1 . 20世纪初德国化学家哈伯(F.Haber)发明工业合成氨,人工制出氮肥,粮食产量显著提高,为解决人类温饱做出重大贡献。回答下列问题:
(1)合成氨的原料H2主要来源于煤的综合利用,如煤的气化: (吸热反应),煤的气化反应过程中能量变化可表示为
(吸热反应),煤的气化反应过程中能量变化可表示为_______ (填字母)。

(2)一种新型的复合光催化剂(CQDs/ 纳米复合物)能以太阳光为能源,使水分解获得
纳米复合物)能以太阳光为能源,使水分解获得 ,其原理如图所示。反应①的化学方程式是
,其原理如图所示。反应①的化学方程式是_______ 。
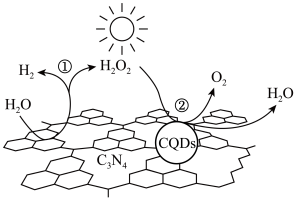
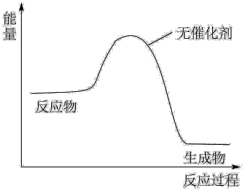
(3)工业合成氨反应过程中的能量变化如图所示。
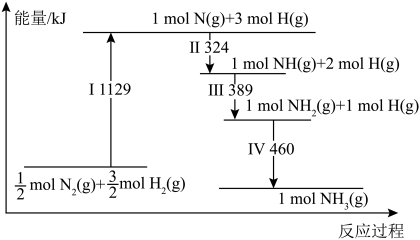
①合成氨反应中,断裂的化学键是_______ (填“极性键”或“非极性键”,下同),形成的化学键是_______ 。
②生成17gNH3时,该反应_______ (填“吸收”或“放出”)的能量为_______ kJ。
(1)合成氨的原料H2主要来源于煤的综合利用,如煤的气化:
 (吸热反应),煤的气化反应过程中能量变化可表示为
(吸热反应),煤的气化反应过程中能量变化可表示为
(2)一种新型的复合光催化剂(CQDs/
 纳米复合物)能以太阳光为能源,使水分解获得
纳米复合物)能以太阳光为能源,使水分解获得 ,其原理如图所示。反应①的化学方程式是
,其原理如图所示。反应①的化学方程式是
(3)工业合成氨反应过程中的能量变化如图所示。

①合成氨反应中,断裂的化学键是
②生成17gNH3时,该反应
您最近半年使用:0次
2 . 在密闭容器里,通入xmolH2和ymolI2(g),改变下列条件,反应速率将如何改变?(填增大或减小或不变)。
(1)升高温度____ 。
(2)加入催化剂____ 。
(3)充入更多的H2____ 。
(4)扩大容器的体积____ 。
(5)容器容积不变,通入氖气____ 。
(1)升高温度
(2)加入催化剂
(3)充入更多的H2
(4)扩大容器的体积
(5)容器容积不变,通入氖气
您最近半年使用:0次
名校
解题方法
3 . 化学反应是有历程的。研究反应机理对于认识反应和调控反应意义重大。
I:NO和H2可以反应生成N2和水蒸气,该反应的历程包含下列两步:
① (慢)
(慢) 
②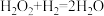 (快)
(快) 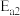
(1)该反应速率由___________ (填①或②)决定。
(2)活化能
___________ 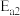 (填“>或<或=”)。
(填“>或<或=”)。
II:催化剂参与反应过程,能加快反应速率。
(3) 的速率很慢,NO和
的速率很慢,NO和 都可以作为该反应的催化剂,发生两步基元反应,快速生成
都可以作为该反应的催化剂,发生两步基元反应,快速生成 。请结合催化剂的特点,写出NO做催化剂时,这两步基元反应的方程式
。请结合催化剂的特点,写出NO做催化剂时,这两步基元反应的方程式___________ 、___________ 。
(4)请在下图中画出加入催化剂时的能量变化过程(在图上画出)(已知该两步反应均为放热反应)______ 。
I:NO和H2可以反应生成N2和水蒸气,该反应的历程包含下列两步:
①
 (慢)
(慢) 
②
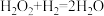 (快)
(快) 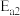
(1)该反应速率由
(2)活化能

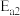 (填“>或<或=”)。
(填“>或<或=”)。II:催化剂参与反应过程,能加快反应速率。
(3)
 的速率很慢,NO和
的速率很慢,NO和 都可以作为该反应的催化剂,发生两步基元反应,快速生成
都可以作为该反应的催化剂,发生两步基元反应,快速生成 。请结合催化剂的特点,写出NO做催化剂时,这两步基元反应的方程式
。请结合催化剂的特点,写出NO做催化剂时,这两步基元反应的方程式(4)请在下图中画出加入催化剂时的能量变化过程(在图上画出)(已知该两步反应均为放热反应)

您最近半年使用:0次
名校
4 . 某中学化学小组查阅资料发现金属氧化物A也能催化氯酸钾的分解,且将A和二氧化锰的催化性能进行了定量对照实验。实验时均以收集满500 mL氧气为准(其他可能影响实验的因素均已忽略)。
表1 用MnO2作催化剂
表2 用A作催化剂
请回答:
上述实验中的待测数据应是_______ 。完成此研究后,他们准备发表一篇研究报告,请你替他们拟一个报告的题目:_______ 。
表1 用MnO2作催化剂
| 实验序号 | KClO3质量(g) | MnO2质量(g) | 反应温度(℃) | 待测数据 |
| 1 | 8.00 | 2.00 | 500 | |
| 2 | 8.00 | 2.00 | 500 |
| 实验序号 | KClO3质量(g) | A质量(g) | 反应温度(℃) | 待测数据 |
| 1 | 8.00 | 2.00 | 500 | |
| 2 | 8.00 | 2.00 | 500 |
上述实验中的待测数据应是
您最近半年使用:0次
5 . 工业合成氨N2(g)+3H2(g)⇌2NH3(g)反应过程中的能量变化如图所示,据图回答下列问题:
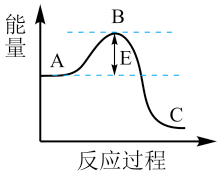
(1)该反应通常用活性铁作催化剂,加活性铁会使图中B点_______ (填“升高”或“降低”),理由是_______
(2)450 ℃时该反应的平衡常数_______ (填“<”、“>”或“=”)500 ℃时的平衡常数。
(3)一定条件下的密闭容器中,该反应达到平衡,要提高H2的转化率,可以采取的合理措施有_______ (填字母代号)。
a.高温高压 b.加入催化剂 c.增加N2的浓度 d.增加H2的浓度 e.分离出NH3

(1)该反应通常用活性铁作催化剂,加活性铁会使图中B点
(2)450 ℃时该反应的平衡常数
(3)一定条件下的密闭容器中,该反应达到平衡,要提高H2的转化率,可以采取的合理措施有
a.高温高压 b.加入催化剂 c.增加N2的浓度 d.增加H2的浓度 e.分离出NH3
您最近半年使用:0次
6 . 研究CO2、H2的开发利用意义重大。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),反应过程中的能量变化情况如图所示。请按要求回答下列问题:
CH3OH(g)+H2O(g),反应过程中的能量变化情况如图所示。请按要求回答下列问题:
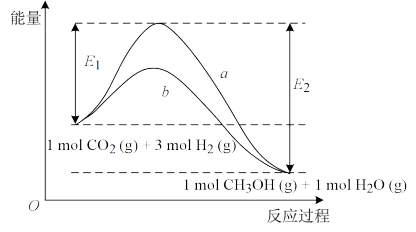
(1)曲线a和曲线b分别表示不使用催化剂和使用催化剂的两种情况。该反应是___ (填“吸热”或“放热”)反应。计算当反应生成2molCH3OH(g)时能量变化是___ (用E1、E2表示)。
(2)选择适宜的催化剂是___ (填“能”或“不能”)改变该反应的能量变化。
(3)下列说法一定正确的是___ (填选项字母)。
A.a与b相比,a表示的反应速度较大
B.反应物断裂化学键吸收的总能量小于生成物形成化学键释放的总能量
C.CO2(g)和H2(g)所具有的总能量一定高于CH3OH(g)和H2O(g)所具有的总能量
(4)推测反应CH3OH(g)+H2O(g) CO2(g)+3H2(g)是
CO2(g)+3H2(g)是___ (填“吸热”或“放热”)反应。
 CH3OH(g)+H2O(g),反应过程中的能量变化情况如图所示。请按要求回答下列问题:
CH3OH(g)+H2O(g),反应过程中的能量变化情况如图所示。请按要求回答下列问题: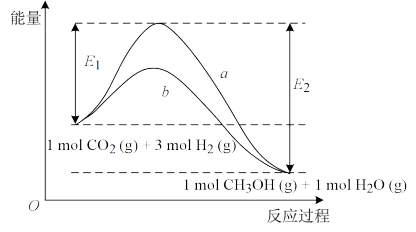
(1)曲线a和曲线b分别表示不使用催化剂和使用催化剂的两种情况。该反应是
(2)选择适宜的催化剂是
(3)下列说法一定正确的是
A.a与b相比,a表示的反应速度较大
B.反应物断裂化学键吸收的总能量小于生成物形成化学键释放的总能量
C.CO2(g)和H2(g)所具有的总能量一定高于CH3OH(g)和H2O(g)所具有的总能量
(4)推测反应CH3OH(g)+H2O(g)
 CO2(g)+3H2(g)是
CO2(g)+3H2(g)是
您最近半年使用:0次
7 . 在下列事实中,各是什么因素影响了化学反应的速率。
(1)黄铁矿煅烧时要粉碎成细小颗粒______________ ;
(2)夏天的食品变霉,在冬天不易发生该现象_____________ ;
(3)同浓度同体积的盐酸中放入同样大小的锌粒和镁块,产生气体快慢程度不同__ ;
(4)同样大小的石灰石分别在0.1 mol·L-1的盐酸和1 mol·L-1的盐酸中反应速度不同_____________ ;
(5)熔化的KClO3放出气泡很慢,撒入MnO2少量很快产生气体__________ ;
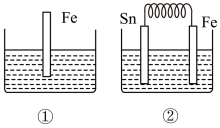
(6)如下图,铁在海水中的腐蚀速度是②比①快______ 。
(1)黄铁矿煅烧时要粉碎成细小颗粒
(2)夏天的食品变霉,在冬天不易发生该现象
(3)同浓度同体积的盐酸中放入同样大小的锌粒和镁块,产生气体快慢程度不同
(4)同样大小的石灰石分别在0.1 mol·L-1的盐酸和1 mol·L-1的盐酸中反应速度不同
(5)熔化的KClO3放出气泡很慢,撒入MnO2少量很快产生气体
(6)如下图,铁在海水中的腐蚀速度是②比①快

您最近半年使用:0次
名校
8 . (1)甲元素位于元素周期表的第3周期Ⅱ A族,乙元素的原子结构示意图为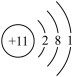
①写乙元素的元素符号:___________ 。
②甲元素原子核外有_________ 个电子层。
③甲元素的金属性(即原子失电子的能力)比乙元素_________ (填“强”或“弱”)。
(2)过氧化氢在适当条件下能发生分解反应:2H2O2=2H2O+O2↑,现进行如下实验探究:在甲、乙两支大小相同的试管中各装入3mL 5%的过氧化氢溶液,再向其中的甲试管中加入少量MnO2粉末。请给合实验现象填写下列空白。
①实验目的:研究催化剂对过氧化氢分解反应速率的影响。
②实验现象:___________ (选填“甲”或“乙”)试管中反应更剧烈,迅速放出无色气体。
③实验结论____________________________________________________ 。

①写乙元素的元素符号:
②甲元素原子核外有
③甲元素的金属性(即原子失电子的能力)比乙元素
(2)过氧化氢在适当条件下能发生分解反应:2H2O2=2H2O+O2↑,现进行如下实验探究:在甲、乙两支大小相同的试管中各装入3mL 5%的过氧化氢溶液,再向其中的甲试管中加入少量MnO2粉末。请给合实验现象填写下列空白。
①实验目的:研究催化剂对过氧化氢分解反应速率的影响。
②实验现象:
③实验结论
您最近半年使用:0次
真题
名校
9 . 反应A(g)+B(g)  C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
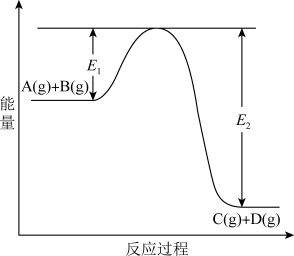
(1)该反应是____________________ 反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率______ (填“增大”“减小”“不变”),原因是_______________________________ ;
(3)反应体系中加入催化剂对反应热是否有影响?________ ,原因是_________ :
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________ ,E2________ (填“增大”“减小、”“不变”)。
 C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
(1)该反应是
(2)当反应达到平衡时,升高温度,A的转化率
(3)反应体系中加入催化剂对反应热是否有影响?
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1
您最近半年使用:0次
2019-01-30更新
|
1402次组卷
|
19卷引用:2008年普通高等学校招生统一考试化学试题(海南卷)
2008年普通高等学校招生统一考试化学试题(海南卷)(已下线)2011-2012学年海南省洋浦中学高二下学期期中考试化学试卷2015-2016学年海南文昌中学高一下期末考化学(理)试题(已下线)2010年河南省长葛三高高二上学期第一次考试化学试题(已下线)2010年山西省山西大学附中高二上学期10月考化学(已下线)2011-2012学年山西省汾阳市高二10月月考化学试卷(已下线)2011-2012学年辽宁省沈阳同泽女中高二上学期期中考试化学试卷(已下线)2011-2012学年山西省汾阳中学高二第二次月考化学试卷(已下线)2014-2015学年山西省太原第五中学高二10月月考化学试卷2015-2016学年山东省临沂市第十九中学高二上10月月考化学试卷2015-2016学年四川阆中中学校高二下第一次段考化学试卷2015-2016学年青海省西宁市第五中学高一下学期期末(理)化学试卷山西省怀仁县第八中学2016-2017学年高一(普通班)下学期期末考试化学试题黑龙江省双鸭山市第一中学2017-2018学年高二9月月考化学试题宁夏育才中学学益校区2017-2018学年高二下学开学考试化学试题【全国百强校】宁夏回族自治区育才中学2018-2019学年高二上学期第一次(9月)月考化学试题山西省运城市稷山中学2019-2020学年高二上学期第一次月考化学试题(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP415(2)】【化学】四川省广安代市中学校2021-2022学年高二上学期第一次月考化学试题
10 . 反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
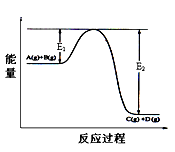
(1)该反应是_________ 反应(填“吸热”或“放热”);
反应热△H=_______ ;(用E1、E2表示)
(2)反应体系中加入催化剂对反应热是否有影响?_________ ,原因是_______________ ;
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化
是:E1_______ ,E2_______ (填 “增大”、“减小”或“不变”)。
 C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
(1)该反应是
反应热△H=
(2)反应体系中加入催化剂对反应热是否有影响?
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化
是:E1
您最近半年使用:0次
2016-12-09更新
|
159次组卷
|
3卷引用:2015-2016学年海南省嘉积中学高二上12月段考化学试卷



