名校
解题方法
1 . 氢气作为一种清洁能源,一直是能源研究的热点,水煤气变换反应可用于大规模制 ,反应原理如下:
,反应原理如下:
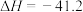 kJ⋅mol
kJ⋅mol
(1)根据下表中提供的数据,计算

 。
。化学键 |
|
|
|
|
键能/kJ·mol | 803 | x | 463 | 436 |
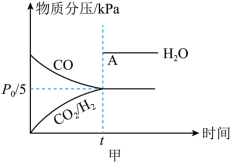
(2)某温度下,在一恒容密闭容器中充入CO和
 ,加入催化剂使其发生上述反应(忽略其他副反应),测得该反应中初始压强为
,加入催化剂使其发生上述反应(忽略其他副反应),测得该反应中初始压强为 ,分压如图甲所示(t时刻前,
,分压如图甲所示(t时刻前, 的分压未给出),则A点坐标为(t,
的分压未给出),则A点坐标为(t,
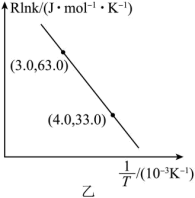
(3)反应
 的Arrhenius经验公式的实验数据如图乙中曲线所示,已知经验公式为
的Arrhenius经验公式的实验数据如图乙中曲线所示,已知经验公式为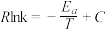 (其中
(其中 为活化能,k为速率常数,R和C为常数)。该反应的活化能
为活化能,k为速率常数,R和C为常数)。该反应的活化能
当使用更高效催化剂时,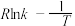
您最近半年使用:0次
解题方法
2 . 我国力争于2030年前实现碳达峰,2060年前实现碳中和,在这种背景下,CO2的利用和转化成为研究重点。回答下列问题:
(1)2021年9月,我国科学家在《科学》杂志发表了二氧化碳人工合成淀粉的研究成果。合成淀粉的重要反应包括二氧化碳制备甲醇的反应: ,该反应在有催化剂和无催化剂作用下的反应机理如图所示(其中标有*的为吸附在催化剂表面上的物种,TS为过渡态):
,该反应在有催化剂和无催化剂作用下的反应机理如图所示(其中标有*的为吸附在催化剂表面上的物种,TS为过渡态):

使用催化剂的曲线是___________ (填“甲”或“乙”),催化剂可使反应历程中决速步骤的活化能降低___________ eV,达到化学平衡后再降低温度,平衡___________ (填“正向”“逆向”或“不”)移动。
(2)一定条件下,向某密闭容器中通入x mol CO2,y mol H2,在催化剂存在下发生反应: 。
。
①恒压条件下,当x:y=___________ 时,平衡体系中CH3OH的体积分数最大。
②恒容条件下,当x=2,y=6,温度为T1K时,反应起始压强为8MPa,经10min,反应达到平衡状态,CO2的平衡转化率为50%。则T1K时平衡常数Kp=___________ 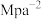 (Kp为以分压表示的平衡常数,分压=总压×物质的量分数),0~10 min内,v(H2)=
(Kp为以分压表示的平衡常数,分压=总压×物质的量分数),0~10 min内,v(H2)=___________  。
。
(1)2021年9月,我国科学家在《科学》杂志发表了二氧化碳人工合成淀粉的研究成果。合成淀粉的重要反应包括二氧化碳制备甲醇的反应:
 ,该反应在有催化剂和无催化剂作用下的反应机理如图所示(其中标有*的为吸附在催化剂表面上的物种,TS为过渡态):
,该反应在有催化剂和无催化剂作用下的反应机理如图所示(其中标有*的为吸附在催化剂表面上的物种,TS为过渡态):
使用催化剂的曲线是
(2)一定条件下,向某密闭容器中通入x mol CO2,y mol H2,在催化剂存在下发生反应:
 。
。①恒压条件下,当x:y=
②恒容条件下,当x=2,y=6,温度为T1K时,反应起始压强为8MPa,经10min,反应达到平衡状态,CO2的平衡转化率为50%。则T1K时平衡常数Kp=
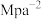 (Kp为以分压表示的平衡常数,分压=总压×物质的量分数),0~10 min内,v(H2)=
(Kp为以分压表示的平衡常数,分压=总压×物质的量分数),0~10 min内,v(H2)= 。
。
您最近半年使用:0次
名校
3 . 将烟气和空气中的 通过催化方式直接还原为甲烷等燃料的过程具有非常重要的意义。
通过催化方式直接还原为甲烷等燃料的过程具有非常重要的意义。
I.光催化还原
(1)华中科技大学某团队构建了一种光催化剂使 和
和 反应生成
反应生成 和
和 ,其中
,其中 的转化率约为
的转化率约为 ,写出该化学方程式:
,写出该化学方程式:________________ 。
II.热催化还原——萨巴蒂尔反应:
 时,在一恒容密闭容器中通入
时,在一恒容密闭容器中通入 、
、 ,至其分压分别为
,至其分压分别为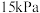 、
、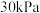 ,再加入催化剂并加热使其发生萨巴蒂尔反应。
,再加入催化剂并加热使其发生萨巴蒂尔反应。
(2)为使固体催化剂与反应物充分接触,应采取的措施是________________ 。
(3)写出该反应的平衡常数表达式:
________________ 。(用浓度表示)。
(4)研究表明 的反应速率
的反应速率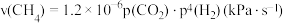 ,某时刻测得
,某时刻测得 的分压为
的分压为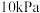 ,则该时刻
,则该时刻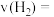
________  。
。
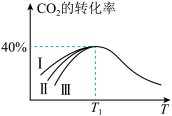
(5)相同时间内,不同催化剂(I、II、III)下,测得 的转化率如图所示。在
的转化率如图所示。在 时,不同催化剂下,
时,不同催化剂下, 的转化率相同的原因是
的转化率相同的原因是________________ 。
(6) 光催化还原和热催化还原法中更好的是
光催化还原和热催化还原法中更好的是________ ,简述理由:________ (答一条即可)。
 通过催化方式直接还原为甲烷等燃料的过程具有非常重要的意义。
通过催化方式直接还原为甲烷等燃料的过程具有非常重要的意义。I.光催化还原
(1)华中科技大学某团队构建了一种光催化剂使
 和
和 反应生成
反应生成 和
和 ,其中
,其中 的转化率约为
的转化率约为 ,写出该化学方程式:
,写出该化学方程式:II.热催化还原——萨巴蒂尔反应:
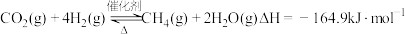
 时,在一恒容密闭容器中通入
时,在一恒容密闭容器中通入 、
、 ,至其分压分别为
,至其分压分别为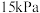 、
、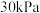 ,再加入催化剂并加热使其发生萨巴蒂尔反应。
,再加入催化剂并加热使其发生萨巴蒂尔反应。(2)为使固体催化剂与反应物充分接触,应采取的措施是
(3)写出该反应的平衡常数表达式:

(4)研究表明
 的反应速率
的反应速率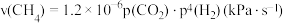 ,某时刻测得
,某时刻测得 的分压为
的分压为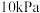 ,则该时刻
,则该时刻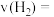
 。
。(5)相同时间内,不同催化剂(I、II、III)下,测得
 的转化率如图所示。在
的转化率如图所示。在 时,不同催化剂下,
时,不同催化剂下, 的转化率相同的原因是
的转化率相同的原因是
(6)
 光催化还原和热催化还原法中更好的是
光催化还原和热催化还原法中更好的是
您最近半年使用:0次
解题方法
4 . 过氧化氢是一种常用的绿色试剂,某学习小组针对 性质进行如下实验。
性质进行如下实验。
I.验证 的还原性
的还原性
查阅资料: 溶液与氯水发生反应时表现还原性。
溶液与氯水发生反应时表现还原性。
(1)制取氯水
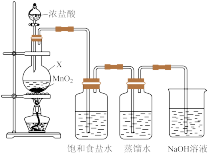
①仪器X的名称是_________ ,生成 的化学方程式为
的化学方程式为 _________ 。
②饱和食盐水的作用是_________ 。
(2)取5mL上述新制饱和氯水于试管中,向其中加入 溶液至过量,产生大量气泡
溶液至过量,产生大量气泡 该气体可使余烬复燃
该气体可使余烬复燃 ,还观察到溶液颜色发生的变化是
,还观察到溶液颜色发生的变化是 _________ 。
Ⅱ.探究 、
、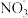 对
对 分解的影响
分解的影响
选用 溶液和
溶液和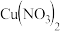 溶液,探究
溶液,探究 、
、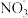 对
对 分解的影响。记录数据如下:
分解的影响。记录数据如下:
(3)实验结果显示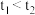 ,可得出的结论是:
,可得出的结论是:_________  填化学式
填化学式 更有利于
更有利于 分解。
分解。
(4)甲同学查阅资料得知: 能加速
能加速 分解,
分解, 对
对 分解无影响。为排除
分解无影响。为排除 干扰,该同学进行实验:向两份
干扰,该同学进行实验:向两份 溶液中分别加入amL浓度均为
溶液中分别加入amL浓度均为 _________ 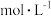 的
的 _________  填化学式
填化学式 溶液和
溶液和 _________  填化学式
填化学式 溶液。
溶液。 内,发现
内,发现 均几乎不分解。甲同学认为:在无
均几乎不分解。甲同学认为:在无 存在的情况下,
存在的情况下, 、
、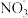 对
对 催化分解无影响。
催化分解无影响。
 性质进行如下实验。
性质进行如下实验。I.验证
 的还原性
的还原性查阅资料:
 溶液与氯水发生反应时表现还原性。
溶液与氯水发生反应时表现还原性。(1)制取氯水

①仪器X的名称是
 的化学方程式为
的化学方程式为 ②饱和食盐水的作用是
(2)取5mL上述新制饱和氯水于试管中,向其中加入
 溶液至过量,产生大量气泡
溶液至过量,产生大量气泡 该气体可使余烬复燃
该气体可使余烬复燃 ,还观察到溶液颜色发生的变化是
,还观察到溶液颜色发生的变化是 Ⅱ.探究
 、
、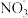 对
对 分解的影响
分解的影响选用
 溶液和
溶液和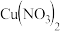 溶液,探究
溶液,探究 、
、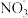 对
对 分解的影响。记录数据如下:
分解的影响。记录数据如下: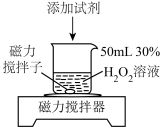 | 实验序号 | 添加试剂及用量 |  完全分解所需时间 完全分解所需时间 |
| 1 | 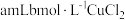 溶液 溶液 | 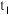 | |
| 2 | 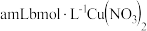 溶液 溶液 | 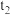 |
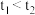 ,可得出的结论是:
,可得出的结论是: 填化学式
填化学式 更有利于
更有利于 分解。
分解。(4)甲同学查阅资料得知:
 能加速
能加速 分解,
分解, 对
对 分解无影响。为排除
分解无影响。为排除 干扰,该同学进行实验:向两份
干扰,该同学进行实验:向两份 溶液中分别加入amL浓度均为
溶液中分别加入amL浓度均为 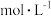 的
的  填化学式
填化学式 溶液和
溶液和  填化学式
填化学式 溶液。
溶液。 内,发现
内,发现 均几乎不分解。甲同学认为:在无
均几乎不分解。甲同学认为:在无 存在的情况下,
存在的情况下, 、
、 对
对 催化分解无影响。
催化分解无影响。
您最近半年使用:0次
2022-12-13更新
|
111次组卷
|
2卷引用:海南省白沙县2023届高三水平调研测试化学试题
名校
5 . 过二硫酸钾(K2S2O8)是白色晶体,遇水易潮解、受热易分解,是一种重要的氧化剂。某学习小组通过查阅文献和实验探究过二硫酸钾的性质。
I.查阅文献知,①1个K2S2O8中存在1个过氧键(—O—O—);②氧化性:S2O >MnO
>MnO
(1)K2S2O8中S的化合价为____ 。
(2)在稀硫酸酸化的MnSO4溶液(无色)中滴加1滴AgNO3溶液作催化剂,再滴加K2S2O8溶液,实验现象是____ ,该反应的离子方程式为____ 。
II.探究过二硫酸钾的不稳定性。
已知SO3、SO2的熔点、沸点如表所示:
取适量的K2S2O8装入硬质玻璃管中,加热,得到三种常见物质。将分解产物依次通过装置B、C、D,实验中发现B中产生无色液体,接着无色液体慢慢变成固体;C中溶液颜色无明显变化,D中溶液逐渐变为蓝色。
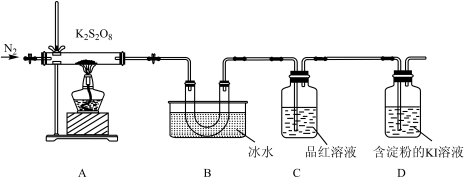
(3)加热之前,先通入一段时间N2,其目的是____ 。当观察到D装置中出现连续气泡时点燃酒精灯。
(4)B装置中集气瓶收集的物质主要成分是____ (填化学式)。
(5)当A装置中硬质玻璃管中固体完全分解时,停止加热,待冷却至室温时取少量残留固体于试管中,加入蒸馏水,溶解后滴加BaCl2溶液和盐酸,产生白色沉淀。写出A装置中K2S2O8分解反应的化学方程式:____ 。
I.查阅文献知,①1个K2S2O8中存在1个过氧键(—O—O—);②氧化性:S2O
 >MnO
>MnO
(1)K2S2O8中S的化合价为
(2)在稀硫酸酸化的MnSO4溶液(无色)中滴加1滴AgNO3溶液作催化剂,再滴加K2S2O8溶液,实验现象是
II.探究过二硫酸钾的不稳定性。
已知SO3、SO2的熔点、沸点如表所示:
| 气体 | SO3 | SO2 |
| 熔点/℃ | 16.8 | -72.7 |
| 沸点/℃ | 44.8 | -10 |

(3)加热之前,先通入一段时间N2,其目的是
(4)B装置中集气瓶收集的物质主要成分是
(5)当A装置中硬质玻璃管中固体完全分解时,停止加热,待冷却至室温时取少量残留固体于试管中,加入蒸馏水,溶解后滴加BaCl2溶液和盐酸,产生白色沉淀。写出A装置中K2S2O8分解反应的化学方程式:
您最近半年使用:0次
2022-04-26更新
|
259次组卷
|
2卷引用:海南省海口市2021-2022学年高三下学期学生学科能力诊断化学试题
名校
解题方法
6 . 实验小组欲通过测定单位时间内生成 的速率,探究某种影响化学反应速率的因素,设计实验方案如下:
的速率,探究某种影响化学反应速率的因素,设计实验方案如下:
【实验原理】2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
请回答:
(1)该反应的离子方程式______________________________________________ 。
(2)该实验目的是探究_______________________________________________
(3)V=_________ 
(4)利用实验1中数据计算,用 的浓度变化表示的反应速率
的浓度变化表示的反应速率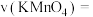
______________ mol/(L·min) 。
(5)该小组同学根据经验绘制了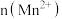 随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中
随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中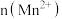 随时间变化的趋势应如图2所示.该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
随时间变化的趋势应如图2所示.该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
①甲同学提出的假设是_______________________________________________ 。
②请你帮助该小组同学完成实验方案,并填写表中空白。
③若甲同学提出的假设成立,再向试管中加入少量该固体后,应观察到的现象与实验1比较,溶液褪色所需时间比4min_________ (填“短”、“长”或“相同”)。
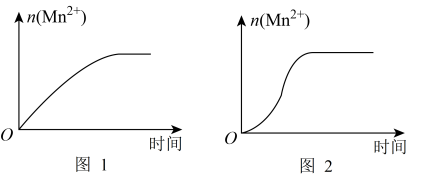
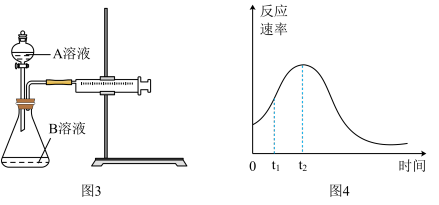
(6)乙同学用图3装置开展实验,发现反应速率总是图4,其中t1~t2时间内速率变快。乙同学认为主要原因可能存在甲提出的假设成立外,还可能有其他原因________________________ 。
 的速率,探究某种影响化学反应速率的因素,设计实验方案如下:
的速率,探究某种影响化学反应速率的因素,设计实验方案如下:【实验原理】2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量 | 室温下溶液颜色褪至无色所需时间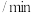 | |||
0.6 mol/L 溶液 溶液 |  |  溶液 溶液 | 3 mol/L 稀硫酸 | ||
| 1 |  |  |  |  |  |
| 2 |  | 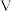 |  |  | 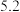 |
| 3 |  |  | 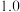 |  |  |
(1)该反应的离子方程式
(2)该实验目的是探究
(3)V=

(4)利用实验1中数据计算,用
 的浓度变化表示的反应速率
的浓度变化表示的反应速率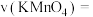
(5)该小组同学根据经验绘制了
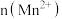 随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中
随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中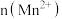 随时间变化的趋势应如图2所示.该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
随时间变化的趋势应如图2所示.该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
①甲同学提出的假设是
②请你帮助该小组同学完成实验方案,并填写表中空白。
| 实验编号 | 室温下,试管中所加试剂及其用量 | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间 | |||
0.6mol/L 溶液 溶液 |  | 0.2mol/L KMnO4溶液 | 3mol/L 稀硫酸 | |||
| 4 |  |  |  |  | MnSO4 | t |
(6)乙同学用图3装置开展实验,发现反应速率总是图4,其中t1~t2时间内速率变快。乙同学认为主要原因可能存在甲提出的假设成立外,还可能有其他原因

您最近半年使用:0次
名校
解题方法
7 . H2O2是一种绿色消毒剂,在公共卫生事业中发挥了重要的作用。已知反应:H2O2 (l)= H2O(1) + O2(g) △H=-98 kJ/mol,K= 2.88×1020。回答问题:
O2(g) △H=-98 kJ/mol,K= 2.88×1020。回答问题:
(1)H2O2的强氧化性使其对大多数致病菌和病毒具有消杀功能。用3%医用H2O2 对传染病房喷洒消毒时,地板上有气泡冒出,该气体是_______ 。
(2)纯H2O2 可作为民用驱雹火箭推进剂。在火箭喷口铂网催化下,H2O2 剧烈分解:H2O2(l)=H2O(g)+ O2(g),放出大量气体,驱动火箭升空。每消耗 34g H2O2,理论上
O2(g),放出大量气体,驱动火箭升空。每消耗 34g H2O2,理论上______ (填“放出”或“吸收”)热量________ 98 kJ(填“大于”、“小于”或“等于”)。
(3)纯H2O2 相对稳定,实验表明在 54℃下恒温贮存2周,浓度仍能保持99%,原因是 H2O2 分解反应的_______ (填编号)。
a.ΔH比较小 b.K不够大 c.速率比较小 d.活化能比较大
(4)铜单质不溶于稀硫酸,向铜和稀硫酸的混合物中加入3% H2O2 溶液,可观察到铜溶解,溶液变蓝,实验室测得6.4g铜溶解放出24.258KJ热量,写出该反应的热化学方程式_______ 。
(5)向 H2O2 稀溶液中滴加数滴含 Mn2+的溶液,即有气泡快速逸出,反应中 Mn2+起______ 作用。某组实验数据如下:
0-30 min H2O2 反应的平均速率 v=_____ mol /(L·min) 。
 O2(g) △H=-98 kJ/mol,K= 2.88×1020。回答问题:
O2(g) △H=-98 kJ/mol,K= 2.88×1020。回答问题:(1)H2O2的强氧化性使其对大多数致病菌和病毒具有消杀功能。用3%医用H2O2 对传染病房喷洒消毒时,地板上有气泡冒出,该气体是
(2)纯H2O2 可作为民用驱雹火箭推进剂。在火箭喷口铂网催化下,H2O2 剧烈分解:H2O2(l)=H2O(g)+
 O2(g),放出大量气体,驱动火箭升空。每消耗 34g H2O2,理论上
O2(g),放出大量气体,驱动火箭升空。每消耗 34g H2O2,理论上(3)纯H2O2 相对稳定,实验表明在 54℃下恒温贮存2周,浓度仍能保持99%,原因是 H2O2 分解反应的
a.ΔH比较小 b.K不够大 c.速率比较小 d.活化能比较大
(4)铜单质不溶于稀硫酸,向铜和稀硫酸的混合物中加入3% H2O2 溶液,可观察到铜溶解,溶液变蓝,实验室测得6.4g铜溶解放出24.258KJ热量,写出该反应的热化学方程式
(5)向 H2O2 稀溶液中滴加数滴含 Mn2+的溶液,即有气泡快速逸出,反应中 Mn2+起
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| c(H2O2)/mol /L | 0.70 | 0.49 | 0.35 | 0.25 | 0.17 | 0.12 |
您最近半年使用:0次
名校
解题方法
8 . 某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:用10mL H2O2制取150mLO2所需的时间(秒)
①该研究小组在设计方案时。考虑了浓度、___________ 、____________ 等因素对过氧化氢分解速率的影响。
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?_______________________ 。
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%(密度为1.0g/cm3)的双氧水中,并用带火星的木条测试。测定结果如下:
① 写出H2O2发生分解的化学反应方程式________________ 。求出实验A中H2O2在5分钟内的平均反应速率________________ 。(结果保留小数点后两位数字)
② 实验结果说明催化剂作用的大小与____________________ 有关。
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:用10mL H2O2制取150mLO2所需的时间(秒)
 | 30% H2O2 | 15% H2O2 | 10% H2O2 | 5% H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%(密度为1.0g/cm3)的双氧水中,并用带火星的木条测试。测定结果如下:
| 实验 序号 | 催化剂(MnO2) | 操作 情况 | 观察结果 | 反应完成 所需的时间 |
| A | 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 5分钟 |
| B | 块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
② 实验结果说明催化剂作用的大小与
您最近半年使用:0次
名校
9 . 某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
(1)通过实验A、B,可探究出浓度的改变对反应速率的影响,其中V1=_________ ,T1=_______ ;通过实验___________ 可探究出温度变化对化学反应速率的影响。
(2)C组实验中溶液褪色时间t1______ (填“>”或“<”)8s,C组实验的反应速率v(KMnO4) = _________________ 。(用含有t1的式子表示)
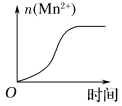
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间变化的趋势如图所示,并以此分析造成n(Mn2+)突变的可能的原因是:______________ 。
| 实验 序号 | 实验温度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
| KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | |||||
| V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
| A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | 6 |
| B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
| C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t1 |
(1)通过实验A、B,可探究出浓度的改变对反应速率的影响,其中V1=
(2)C组实验中溶液褪色时间t1
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间变化的趋势如图所示,并以此分析造成n(Mn2+)突变的可能的原因是:

您最近半年使用:0次
2019-06-06更新
|
805次组卷
|
7卷引用:海南省海口市第四中学2020-2021学年高二上学期第一次月考化学试题
名校
10 . (1)为准确测定中和热,除了提供的酸和碱溶液的浓度与体积必须准确外,在实验过程中的另外两个重要措施是:_______________ 、 _________________
(1)在草酸溶液中加入酸性高锰酸钾溶液,发生如下反应。请配平:____________
 MnO4- +
MnO4- + H+ +
H+ + C2O42-=
C2O42-=  Mn2+ +
Mn2+ + CO2 ↑+
CO2 ↑+ H2O
H2O
该反应开始时速率较慢,但一段时间后,紫色突然褪去,其主要原因是:_______________________________________________________________
(3)反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)△H>0 在一容积可变的密闭容器中进行,试回答:
Fe3O4(s)+4H2(g)△H>0 在一容积可变的密闭容器中进行,试回答:
①此反应的平衡常数表达式为___________________ 。若使平衡常数增大,可采取的措施是____________________ 。
②保持压强不变,充入N2,其正反应速率_________ ,(填“增大”、“不变”、“减小”)逆反应速率___________ 。(填“增大”、“不变”、“减小”)
(1)在草酸溶液中加入酸性高锰酸钾溶液,发生如下反应。请配平:
 MnO4- +
MnO4- + H+ +
H+ + C2O42-=
C2O42-=  Mn2+ +
Mn2+ + CO2 ↑+
CO2 ↑+ H2O
H2O 该反应开始时速率较慢,但一段时间后,紫色突然褪去,其主要原因是:
(3)反应3Fe(s)+4H2O(g)
 Fe3O4(s)+4H2(g)△H>0 在一容积可变的密闭容器中进行,试回答:
Fe3O4(s)+4H2(g)△H>0 在一容积可变的密闭容器中进行,试回答:①此反应的平衡常数表达式为
②保持压强不变,充入N2,其正反应速率
您最近半年使用:0次







