1 . 用 还原
还原 可合成
可合成 。回答下列问题:
。回答下列问题:
(1)利用 光解水制
光解水制 具有重要的经济价值,原理如图所示。
具有重要的经济价值,原理如图所示。 表面发生的电极反应式为
表面发生的电极反应式为_____ 。
写出 还原
还原 生成
生成 和
和 的热化学方程式:
的热化学方程式:_____ 。
(3)一定条件下,向某恒容密闭容器中充入2
 和3
和3
 反应生成
反应生成 和
和 ,起始时压强为
,起始时压强为 ,测得在相同时间内不同温度下
,测得在相同时间内不同温度下 的转化率如图所示。
的转化率如图所示。_____ 。
② K时,该反应的平衡常数
K时,该反应的平衡常数
_____ (列出计算式即可,不必化简。以分压代替浓度,分压=总压×物质的量分数)。
(4)为了探究浓度对反应速率的影响,473K时,向某恒容密闭容器中充入 和
和 进行实验,实验数据如下表所示:
进行实验,实验数据如下表所示:
该反应速率的通式为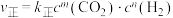 ,
,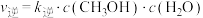 (
( 、
、 是只与温度有关的速率常数)。由表中数据可确定反应速率通式中
是只与温度有关的速率常数)。由表中数据可确定反应速率通式中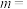
_____ 、
_____ 。实验发现,当实验1中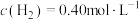 时达到平衡,请计算该温度下此反应的
时达到平衡,请计算该温度下此反应的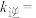
_____ 。
 还原
还原 可合成
可合成 。回答下列问题:
。回答下列问题:(1)利用
 光解水制
光解水制 具有重要的经济价值,原理如图所示。
具有重要的经济价值,原理如图所示。 表面发生的电极反应式为
表面发生的电极反应式为
| 共价键 |  |  |  |  |  |
键能/( ) ) | 464 | 358 | 799 | 432 | 411 |
 还原
还原 生成
生成 和
和 的热化学方程式:
的热化学方程式:(3)一定条件下,向某恒容密闭容器中充入2

 和3
和3
 反应生成
反应生成 和
和 ,起始时压强为
,起始时压强为 ,测得在相同时间内不同温度下
,测得在相同时间内不同温度下 的转化率如图所示。
的转化率如图所示。
②
 K时,该反应的平衡常数
K时,该反应的平衡常数
(4)为了探究浓度对反应速率的影响,473K时,向某恒容密闭容器中充入
 和
和 进行实验,实验数据如下表所示:
进行实验,实验数据如下表所示:| 实验 | 起始浓度/( ) ) | 初始速率/( ) ) | |
 |  | ||
| 1 | 0.25 | 1.00 | 0.45 |
| 2 | 0.25 | 2.00 | 3.60 |
| 3 | 2.00 | 1.00 | 3.6 |
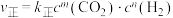 ,
,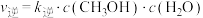 (
( 、
、 是只与温度有关的速率常数)。由表中数据可确定反应速率通式中
是只与温度有关的速率常数)。由表中数据可确定反应速率通式中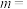

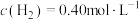 时达到平衡,请计算该温度下此反应的
时达到平衡,请计算该温度下此反应的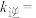
您最近半年使用:0次
名校
解题方法
2 . 某研究团队以NO和H2为原料,在Fe基催化下有效地合成NH3.回答下列问题:
已知:①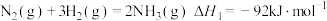
②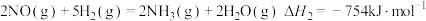
(1)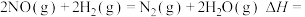
___________  。
。
(2)在一定温度下,向一恒容密闭容器中充入0.2molNO(g)和0.5molH2(g),只发生反应②,达到平衡时生成1.7gNH3(g)。下列叙述正确的是___________ (填标号)。
A.当容器内总压强不变时,该反应达到平衡
B.达到平衡时,反应体系放出的热量为37.7kJ
C.平衡后再充入0.2molNO(g)和0.5molH2(g),NO平衡转化率减小
(3)研究发现, 分两步进行:
分两步进行:
第1步: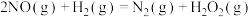 (慢反应);
(慢反应);
第2步:___________ (补充)(快反应)。
加入催化剂,主要是降低第___________ (填“1”或“2”)步反应活化能。
(4) 的反应速率方程式为
的反应速率方程式为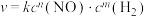 (其中,k为常数,只与温度和催化剂有关)。为了测定反应级数m、n,实验结果如下:
(其中,k为常数,只与温度和催化剂有关)。为了测定反应级数m、n,实验结果如下:
根据上述数据计算:m=___________ ,n=___________ ,c=___________ 。
(5)在一密闭反应器中充入2molNO(g)和5molH2(g),在催化剂10Fe﹣8Cu/TiO2作用下发生反应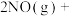
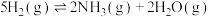 ,
, ,实验测得NO转化率和NH3选择性与温度的关系如图所示。
,实验测得NO转化率和NH3选择性与温度的关系如图所示。

温度高于350℃时,NO转化率增大,但NH3选择性降低,主要原因是___________ 。a点时生成NH3的物质的量为___________ (结果保留3位有效数字)。
(6)某温度下,保持总压强为100kPa,向反应器中充入2molNO(g)和6molH2(g),只发生反应:(a)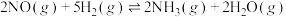 ,(b)
,(b) ,达到平衡时NO转化率为60%,NH3选择性为80%。反应(b)的平衡常数
,达到平衡时NO转化率为60%,NH3选择性为80%。反应(b)的平衡常数
___________  (计算结果保留三位有效数字)。
(计算结果保留三位有效数字)。
已知:①
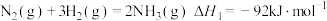
②
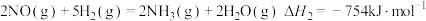
(1)
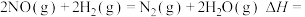
 。
。(2)在一定温度下,向一恒容密闭容器中充入0.2molNO(g)和0.5molH2(g),只发生反应②,达到平衡时生成1.7gNH3(g)。下列叙述正确的是
A.当容器内总压强不变时,该反应达到平衡
B.达到平衡时,反应体系放出的热量为37.7kJ
C.平衡后再充入0.2molNO(g)和0.5molH2(g),NO平衡转化率减小
(3)研究发现,
 分两步进行:
分两步进行:第1步:
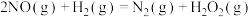 (慢反应);
(慢反应);第2步:
加入催化剂,主要是降低第
(4)
 的反应速率方程式为
的反应速率方程式为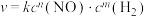 (其中,k为常数,只与温度和催化剂有关)。为了测定反应级数m、n,实验结果如下:
(其中,k为常数,只与温度和催化剂有关)。为了测定反应级数m、n,实验结果如下:| 序号 | 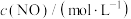 | 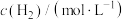 | 速率 |
| I | 0.1 | 0.1 | v |
| II | 0.2 | 0.1 | 4v |
| III | 0.2 | 0.2 | 8v |
| IV | c | 0.4 | 36v |
(5)在一密闭反应器中充入2molNO(g)和5molH2(g),在催化剂10Fe﹣8Cu/TiO2作用下发生反应
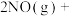
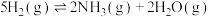 ,
, ,实验测得NO转化率和NH3选择性与温度的关系如图所示。
,实验测得NO转化率和NH3选择性与温度的关系如图所示。
温度高于350℃时,NO转化率增大,但NH3选择性降低,主要原因是
(6)某温度下,保持总压强为100kPa,向反应器中充入2molNO(g)和6molH2(g),只发生反应:(a)
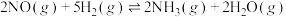 ,(b)
,(b) ,达到平衡时NO转化率为60%,NH3选择性为80%。反应(b)的平衡常数
,达到平衡时NO转化率为60%,NH3选择性为80%。反应(b)的平衡常数
 (计算结果保留三位有效数字)。
(计算结果保留三位有效数字)。
您最近半年使用:0次
2024-01-19更新
|
156次组卷
|
3卷引用:2024届青海省协作联考高三上学期一模理综试题
解题方法
3 . 在室温下,Ti不与O2、H2O、强碱、强酸反应,在高温下可与O2反应。Hunter法是最早研究用来制取金属钛的方法,其流程如下图所示。回答下列问题:
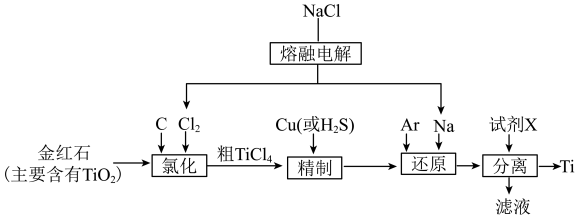
(1)“氯化”是在1000~1050℃下进行,碳被氧化为CO,该反应的化学方程式为___________ 。
(2)“精制”时,粗 中含有大量杂质,可用精馏的方法提纯,对于沸点相近的
中含有大量杂质,可用精馏的方法提纯,对于沸点相近的 杂质可用铜(或
杂质可用铜(或 )将其转化为
)将其转化为 沉淀,反应机理为
沉淀,反应机理为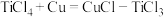 ,
,
 。从总反应看,
。从总反应看, 是该反应的
是该反应的___________ ; 可与
可与 直接反应生成
直接反应生成 ,写出
,写出 与
与 发生反应的化学方程式:
发生反应的化学方程式:___________ 。
(3)“钠还原”是用液态钠还原气态 得到Ti,Ar的作用是
得到Ti,Ar的作用是___________ ;若发生 、
、 等副反应,其原因可能是
等副反应,其原因可能是___________ 。
(4)“分离”时,固体混合物需经取出、破碎、酸浸、过滤、洗涤及干燥等步骤,试剂X为___________ (填名称),滤液循环使用的方法是___________ 。

(1)“氯化”是在1000~1050℃下进行,碳被氧化为CO,该反应的化学方程式为
(2)“精制”时,粗
 中含有大量杂质,可用精馏的方法提纯,对于沸点相近的
中含有大量杂质,可用精馏的方法提纯,对于沸点相近的 杂质可用铜(或
杂质可用铜(或 )将其转化为
)将其转化为 沉淀,反应机理为
沉淀,反应机理为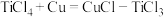 ,
,
 。从总反应看,
。从总反应看, 是该反应的
是该反应的 可与
可与 直接反应生成
直接反应生成 ,写出
,写出 与
与 发生反应的化学方程式:
发生反应的化学方程式:(3)“钠还原”是用液态钠还原气态
 得到Ti,Ar的作用是
得到Ti,Ar的作用是 、
、 等副反应,其原因可能是
等副反应,其原因可能是(4)“分离”时,固体混合物需经取出、破碎、酸浸、过滤、洗涤及干燥等步骤,试剂X为
您最近半年使用:0次
解题方法
4 . 无论是在环境保护还是工农业生产方面,氮及其化合物一直是我国科研重点。
已知:反应i. 6NO(g)+4NH3(g)⇌5N2(g)+6H2O(g) ΔH1=−1808kJ·mol−1;
反应ii. N2(g)+3H2(g)⇌2NH3(g) ΔH2=−91.4kJ·mol−1。
部分化学键键能如下表所示:
回答下列问题:
(1)NO中氮氧键键能为_______ 。
(2)向2L刚性密闭容器中充入0.06molNO(g)和0.04molNH3(g),发生反应i.不同温度下,测得10min时NO的转化率如图1所示。

①T1K下反应i的平均反应速率v(NO)=_______ mol·L-1·min-1(用含α1的代数式表示);
②NH3和NO(g)的有效碰撞几率M_______ N(填“>”“=”或“<”)原因为_______ ;
③NO转化率先升高后降低的原因为_______ ;
(3)固氮在工农业生产中具有重要意义:
①反应i是工业固氮的反应原理合成氨的速率公式为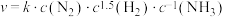 。其中k为反应速率常数:下列条件能影响k值大小的是
。其中k为反应速率常数:下列条件能影响k值大小的是_______ (填选项字母)
A.反应温度 B.反应物的浓度 C.反应压强 D.催化剂
②某固氮反应机理如图2所示:
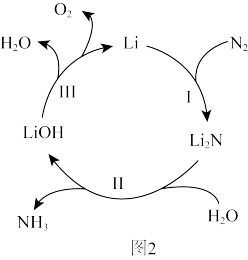
该固氮的总反应方程式为_______ ;已知三步反应的活化能由大到小的顺序为Ⅲ>Ⅰ>Ⅱ则该固氮过程的决速步骤为_______ (填“I”“Ⅱ”或“Ⅲ”);
已知:反应i. 6NO(g)+4NH3(g)⇌5N2(g)+6H2O(g) ΔH1=−1808kJ·mol−1;
反应ii. N2(g)+3H2(g)⇌2NH3(g) ΔH2=−91.4kJ·mol−1。
部分化学键键能如下表所示:
| 化学键 | N—H |  | H—O |
| 键能/ kJ·mol−1 | 390 | 946 | 463 |
(1)NO中氮氧键键能为
(2)向2L刚性密闭容器中充入0.06molNO(g)和0.04molNH3(g),发生反应i.不同温度下,测得10min时NO的转化率如图1所示。

①T1K下反应i的平均反应速率v(NO)=
②NH3和NO(g)的有效碰撞几率M
③NO转化率先升高后降低的原因为
(3)固氮在工农业生产中具有重要意义:
①反应i是工业固氮的反应原理合成氨的速率公式为
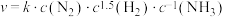 。其中k为反应速率常数:下列条件能影响k值大小的是
。其中k为反应速率常数:下列条件能影响k值大小的是A.反应温度 B.反应物的浓度 C.反应压强 D.催化剂
②某固氮反应机理如图2所示:

该固氮的总反应方程式为
您最近半年使用:0次
名校
5 . 研究化学反应速率是为了控制化学反应速率,使生产、生活中的大部分化学反应的速率都尽可能随着人们的意向改变。回答下列问题:
(1)某同学为探究 分解的影响因素(温度为
分解的影响因素(温度为 ,控制温度装置已省略)设计如图实验,不同时间测得的实验数据如表(
,控制温度装置已省略)设计如图实验,不同时间测得的实验数据如表( 的起始浓度为
的起始浓度为 )。
)。
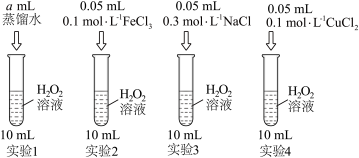
①
___________ 。
②探究 对
对 分解速率的影响,应选择的实验有实验2、
分解速率的影响,应选择的实验有实验2、___________ ,实验前10min平均反应速率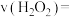
___________  ,实验2还能验证
,实验2还能验证___________ 对反应速率的影响。
③在②的基础上,实验2、实验4对比证明了___________ (填“ ”或“
”或“ ”)的催化能力较强。
”)的催化能力较强。
(2) 分解的化学方程式为
分解的化学方程式为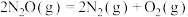 ,该反应生成物的总能量小于反应物的总能量。将
,该反应生成物的总能量小于反应物的总能量。将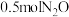 置于某恒容绝热反应器中发生该反应,反应速率与时间的关系如图。
置于某恒容绝热反应器中发生该反应,反应速率与时间的关系如图。
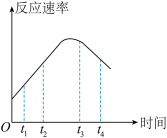
① 反应速率增加的原因是
反应速率增加的原因是___________ 。
②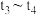 反应速率降低的原因是
反应速率降低的原因是___________ 。
(1)某同学为探究
 分解的影响因素(温度为
分解的影响因素(温度为 ,控制温度装置已省略)设计如图实验,不同时间测得的实验数据如表(
,控制温度装置已省略)设计如图实验,不同时间测得的实验数据如表( 的起始浓度为
的起始浓度为 )。
)。
时间/min 浓度/ 实验编号 | 0 | 2 | 10 | 15 | 20 |
| 1 | 1 | 几乎无变化 | 几乎无变化 | 几乎无变化 | 几乎无变化 |
| 2 | 1 | 0.80 | 0.65 | 0.52 | 0.40 |
| 3 | 1 | 几乎无变化 | 几乎无变化 | 几乎无变化 | 几乎无变化 |
| 4 | 1 | 0.90 | 0.82 | 0.75 | 0.70 |

②探究
 对
对 分解速率的影响,应选择的实验有实验2、
分解速率的影响,应选择的实验有实验2、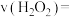
 ,实验2还能验证
,实验2还能验证③在②的基础上,实验2、实验4对比证明了
 ”或“
”或“ ”)的催化能力较强。
”)的催化能力较强。(2)
 分解的化学方程式为
分解的化学方程式为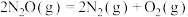 ,该反应生成物的总能量小于反应物的总能量。将
,该反应生成物的总能量小于反应物的总能量。将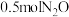 置于某恒容绝热反应器中发生该反应,反应速率与时间的关系如图。
置于某恒容绝热反应器中发生该反应,反应速率与时间的关系如图。
①
 反应速率增加的原因是
反应速率增加的原因是②
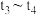 反应速率降低的原因是
反应速率降低的原因是
您最近半年使用:0次
2021-07-21更新
|
229次组卷
|
2卷引用:青海省西宁市大通回族土族自治县2020-2021学年高一下学期期末联考化学试题
名校
解题方法
6 . 反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
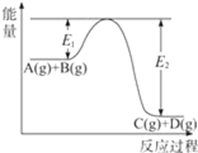
(1)该反应是_________ (填“吸热”“放热”)反应。
(2)反应达到平衡时,升高温度,A的转化率____ (填“增大”“减小”或“不变”)。
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1____________________ E2-E1__________________ (填“增大”“减小”或“不变”)。
(4)在火箭推进器中装有肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量的气体,并放出大量热。已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量。写出该反应的热化学方程式____________________________________ 。
(5)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_____________________________ 。
 C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
(1)该反应是
(2)反应达到平衡时,升高温度,A的转化率
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1
(4)在火箭推进器中装有肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量的气体,并放出大量热。已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量。写出该反应的热化学方程式
(5)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
您最近半年使用:0次



