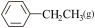名校
1 . 炼油、石化等工业会产生含硫(-2价)废水,处理的方法有沉淀法、氧化法。
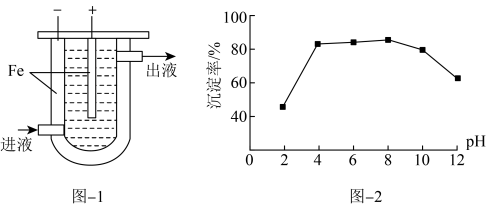
Ⅰ.沉淀法。用如下图-1装置可以将废水中的硫转化为FeS沉淀。控制其他条件一定,测得出口处硫转化为FeS的沉淀率与溶液pH的关系如题图-2所示。
(2)该装置沉淀废水中的硫(-2价)的原理可描述为_______ 。
(3)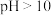 时,pH越大,硫转化为FeS的沉淀率越低,可能的原因是_______。
时,pH越大,硫转化为FeS的沉淀率越低,可能的原因是_______。
Ⅱ.氧化法。 氧化法、
氧化法、 氧化法、催化氧化法等可以将含硫废水中硫元素氧化。
氧化法、催化氧化法等可以将含硫废水中硫元素氧化。
i. 氧化法:向含
氧化法:向含 的废水中,加入一定量的
的废水中,加入一定量的 溶液,控制溶液的pH为5,可以生成S沉淀。
溶液,控制溶液的pH为5,可以生成S沉淀。
(4)写出该反应的离子方程式:_______ 。
ii. 氧化法:向含
氧化法:向含 的废水中,加入
的废水中,加入 溶液,其他条件一定,测得硫(-2价)的去除率、S(单质)的生成率与所加
溶液,其他条件一定,测得硫(-2价)的去除率、S(单质)的生成率与所加 溶液体积的关系如题图-3所示。
溶液体积的关系如题图-3所示。
(6)当所加 溶液体积大于9mL时,所加
溶液体积大于9mL时,所加 溶液越多,S生成率越低,原因是
溶液越多,S生成率越低,原因是____ 。
iii.催化氧化法: 苯胺(
苯胺( 为催化剂、聚苯胺为催化剂载体)可用作空气氧化含硫(-2价)废水的催化剂。碱性条件下,催化氧化废水的机理如题图-4所示。
为催化剂、聚苯胺为催化剂载体)可用作空气氧化含硫(-2价)废水的催化剂。碱性条件下,催化氧化废水的机理如题图-4所示。_______ 。
(8)催化剂使用一段时间后催化效率会下降,结合图中相关信息,分析可能原因为_______ ,要使催化剂恢复催化效率,处理的方法是用氯仿( )浸取催化剂,再干燥即可。
)浸取催化剂,再干燥即可。
Ⅰ.沉淀法。用如下图-1装置可以将废水中的硫转化为FeS沉淀。控制其他条件一定,测得出口处硫转化为FeS的沉淀率与溶液pH的关系如题图-2所示。
A.负极: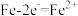 | B.阳极: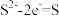 |
C.正极: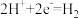 | D.阴极: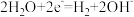 |
(2)该装置沉淀废水中的硫(-2价)的原理可描述为
(3)
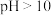 时,pH越大,硫转化为FeS的沉淀率越低,可能的原因是_______。
时,pH越大,硫转化为FeS的沉淀率越低,可能的原因是_______。A.pH越大, 越高, 越高, 与 与 结合转化为 结合转化为 逸出 逸出 |
B.pH越大, 越低,废水中 越低,废水中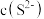 低,则FeS的沉淀率越低 低,则FeS的沉淀率越低 |
C.pH越大,废水中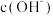 越高, 越高, 与 与 生成 生成 ,导致 ,导致 浓度越小,废水中 浓度越小,废水中 与 与 结合FeS沉淀的硫的量越少 结合FeS沉淀的硫的量越少 |
D.pH越大,废水中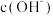 越低,废水中 越低,废水中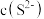 低, 低, 与 与 结合FeS沉淀量越少 结合FeS沉淀量越少 |
Ⅱ.氧化法。
 氧化法、
氧化法、 氧化法、催化氧化法等可以将含硫废水中硫元素氧化。
氧化法、催化氧化法等可以将含硫废水中硫元素氧化。i.
 氧化法:向含
氧化法:向含 的废水中,加入一定量的
的废水中,加入一定量的 溶液,控制溶液的pH为5,可以生成S沉淀。
溶液,控制溶液的pH为5,可以生成S沉淀。(4)写出该反应的离子方程式:
ii.
 氧化法:向含
氧化法:向含 的废水中,加入
的废水中,加入 溶液,其他条件一定,测得硫(-2价)的去除率、S(单质)的生成率与所加
溶液,其他条件一定,测得硫(-2价)的去除率、S(单质)的生成率与所加 溶液体积的关系如题图-3所示。
溶液体积的关系如题图-3所示。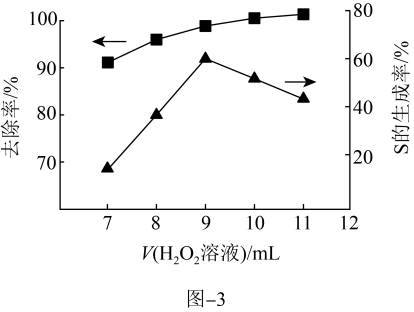
A.加 溶液就是将 溶液就是将 氧化为单质S 氧化为单质S |
B.随着 溶液的不断加入,废水中硫元素的去除率一直在升高 溶液的不断加入,废水中硫元素的去除率一直在升高 |
C. 溶液加入量越多,废水中含硫量越低 溶液加入量越多,废水中含硫量越低 |
D. 在处理一定量的废水中,其加入量不同氧化产物可能有差异 在处理一定量的废水中,其加入量不同氧化产物可能有差异 |
(6)当所加
 溶液体积大于9mL时,所加
溶液体积大于9mL时,所加 溶液越多,S生成率越低,原因是
溶液越多,S生成率越低,原因是iii.催化氧化法:
 苯胺(
苯胺( 为催化剂、聚苯胺为催化剂载体)可用作空气氧化含硫(-2价)废水的催化剂。碱性条件下,催化氧化废水的机理如题图-4所示。
为催化剂、聚苯胺为催化剂载体)可用作空气氧化含硫(-2价)废水的催化剂。碱性条件下,催化氧化废水的机理如题图-4所示。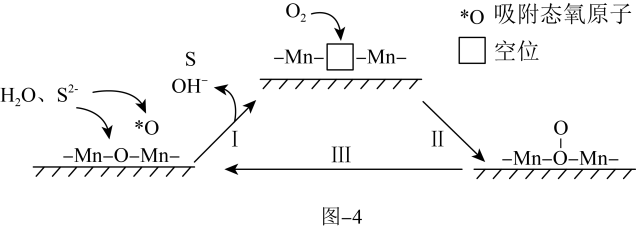
(8)催化剂使用一段时间后催化效率会下降,结合图中相关信息,分析可能原因为
 )浸取催化剂,再干燥即可。
)浸取催化剂,再干燥即可。
您最近一年使用:0次
名校
解题方法
2 . 聚苯乙烯是一类重要的高分子材料,可通过苯乙烯聚合制得。
I.工业常采用乙苯脱氢的方法制备苯乙烯,其原理为:C6H5-CH2CH3(g) C6H5-CH=CH2(g)+H2(g)
C6H5-CH=CH2(g)+H2(g)  。通过计算机模拟一个乙苯分子在催化剂表面脱氢制苯乙烯的反应,其历程如图1所示(吸附在催化剂表面的物质用*标注):
。通过计算机模拟一个乙苯分子在催化剂表面脱氢制苯乙烯的反应,其历程如图1所示(吸附在催化剂表面的物质用*标注):
(2)写出该反应历程(过渡态1和2中)的决速步骤反应方程式:___________ 。
(3)实验测得乙苯脱氢反应的速率方程为v正=k正p乙苯,v逆=k逆p苯乙烯p氢气(k正、k逆为速率常数,只与温度有关),图2中③代表lgk逆随 的变化关系,则能代表lgk正随
的变化关系,则能代表lgk正随 的变化关系的是___________。
的变化关系的是___________。
(4)某温度下,向1.0L恒容密闭容器中充入0.10mol C6H5-CH2CH3(g),测得乙苯脱氢反应时间(t)与容器的气体总压强(p)的数据见表:
该温度下的浓度平衡常数K=___________ mol/L(结果保留至小数点后两位)。
(5)实际生产中常在恒压条件下掺入高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),乙苯的转化率随稀释比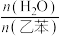 的变化如图所示,说明乙苯转化率变化的原因。
的变化如图所示,说明乙苯转化率变化的原因。___________
又已知水的汽化热为40.8kJ·mol-1。根据以上数据,计算CO2氧化乙苯脱氢反应的 =
=___________ 。
(7)该反应在催化剂表面发生的历程如图所示:___________ ;pH过高时,___________ 。
(8)相对于乙苯脱氢法,CO2氧化法制备苯乙烯工艺的优点为合成速率快、单位时间内的产量高;其缺点为:①反应需要控制酸度,工艺较为复杂;②___________ ;③___________ 。
I.工业常采用乙苯脱氢的方法制备苯乙烯,其原理为:C6H5-CH2CH3(g)
 C6H5-CH=CH2(g)+H2(g)
C6H5-CH=CH2(g)+H2(g)  。通过计算机模拟一个乙苯分子在催化剂表面脱氢制苯乙烯的反应,其历程如图1所示(吸附在催化剂表面的物质用*标注):
。通过计算机模拟一个乙苯分子在催化剂表面脱氢制苯乙烯的反应,其历程如图1所示(吸附在催化剂表面的物质用*标注):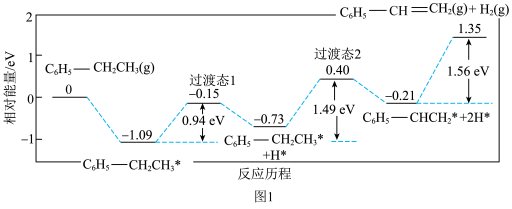
| A.大于0 | B.等于0 | C.小于0 | D.无法确定 |
(2)写出该反应历程(过渡态1和2中)的决速步骤反应方程式:
(3)实验测得乙苯脱氢反应的速率方程为v正=k正p乙苯,v逆=k逆p苯乙烯p氢气(k正、k逆为速率常数,只与温度有关),图2中③代表lgk逆随
 的变化关系,则能代表lgk正随
的变化关系,则能代表lgk正随 的变化关系的是___________。
的变化关系的是___________。
| A.① | B.② | C.④ | D.⑤ |
(4)某温度下,向1.0L恒容密闭容器中充入0.10mol C6H5-CH2CH3(g),测得乙苯脱氢反应时间(t)与容器的气体总压强(p)的数据见表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.26 | 9.32 | 9.33 | 9.33 |
(5)实际生产中常在恒压条件下掺入高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),乙苯的转化率随稀释比
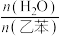 的变化如图所示,说明乙苯转化率变化的原因。
的变化如图所示,说明乙苯转化率变化的原因。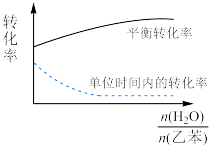
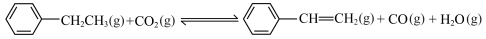
| 物质 |
|
| CO(g) |
| 燃烧热/kJ·mol-1 | -4610.2 | -4376.9 | -283.5 |
 =
=(7)该反应在催化剂表面发生的历程如图所示:
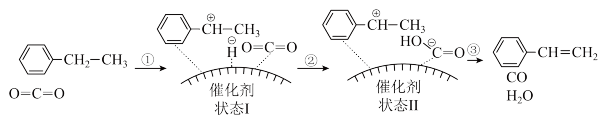
(8)相对于乙苯脱氢法,CO2氧化法制备苯乙烯工艺的优点为合成速率快、单位时间内的产量高;其缺点为:①反应需要控制酸度,工艺较为复杂;②
您最近一年使用:0次
名校
解题方法
3 . 以 还原
还原 的选择性催化还原(
的选择性催化还原(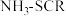 )技术广泛应用于烟气(含
)技术广泛应用于烟气(含 、
、 、
、 等)脱硝。
等)脱硝。
(1)常压下,将一定比例的 、
、 、
、 、
、 的混合气体匀速通过装有催化剂的反应管,测得
的混合气体匀速通过装有催化剂的反应管,测得 的转化率与
的转化率与 的选择性
的选择性 如图1所示。温度高于350℃,
如图1所示。温度高于350℃, 选择性下降的原因是
选择性下降的原因是_______ 。

(2)研究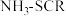 法尾气中
法尾气中 脱除机理的流程如图2所示。其他条件一定时,在不通
脱除机理的流程如图2所示。其他条件一定时,在不通 、通入
、通入 两种情况下,
两种情况下, 的脱除率、
的脱除率、 的选择性
的选择性 与通气时间的关系如图3所示。
与通气时间的关系如图3所示。

①反应17~19.2h时, 脱除率下降,其原因是
脱除率下降,其原因是_______ 。
②通入 后,
后, 选择性增大,其原因是
选择性增大,其原因是_______ 。
 还原
还原 的选择性催化还原(
的选择性催化还原(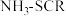 )技术广泛应用于烟气(含
)技术广泛应用于烟气(含 、
、 、
、 等)脱硝。
等)脱硝。(1)常压下,将一定比例的
 、
、 、
、 、
、 的混合气体匀速通过装有催化剂的反应管,测得
的混合气体匀速通过装有催化剂的反应管,测得 的转化率与
的转化率与 的选择性
的选择性 如图1所示。温度高于350℃,
如图1所示。温度高于350℃, 选择性下降的原因是
选择性下降的原因是
(2)研究
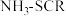 法尾气中
法尾气中 脱除机理的流程如图2所示。其他条件一定时,在不通
脱除机理的流程如图2所示。其他条件一定时,在不通 、通入
、通入 两种情况下,
两种情况下, 的脱除率、
的脱除率、 的选择性
的选择性 与通气时间的关系如图3所示。
与通气时间的关系如图3所示。
①反应17~19.2h时,
 脱除率下降,其原因是
脱除率下降,其原因是②通入
 后,
后, 选择性增大,其原因是
选择性增大,其原因是
您最近一年使用:0次
4 . “氢经济”是“双碳”转型中非常关键的一环。大量安全制氢是关键技术之一。
方法一:工业上常用甲烷、水蒸气重整制备氢气,体系中发生如下反应:
反应①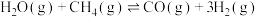
反应②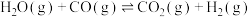
(1)下列操作中,能提高 平衡转化率的是_____。(双选)
平衡转化率的是_____。(双选)
(2)恒温条件下,1L密闭容器中, 和
和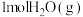 反应达平衡时,
反应达平衡时, 的转化率为
的转化率为 ,
, 的物质的量为
的物质的量为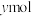 ,则反应①的平衡常数
,则反应①的平衡常数
_____ 。(用 、
、 表示)
表示)
方法二:用与 制备
制备 可以同时实现资源化利用,其反应历程如下:
可以同时实现资源化利用,其反应历程如下:
反应①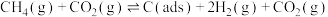
反应②
已知: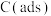 为吸附型活性炭。
为吸附型活性炭。
(3)使用不同催化剂时,相同时间内测得 的转化率随温度的变化如下图所示:
的转化率随温度的变化如下图所示:

催化效果最佳的是催化剂_____ (选填“Ⅰ”、“Ⅱ”或“Ⅲ”),b点的
_____  (选填“>”、“<”或“=”),c点转化率比a点低的可能原因是
(选填“>”、“<”或“=”),c点转化率比a点低的可能原因是_____ 。(任写一点)
方法一:工业上常用甲烷、水蒸气重整制备氢气,体系中发生如下反应:
反应①
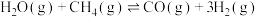
反应②
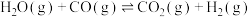
(1)下列操作中,能提高
 平衡转化率的是_____。(双选)
平衡转化率的是_____。(双选)A.增大 的浓度 的浓度 | B.分离出 |
| C.恒温恒压下通入惰性气体 | D.加入催化剂 |
(2)恒温条件下,1L密闭容器中,
 和
和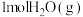 反应达平衡时,
反应达平衡时, 的转化率为
的转化率为 ,
, 的物质的量为
的物质的量为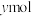 ,则反应①的平衡常数
,则反应①的平衡常数
 、
、 表示)
表示)方法二:用与
 制备
制备 可以同时实现资源化利用,其反应历程如下:
可以同时实现资源化利用,其反应历程如下:反应①
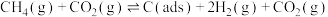
反应②

已知:
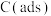 为吸附型活性炭。
为吸附型活性炭。(3)使用不同催化剂时,相同时间内测得
 的转化率随温度的变化如下图所示:
的转化率随温度的变化如下图所示:
催化效果最佳的是催化剂

 (选填“>”、“<”或“=”),c点转化率比a点低的可能原因是
(选填“>”、“<”或“=”),c点转化率比a点低的可能原因是
您最近一年使用:0次
名校
解题方法
5 . 某化学课外小组的同学准备通过实验探究,加深对化学反应速率和化学反应限度的认识。
实验一:探究温度和浓度对反应速率的影响
实验原理及方案:在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生反应生成碘,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。
(1)上述表格中:V1=____ mL,V2=____ mL。
实验二:探究KI和FeCl3混合时生成KCl、I2和FeCl2的反应存在一定的限度。
实验步骤:
i.向5mL,0.01mol/LKI溶液中滴加5~6滴0.01mol/LFeCl3溶液,充分反应后,将所得溶液分成甲、乙两等份;
ii.向甲中滴加CCl4,充分振荡;
iii.向乙中滴加KSCN。
请回答下列问题:
(2)KI和FeCl3在溶液中反应的离子方程式为:2I-+2Fe3+ I2(溶液)+2Fe2+,写出该反应的平衡常数K的表达式
I2(溶液)+2Fe2+,写出该反应的平衡常数K的表达式___ 。
(3)步骤和iii中的实验现象说明KI和FeCl3混合时生成KCl、I2和FeCl2的反应存在一定的限度,则步骤ii中的实验现象是____ ,且步骤iii中的实验现象是____ 。
实验三:对铝片与相同H+浓度的盐酸和硫酸在同温同压下反应时,铝和盐酸反应速率更快的原因探究。填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因I:Cl-对反应具有促进作用,而SO 对反应没有影响;
对反应没有影响;
原因II:Cl-对反应没有影响,而SO 对反应具有阻碍作用;
对反应具有阻碍作用;
(4)原因III:____ ;
原因IV:Cl-、SO 均对反应具有促进作用,但Cl-影响更大;
均对反应具有促进作用,但Cl-影响更大;
(5)原因V:_____ 。
②该同学设计并进行了两组实验,即得出了正确结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
(6)若原因I是正确的,则应观察到的现象是:实验a中____ ,实验b中____ 。
实验一:探究温度和浓度对反应速率的影响
实验原理及方案:在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生反应生成碘,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。
| 实验序号 | 0.01mol/LKIO3酸性溶液(含淀粉)的体积/mL | 0.01mol/LNa2SO3溶液的体积/mL | 水的体积/mL | 实验温度/℃ | 出现蓝色的时间/s |
| ① | 5 | 5 | V1 | 0 | |
| ② | 5 | 5 | 40 | 25 | |
| ③ | 5 | V2 | 35 | 25 |
实验二:探究KI和FeCl3混合时生成KCl、I2和FeCl2的反应存在一定的限度。
实验步骤:
i.向5mL,0.01mol/LKI溶液中滴加5~6滴0.01mol/LFeCl3溶液,充分反应后,将所得溶液分成甲、乙两等份;
ii.向甲中滴加CCl4,充分振荡;
iii.向乙中滴加KSCN。
请回答下列问题:
(2)KI和FeCl3在溶液中反应的离子方程式为:2I-+2Fe3+
 I2(溶液)+2Fe2+,写出该反应的平衡常数K的表达式
I2(溶液)+2Fe2+,写出该反应的平衡常数K的表达式(3)步骤和iii中的实验现象说明KI和FeCl3混合时生成KCl、I2和FeCl2的反应存在一定的限度,则步骤ii中的实验现象是
实验三:对铝片与相同H+浓度的盐酸和硫酸在同温同压下反应时,铝和盐酸反应速率更快的原因探究。填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因I:Cl-对反应具有促进作用,而SO
 对反应没有影响;
对反应没有影响;原因II:Cl-对反应没有影响,而SO
 对反应具有阻碍作用;
对反应具有阻碍作用;(4)原因III:
原因IV:Cl-、SO
 均对反应具有促进作用,但Cl-影响更大;
均对反应具有促进作用,但Cl-影响更大;(5)原因V:
②该同学设计并进行了两组实验,即得出了正确结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
(6)若原因I是正确的,则应观察到的现象是:实验a中
您最近一年使用:0次