名校
解题方法
1 .  经催化加氢可以生成低碳有机物,实现
经催化加氢可以生成低碳有机物,实现 的综合利用和“碳达峰、碳中和”的目标。
的综合利用和“碳达峰、碳中和”的目标。 合成甲醇涉及以下三个反应:
合成甲醇涉及以下三个反应:
①

②

③

已知:反应①、③是低温条件的自发反应。回答下列问题:
(1)上述三个反应的平衡常数 与温度关系如图1所示。图1中c线表示的反应是
与温度关系如图1所示。图1中c线表示的反应是___________ (填“①”、“②”或“③”),
___________  (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。 加氢制甲醇反应机理如图2所示。
加氢制甲醇反应机理如图2所示。___________ (填字母)。
A.羧基物种 和甲酸盐物种
和甲酸盐物种 为两种中间体
为两种中间体
B.该反应使用的催化剂既加快了反应速率,又提高了 的平衡转化率
的平衡转化率
C.反应过程中有极性键和非极性键的断裂和形成
(3)某温度下,向一恒容密闭容器中充入等物质的量的 和
和 ,在催化剂作用下发生反应③并达到平衡状态。下列图像正确的是
,在催化剂作用下发生反应③并达到平衡状态。下列图像正确的是___________ (填字母)。 和
和 )
)
(4)在密闭容器中,充入 和
和 合成
合成 ,发生反应①和②。不同温度下达到平衡时
,发生反应①和②。不同温度下达到平衡时 、
、 及
及 的体积分数如图3所示。
的体积分数如图3所示。 ,则曲线a代表
,则曲线a代表___________ 。
② 时,
时, 的平衡转化率为
的平衡转化率为___________ (保留两位有效数字,下同),此温度下反应②的
___________ (用平衡物质的量分数代替平衡浓度计算)。
 经催化加氢可以生成低碳有机物,实现
经催化加氢可以生成低碳有机物,实现 的综合利用和“碳达峰、碳中和”的目标。
的综合利用和“碳达峰、碳中和”的目标。 合成甲醇涉及以下三个反应:
合成甲醇涉及以下三个反应:①


②


③


已知:反应①、③是低温条件的自发反应。回答下列问题:
(1)上述三个反应的平衡常数
 与温度关系如图1所示。图1中c线表示的反应是
与温度关系如图1所示。图1中c线表示的反应是
 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。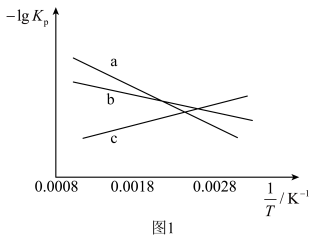
 加氢制甲醇反应机理如图2所示。
加氢制甲醇反应机理如图2所示。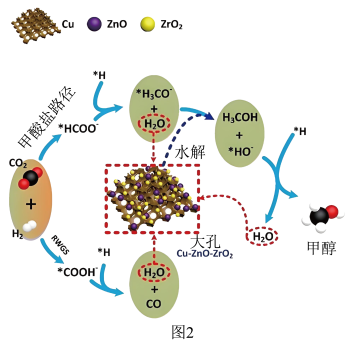
A.羧基物种
 和甲酸盐物种
和甲酸盐物种 为两种中间体
为两种中间体B.该反应使用的催化剂既加快了反应速率,又提高了
 的平衡转化率
的平衡转化率C.反应过程中有极性键和非极性键的断裂和形成
(3)某温度下,向一恒容密闭容器中充入等物质的量的
 和
和 ,在催化剂作用下发生反应③并达到平衡状态。下列图像正确的是
,在催化剂作用下发生反应③并达到平衡状态。下列图像正确的是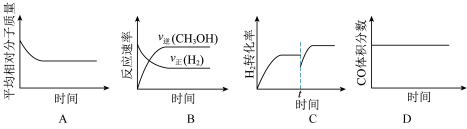
 和
和 )
)(4)在密闭容器中,充入
 和
和 合成
合成 ,发生反应①和②。不同温度下达到平衡时
,发生反应①和②。不同温度下达到平衡时 、
、 及
及 的体积分数如图3所示。
的体积分数如图3所示。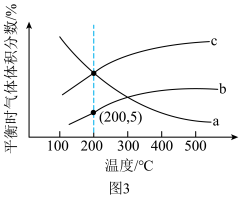
 ,则曲线a代表
,则曲线a代表②
 时,
时, 的平衡转化率为
的平衡转化率为
您最近一年使用:0次
2024-05-11更新
|
298次组卷
|
2卷引用:2024届黑龙江省哈尔滨师范大学附属中学高三下学期三模化学试题
名校
解题方法
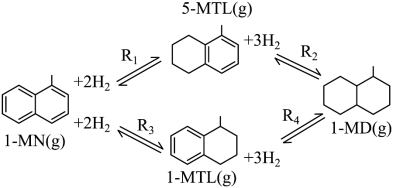
2 . 利用1-甲基萘(1-MN)制备四氢萘类物质(MTLs,包括1-MTL和5-MTL)。
反应过程中伴有生成十氢萘(1-MD)的副反应,涉及反应如图:
(1)1-甲基萘(1-MN)中的大Π键可表示为______ ,提高 反应选择性的关键因素是
反应选择性的关键因素是______ 。
(2)已知一定条件下反应 、
、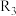 、
、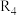 的焓变分别为
的焓变分别为 、
、 、
、 ,则反应
,则反应 的焓变为
的焓变为______ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
(3)四个平衡体系的平衡常数与温度的关系如图甲所示。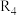 和
和 的平衡常数随温度变化的曲线,则表示反应
的平衡常数随温度变化的曲线,则表示反应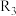 的平衡常数随温度变化的曲线为
的平衡常数随温度变化的曲线为______ 。
②已知反应 的速率方程
的速率方程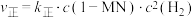 ,
,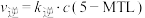 (
( 、
、 分别为正、逆反应速率常数,只与温度、催化剂有关)。温度
分别为正、逆反应速率常数,只与温度、催化剂有关)。温度 下反应达到平衡时
下反应达到平衡时 ,温度
,温度 下反应达到平衡时
下反应达到平衡时 。由此推知,
。由此推知,
______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③下列说法正确的是______ (填标号)。
A.四个反应均为放热反应
B.压强越大,温度越低越有利于生成四氢萘类物质
C.由上述信息可知,400K时反应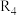 速率最快
速率最快
D.反应体系中1-MD最稳定.
(4)1-MN在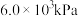 的高压
的高压 氛围下反应(
氛围下反应( 压强近似等于总压)。不同温度下达平衡时各产物的选择性
压强近似等于总压)。不同温度下达平衡时各产物的选择性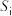 (某生成物i的物质的量与消耗l-MN的物质的量之比)和物质的量分数
(某生成物i的物质的量与消耗l-MN的物质的量之比)和物质的量分数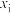 (
(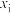 表示物种i与除
表示物种i与除 外其他各物种总物质的量之比)随1-MN平衡转化率y的变化关系如图乙所示,y为65%时反应
外其他各物种总物质的量之比)随1-MN平衡转化率y的变化关系如图乙所示,y为65%时反应 的平衡常数
的平衡常数
______  (列出计算式)。
(列出计算式)。
反应过程中伴有生成十氢萘(1-MD)的副反应,涉及反应如图:
(1)1-甲基萘(1-MN)中的大Π键可表示为
 反应选择性的关键因素是
反应选择性的关键因素是(2)已知一定条件下反应
 、
、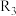 、
、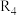 的焓变分别为
的焓变分别为 、
、 、
、 ,则反应
,则反应 的焓变为
的焓变为 、
、 、
、 的代数式表示)。
的代数式表示)。(3)四个平衡体系的平衡常数与温度的关系如图甲所示。
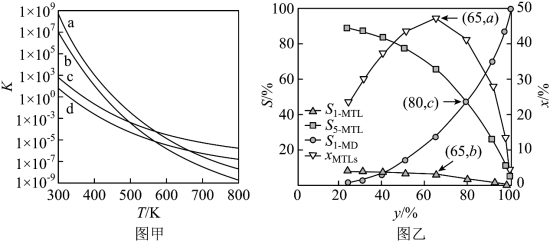
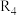 和
和 的平衡常数随温度变化的曲线,则表示反应
的平衡常数随温度变化的曲线,则表示反应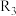 的平衡常数随温度变化的曲线为
的平衡常数随温度变化的曲线为②已知反应
 的速率方程
的速率方程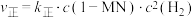 ,
,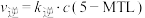 (
( 、
、 分别为正、逆反应速率常数,只与温度、催化剂有关)。温度
分别为正、逆反应速率常数,只与温度、催化剂有关)。温度 下反应达到平衡时
下反应达到平衡时 ,温度
,温度 下反应达到平衡时
下反应达到平衡时 。由此推知,
。由此推知,
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③下列说法正确的是
A.四个反应均为放热反应
B.压强越大,温度越低越有利于生成四氢萘类物质
C.由上述信息可知,400K时反应
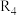 速率最快
速率最快D.反应体系中1-MD最稳定.
(4)1-MN在
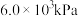 的高压
的高压 氛围下反应(
氛围下反应( 压强近似等于总压)。不同温度下达平衡时各产物的选择性
压强近似等于总压)。不同温度下达平衡时各产物的选择性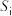 (某生成物i的物质的量与消耗l-MN的物质的量之比)和物质的量分数
(某生成物i的物质的量与消耗l-MN的物质的量之比)和物质的量分数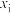 (
(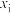 表示物种i与除
表示物种i与除 外其他各物种总物质的量之比)随1-MN平衡转化率y的变化关系如图乙所示,y为65%时反应
外其他各物种总物质的量之比)随1-MN平衡转化率y的变化关系如图乙所示,y为65%时反应 的平衡常数
的平衡常数
 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2024-02-29更新
|
768次组卷
|
3卷引用:黑龙江省哈尔滨市第三中学校2023-2024学年高三一模化学试题
黑龙江省哈尔滨市第三中学校2023-2024学年高三一模化学试题福建省福州市福建师范大学附属中学2024届高三一模化学试题(已下线)大题04 化学反应原理综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)
名校
解题方法
3 . 晶体硅材料是最主要的光伏材料,随当前信息工程的发展,硅主要用于微电子技术。工业上将粗硅氯化、精馏后得到 和
和 的混合物然后用
的混合物然后用 还原得到高纯硅。还原过程中发生的主要反应为:
还原得到高纯硅。还原过程中发生的主要反应为:
i.
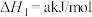
ii.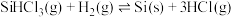
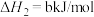
回答下列问题:
(1)已知: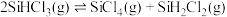
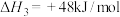 ,
, 还原
还原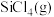 生成
生成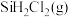 的热化学方程式为
的热化学方程式为___________ 。
(2)在 、
、 温度下,将
温度下,将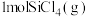 、
、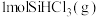 和
和 分别加入体积固定的密闭容器中,在催化条件下发生反应i、ii.测得
分别加入体积固定的密闭容器中,在催化条件下发生反应i、ii.测得 的转化率及体系内的压强随时间的变化关系如图所示。
的转化率及体系内的压强随时间的变化关系如图所示。
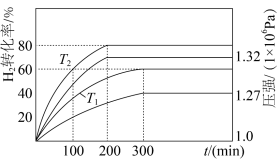
① 温度下,反应达到平衡时
温度下,反应达到平衡时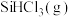 的转化率
的转化率___________ 。
② 温度下,反应i的标准平衡常数
温度下,反应i的标准平衡常数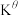 的计算式为
的计算式为___________ 。(已知:分压=总压×该组分物质的量分数,对于反应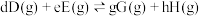 的
的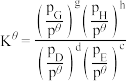 ,其中
,其中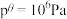 ,
, 、
、 、
、 、
、 为各组分的平衡分压)。
为各组分的平衡分压)。
③
___________ 0(填“>”或“<”),写出推理过程___________ 。
(3)研究发现,反应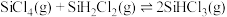 的活化能
的活化能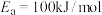 。反应的活化能
。反应的活化能 、速率常数k、温度T满足关系:
、速率常数k、温度T满足关系: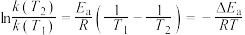 。
。
已知: ;ln10=2.3
;ln10=2.3
①若 ,通过升高温度到595K,才能满足
,通过升高温度到595K,才能满足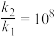 以加快反应速率;
以加快反应速率;
②若T=300K,使用催化剂使活化能降低,满足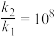 以加快反应速率,
以加快反应速率, 应减小。
应减小。
上述②中 应减小
应减小___________ kJ/mol(保留1位小数);对比①和②你得到的结论是___________ 。
 和
和 的混合物然后用
的混合物然后用 还原得到高纯硅。还原过程中发生的主要反应为:
还原得到高纯硅。还原过程中发生的主要反应为:i.

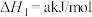
ii.
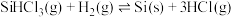
回答下列问题:
(1)已知:
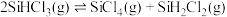
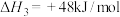 ,
, 还原
还原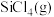 生成
生成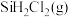 的热化学方程式为
的热化学方程式为(2)在
 、
、 温度下,将
温度下,将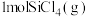 、
、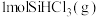 和
和 分别加入体积固定的密闭容器中,在催化条件下发生反应i、ii.测得
分别加入体积固定的密闭容器中,在催化条件下发生反应i、ii.测得 的转化率及体系内的压强随时间的变化关系如图所示。
的转化率及体系内的压强随时间的变化关系如图所示。
①
 温度下,反应达到平衡时
温度下,反应达到平衡时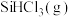 的转化率
的转化率②
 温度下,反应i的标准平衡常数
温度下,反应i的标准平衡常数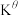 的计算式为
的计算式为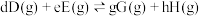 的
的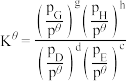 ,其中
,其中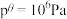 ,
, 、
、 、
、 、
、 为各组分的平衡分压)。
为各组分的平衡分压)。③

(3)研究发现,反应
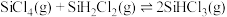 的活化能
的活化能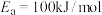 。反应的活化能
。反应的活化能 、速率常数k、温度T满足关系:
、速率常数k、温度T满足关系: 。
。已知:
 ;ln10=2.3
;ln10=2.3①若
 ,通过升高温度到595K,才能满足
,通过升高温度到595K,才能满足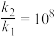 以加快反应速率;
以加快反应速率;②若T=300K,使用催化剂使活化能降低,满足
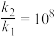 以加快反应速率,
以加快反应速率, 应减小。
应减小。上述②中
 应减小
应减小
您最近一年使用:0次
4 . 环氧乙烷( ,别称EO)是重要的杀菌剂和工业合成原料。回答下列问题:
,别称EO)是重要的杀菌剂和工业合成原料。回答下列问题:
(一)乙烯直接氧化法:
反应I:CH2=CH2(g)+ O2(g)→
O2(g)→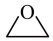 (g) ΔH1
(g) ΔH1
反应II:CH2=CH2(g)+3O2(g)→2CO2(g)+2H2O(g) ΔH2
(1)乙烯与O2在a、b两种催化剂作用下发生反应,催化剂的催化活性(用EO%衡量)及生成EO的选择性(用EO选择性%表示)与温度(T)的变化曲线如图一所示。

①依据图给信息,选择制备环氧乙烷的适宜条件为_____ 。
②M点后曲线下降的原因为_____ 。
③下列说法正确的有_____ (填标号)。
A.催化剂的选择性越高,其达到最高反应活性所需的温度越高
B.不同催化剂达到最高活性时的温度不同
C.催化剂的催化活性与温度成正比
(2)设K 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。反应I、II对应的-lnK
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。反应I、II对应的-lnK 随
随 (温度的倒数)的变化如图二所示。
(温度的倒数)的变化如图二所示。
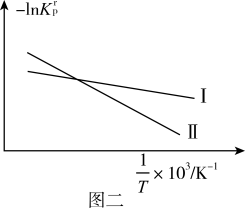
ΔH2_____ 0(填“>”或“<”)。
(二)电化学合成法
(3)科学家利用CO2、水合成环氧乙烷,有利于实现碳中和。总反应为:2CO2+2H2O→ +2.5O2,该过程在两个独立的电解槽中实现,装置如图三所示,在电解槽2中利用氯离子介导制备环氧乙烷,内部结构如图四所示。
+2.5O2,该过程在两个独立的电解槽中实现,装置如图三所示,在电解槽2中利用氯离子介导制备环氧乙烷,内部结构如图四所示。
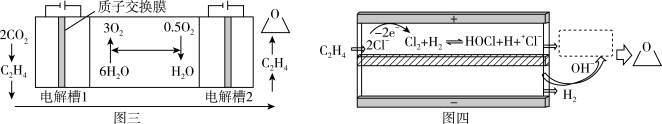
①电解槽1中阴极的电极反应式为_____ 。
②图四虚线框中发生多个反应,有中间产物HOCH2CH2Cl生成,最终生成环氧乙烷,其反应过程可描述为_____ 。
 ,别称EO)是重要的杀菌剂和工业合成原料。回答下列问题:
,别称EO)是重要的杀菌剂和工业合成原料。回答下列问题:(一)乙烯直接氧化法:
反应I:CH2=CH2(g)+
 O2(g)→
O2(g)→ (g) ΔH1
(g) ΔH1反应II:CH2=CH2(g)+3O2(g)→2CO2(g)+2H2O(g) ΔH2
(1)乙烯与O2在a、b两种催化剂作用下发生反应,催化剂的催化活性(用EO%衡量)及生成EO的选择性(用EO选择性%表示)与温度(T)的变化曲线如图一所示。

①依据图给信息,选择制备环氧乙烷的适宜条件为
②M点后曲线下降的原因为
③下列说法正确的有
A.催化剂的选择性越高,其达到最高反应活性所需的温度越高
B.不同催化剂达到最高活性时的温度不同
C.催化剂的催化活性与温度成正比
(2)设K
 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。反应I、II对应的-lnK
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。反应I、II对应的-lnK 随
随 (温度的倒数)的变化如图二所示。
(温度的倒数)的变化如图二所示。
ΔH2
(二)电化学合成法
(3)科学家利用CO2、水合成环氧乙烷,有利于实现碳中和。总反应为:2CO2+2H2O→
 +2.5O2,该过程在两个独立的电解槽中实现,装置如图三所示,在电解槽2中利用氯离子介导制备环氧乙烷,内部结构如图四所示。
+2.5O2,该过程在两个独立的电解槽中实现,装置如图三所示,在电解槽2中利用氯离子介导制备环氧乙烷,内部结构如图四所示。
①电解槽1中阴极的电极反应式为
②图四虚线框中发生多个反应,有中间产物HOCH2CH2Cl生成,最终生成环氧乙烷,其反应过程可描述为
您最近一年使用:0次
5 . 我国提出2060年前实现碳中和,为有效降低大气中 含量,科学家利用
含量,科学家利用 与
与 合成
合成 ,发生反应包含:
,发生反应包含:
Ⅰ主反应: △H
△H
Ⅱ副反应:

回答下列问题:
(1)已知反应Ⅲ
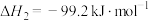 ,则△H=
,则△H=_______ 。相同条件下,C=O键键能为803 ,H-H键键能为436
,H-H键键能为436 ,则
,则
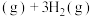 的活化能为
的活化能为_______ 。
(2)我国科学家在发展非金属催化剂实现 电催化还原制备甲醇方向取得重要进展,该反应历程如图所示(部分物质未画出)。
电催化还原制备甲醇方向取得重要进展,该反应历程如图所示(部分物质未画出)。
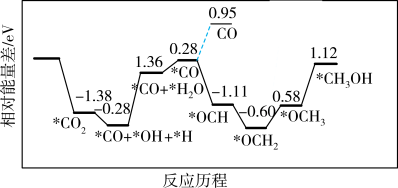
①下列说法正确的是_______ 。
A.催化剂可同时降低主副反应的活化能从而降低反应热
B.副反应所需活化能高于主反应
C. 与
与 结合形成
结合形成
D.反应过程中包含极性键和非极性键的断裂与生成
②要加快合成甲醇的反应速率,主要降低历程中_______ 的能量变化(用历程中符号表示即可,如:( )。
)。
(3)在恒温1L密闭容器中充入4mol 和6mol
和6mol ,初始压强为p,10min时主副反应都达到平衡状态,体系压强为0.8p,测得
,初始压强为p,10min时主副反应都达到平衡状态,体系压强为0.8p,测得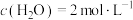 。
。
①0~10min内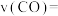
_______ 。
②主反应的化学平衡常数
_______ (用含p的代数式表示)。
③平衡时, 的选择性
的选择性_______ ( )。
)。
 含量,科学家利用
含量,科学家利用 与
与 合成
合成 ,发生反应包含:
,发生反应包含:Ⅰ主反应:
 △H
△HⅡ副反应:


回答下列问题:
(1)已知反应Ⅲ

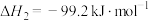 ,则△H=
,则△H= ,H-H键键能为436
,H-H键键能为436 ,则
,则
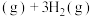 的活化能为
的活化能为(2)我国科学家在发展非金属催化剂实现
 电催化还原制备甲醇方向取得重要进展,该反应历程如图所示(部分物质未画出)。
电催化还原制备甲醇方向取得重要进展,该反应历程如图所示(部分物质未画出)。
①下列说法正确的是
A.催化剂可同时降低主副反应的活化能从而降低反应热
B.副反应所需活化能高于主反应
C.
 与
与 结合形成
结合形成
D.反应过程中包含极性键和非极性键的断裂与生成
②要加快合成甲醇的反应速率,主要降低历程中
 )。
)。(3)在恒温1L密闭容器中充入4mol
 和6mol
和6mol ,初始压强为p,10min时主副反应都达到平衡状态,体系压强为0.8p,测得
,初始压强为p,10min时主副反应都达到平衡状态,体系压强为0.8p,测得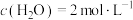 。
。①0~10min内
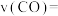
②主反应的化学平衡常数

③平衡时,
 的选择性
的选择性 )。
)。
您最近一年使用:0次
6 . 以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
Ⅰ.汽车尾气中的NO(g)和CO(g)在一定条件下可发生反应生成无毒的N2和CO2:
(1)已知:①N2(g) + O2(g)⇌2NO(g) ∆H1= +180.5 kJ/mol;②CO的燃烧热∆H2=−283.0 kJ/mol,则反应③2NO(g) + 2CO(g)⇌N2(g) + 2CO2(g) ∆H3=_____________ 。
(2)某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.4molNO和0.4molCO,发生反应③。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系的总压强随时间变化情况如图所示:
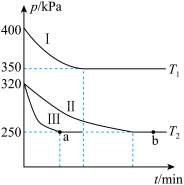
①温度:T1_______ T2(填“<”、“=”或“>”)
②CO的平衡转化率:α(Ⅰ)________ α(Ⅱ)________ α(Ⅲ)(填“<”、“=”或“>”)
③反应速率:a点的v正______ b点的v逆(填“<”、“=”或“>”)
④T2时反应③的压强平衡常数Kp=__________ 。
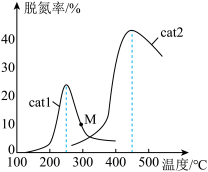
(3)将NO和CO以一定的流速通过两种不同的催化剂(Cat1、Cat2)进行反应,相同时间内测量的脱氮率 脱氮率即NO的转化率
脱氮率即NO的转化率 如图所示。M点
如图所示。M点___________ (填“是”或“不是”)对应温度下的平衡脱氮率,说明理由_________ 。
Ⅱ.N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解反应2N2O=2N2+O2对环境保护有重要意义。
(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步:I2(g)⇌2I(g) 快速平衡,平衡常数为K
第二步:I(g)+N2O(g) =N2(g)+IO(g) 慢反应,v=k1·c(N2O)·c(I)
第三步:IO(g)+N2O(g) =N2(g)+O2(g)+ I2(g) 快反应
I2(g) 快反应
其中可近似认为第二步反应不影响第一步的平衡。实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数 。
。
①k=_____ 用含K和 的代数式表示
的代数式表示 。
。
②下列表述正确的是_______ 。
A.IO为反应的中间产物
B.碘蒸气的浓度大小不会影响N2O的分解速率
C.第二步对总反应速率起决定作用
D.第二步反应的活化能小于第三步反应的活化能
Ⅰ.汽车尾气中的NO(g)和CO(g)在一定条件下可发生反应生成无毒的N2和CO2:
(1)已知:①N2(g) + O2(g)⇌2NO(g) ∆H1= +180.5 kJ/mol;②CO的燃烧热∆H2=−283.0 kJ/mol,则反应③2NO(g) + 2CO(g)⇌N2(g) + 2CO2(g) ∆H3=
(2)某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.4molNO和0.4molCO,发生反应③。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系的总压强随时间变化情况如图所示:

①温度:T1
②CO的平衡转化率:α(Ⅰ)
③反应速率:a点的v正
④T2时反应③的压强平衡常数Kp=
(3)将NO和CO以一定的流速通过两种不同的催化剂(Cat1、Cat2)进行反应,相同时间内测量的脱氮率
 脱氮率即NO的转化率
脱氮率即NO的转化率 如图所示。M点
如图所示。M点
Ⅱ.N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解反应2N2O=2N2+O2对环境保护有重要意义。
(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步:I2(g)⇌2I(g) 快速平衡,平衡常数为K
第二步:I(g)+N2O(g) =N2(g)+IO(g) 慢反应,v=k1·c(N2O)·c(I)
第三步:IO(g)+N2O(g) =N2(g)+O2(g)+
 I2(g) 快反应
I2(g) 快反应其中可近似认为第二步反应不影响第一步的平衡。实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数
 。
。①k=
 的代数式表示
的代数式表示 。
。②下列表述正确的是
A.IO为反应的中间产物
B.碘蒸气的浓度大小不会影响N2O的分解速率
C.第二步对总反应速率起决定作用
D.第二步反应的活化能小于第三步反应的活化能
您最近一年使用:0次



