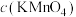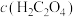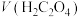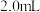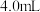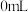2022·北京朝阳·三模
名校
解题方法
1 . 某小组探究 和
和 的反应的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
的反应的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
【实验探究】
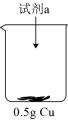
实验i:向装有0.5g 的烧杯中加入20mL30%
的烧杯中加入20mL30% 溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,
溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊, 片表面附着少量蓝色固体。
片表面附着少量蓝色固体。
(1)写出该反应的化学方程式:_______ 。
【继续探究】
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
(2)实验ii中:溶液变蓝的原因是_______ (用离子反应方程式表示);经检验产生的气体为氧气,产生氧气的原因是_______ 。
(3)对比实验i和iii,为探究氨水对 的还原性或
的还原性或 氧化性的影响,该同学利用如图装置继续实验。
氧化性的影响,该同学利用如图装置继续实验。
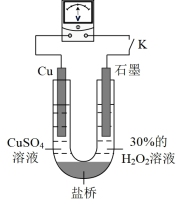
已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U型管右侧溶液中滴加氨水后,电压不变。
c.继续向U型管左侧溶液中滴加氨水后,电压增大了y。
①利用电极反应解释该实验的结论:_______ 。
②利用该方法也可证明酸性增强可提高 的氧化性,与上述实验操作不同的是
的氧化性,与上述实验操作不同的是_______ 。
(4)总结:物质氧化性和还原性变化的一般规律是_______ 。
(5)应用: 分别与
分别与 的盐酸、氢溴酸、氢碘酸混合,
的盐酸、氢溴酸、氢碘酸混合, 只与氢碘酸发生置换反应,试解释原因
只与氢碘酸发生置换反应,试解释原因_______ 。
 和
和 的反应的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
的反应的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。【实验探究】
实验i:向装有0.5g
 的烧杯中加入20mL30%
的烧杯中加入20mL30% 溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,
溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊, 片表面附着少量蓝色固体。
片表面附着少量蓝色固体。(1)写出该反应的化学方程式:
【继续探究】
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
| 装置 | 序号 | 试剂a | 现象 |
 | ii | 20mL30% 与4mL 与4mL5mol/L  混合液 混合液 |  表面很快生产少量气泡,溶液逐渐变蓝,产生较多气泡 表面很快生产少量气泡,溶液逐渐变蓝,产生较多气泡 |
| iii | 20mL30% 与4mL 与4mL5mol/L氨水混合液 | 溶液立即变为深蓝色,产生大量气泡, 表面有少量蓝色不溶物 表面有少量蓝色不溶物 |
(3)对比实验i和iii,为探究氨水对
 的还原性或
的还原性或 氧化性的影响,该同学利用如图装置继续实验。
氧化性的影响,该同学利用如图装置继续实验。
已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U型管右侧溶液中滴加氨水后,电压不变。
c.继续向U型管左侧溶液中滴加氨水后,电压增大了y。
①利用电极反应解释该实验的结论:
②利用该方法也可证明酸性增强可提高
 的氧化性,与上述实验操作不同的是
的氧化性,与上述实验操作不同的是(4)总结:物质氧化性和还原性变化的一般规律是
(5)应用:
 分别与
分别与 的盐酸、氢溴酸、氢碘酸混合,
的盐酸、氢溴酸、氢碘酸混合, 只与氢碘酸发生置换反应,试解释原因
只与氢碘酸发生置换反应,试解释原因
您最近一年使用:0次
2022-06-03更新
|
538次组卷
|
4卷引用:微专题 物质性质综合实验探究
(已下线)微专题 物质性质综合实验探究北京市东直门中学2023-2024学年高三上学期12月阶段测试化学试题北京市和平街第一中学2021-2022学年高三下学期保温化学试题(已下线)易错点21 化学反应速率-备战2023年高考化学考试易错题
名校
2 . 铁元素的“价—类”二维图如图所示:
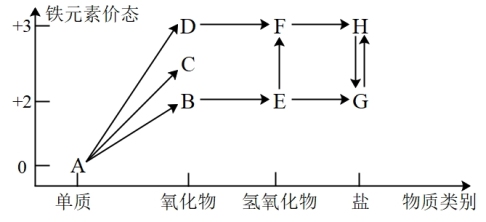
(1)C的化学式是_______ , 反应的化学方程式是
反应的化学方程式是_______ ,反应过程的现象为_______ 。
(2)维生素C可将H转化为G,维生素C具有_______ (填“酸性”、“氧化性”或“还原性”)。
(3)在指定条件下,下列铁及其化合物之间的转化不能实现的是_______ 。
A. B.
B. C.
C.
(4)某小组同学设计如下实验,研究亚铁盐与 溶液的反应。
溶液的反应。
试剂:酸化的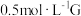 溶液,
溶液, 溶液
溶液
①上述实验中 溶液与G溶液反应的离子方程式是
溶液与G溶液反应的离子方程式是_______ 。
②产生气泡的原因是_______ 。

(1)C的化学式是
 反应的化学方程式是
反应的化学方程式是(2)维生素C可将H转化为G,维生素C具有
(3)在指定条件下,下列铁及其化合物之间的转化不能实现的是
A.
 B.
B. C.
C.
(4)某小组同学设计如下实验,研究亚铁盐与
 溶液的反应。
溶液的反应。试剂:酸化的
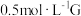 溶液,
溶液, 溶液
溶液| 操作 | 现象 |
取 酸化的G溶液于试管中,加入5滴 酸化的G溶液于试管中,加入5滴 溶液 溶液 | 溶液立即变为棕黄色,稍后,产生气泡。 |
向反应后的溶液中加入 溶液 溶液 | 溶液变红 |
 溶液与G溶液反应的离子方程式是
溶液与G溶液反应的离子方程式是②产生气泡的原因是
您最近一年使用:0次
2022-01-23更新
|
803次组卷
|
8卷引用:广东省广州市第八十九中学2022-2023学年高一上学期期末考试化学试题
名校
3 . Ⅰ.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
(1)催化剂能增大化学反应速率的原因是___________ 。
(2)实验①和②的目的是探究___________ 对反应速率的影响。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是___________ 。
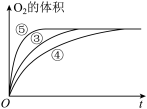
(3)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图。
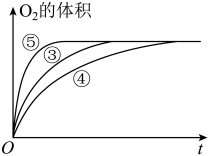
分析下图能够得出的实验结论:
①___________ 环境能增大H2O2分解的速率;
②___________ 环境能减小H2O2分解的速率。
(4)设计实验进一步探究Fe3+和Cu2+对H2O2分解的催化效果:在两支试管中各加入2mL5%的H2O2溶液,再向其中分别滴入1mL浓度均为0.1mol/L的FeCl3溶液和CuSO4溶液。有同学建议将CuSO4改为CuCl2溶液,理由是___________ ;还有同学认为即使改用了CuCl2溶液,仍不严谨,建议补做对比实验:向2mL5%的H2O2溶液中滴入的试剂及其用量是___________ 。
Ⅱ.为进一步研究浓度对反应速率的影响,该实验小组又涉及了如下实验方案:混合试剂1和试剂2,记录溶液褪色所需的时间。
(5)写出上述反应的离子方程式:___________ 。
(6)实验1中tmin时溶液褪色,用草酸表示的反应速率v(H2C2O4)=___________ mol·L-1·min-1。联系实验1、2,预期结论是___________ 。
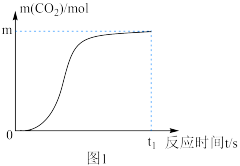
(7)n(CO2)随时间的变化如下图1所示,其变化的原因是___________ 。
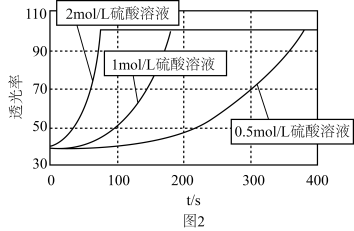
(8)研究发现KMnO4溶液的酸化程度对反应的速率也有较大影响,用不同浓度的硫酸进行酸化,其余条件均相同时,测得反应溶液的透光率(溶液颜色越浅,透光率越高)随时间变化如图2所示,由此得出的结论是___________ 。
| 分组实验 | 催化剂 | |
| ① | 10mL5%H2O2溶液 | 无 |
| ② | 10mL2%H2O2溶液 | 无 |
| ③ | 10mL5%H2O2溶液 | 1mL0.1mol·L-1FeCl3溶液 |
| ④ | 10mL5%H2O2溶液+少量稀盐酸 | 1mL0.1mol·L-1FeCl3溶液 |
| ⑤ | 10mL5%H2O2溶液+少量NaOH溶液 | 1mL0.1mol·L-1FeCl3溶液 |
(2)实验①和②的目的是探究
(3)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图。

分析下图能够得出的实验结论:
①
②
(4)设计实验进一步探究Fe3+和Cu2+对H2O2分解的催化效果:在两支试管中各加入2mL5%的H2O2溶液,再向其中分别滴入1mL浓度均为0.1mol/L的FeCl3溶液和CuSO4溶液。有同学建议将CuSO4改为CuCl2溶液,理由是
Ⅱ.为进一步研究浓度对反应速率的影响,该实验小组又涉及了如下实验方案:混合试剂1和试剂2,记录溶液褪色所需的时间。
| 实验1 | 实验2 | |
| 试剂1 | 2mL0.1mol/L的草酸溶液 | 2mL0.2mol/L的草酸溶液 |
| 试剂2 | 4mL0.01mol/L的高锰酸钾酸性溶液 | 4mL0.01mol/L的高锰酸钾酸性溶液 |
(6)实验1中tmin时溶液褪色,用草酸表示的反应速率v(H2C2O4)=
(7)n(CO2)随时间的变化如下图1所示,其变化的原因是

(8)研究发现KMnO4溶液的酸化程度对反应的速率也有较大影响,用不同浓度的硫酸进行酸化,其余条件均相同时,测得反应溶液的透光率(溶液颜色越浅,透光率越高)随时间变化如图2所示,由此得出的结论是

您最近一年使用:0次
名校
解题方法
4 . H2O2广泛应用于医疗卫生、化学合成等领域。
(1)已知2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ•mol-1,趣味实验“大象牙膏”的实验原理是H2O2溶液在KI催化作用下分解,反应的机理可表示为:
i.H2O2(l)+I-(aq)=H2O(l)+IO-(aq) △H1=+akJ•mol-1(a>0)
ii.H2O2(l)+__________。
则ii中反应机理用热化学方程式表示为________ 。
(2)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如表方案完成实验。
I.实验①和②的目的是_______ 。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2较稳定,不易分解,为达到实验目的,你对原方案的改进是_______ 。
II.实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图,结合图分析实验,能够得出什么实验结论?________ 。
III.为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。

①写出H2O2在FeCl3作用下发生反应的化学方程式:________ 。
②利用图1实验,可通过观察产生气泡的快慢定性比较得出结论·有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_______ 。
③若利用图2实验可进行定量分析,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是_______ 。
(1)已知2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ•mol-1,趣味实验“大象牙膏”的实验原理是H2O2溶液在KI催化作用下分解,反应的机理可表示为:
i.H2O2(l)+I-(aq)=H2O(l)+IO-(aq) △H1=+akJ•mol-1(a>0)
ii.H2O2(l)+__________。
则ii中反应机理用热化学方程式表示为
(2)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如表方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2%H2O2溶液 | 无 |
| ② | 10mL5%H2O2溶液 | 无 |
| ③ | 10mL5%H2O2溶液 | 1mL0.1mol/LFeCl3溶液 |
| ④ | 10mL5%H2O2溶液+少量HCl溶液 | 1mL0.1mol/LFeCl3溶液 |
| ⑤ | 10mL5%H2O2溶液+少量NaOH溶液 | 1mL0.1mol/LFeCl3溶液 |
II.实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图,结合图分析实验,能够得出什么实验结论?

III.为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。

①写出H2O2在FeCl3作用下发生反应的化学方程式:
②利用图1实验,可通过观察产生气泡的快慢定性比较得出结论·有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是
③若利用图2实验可进行定量分析,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是
您最近一年使用:0次
名校
解题方法
5 . 某兴趣小组同学将 的酸性
的酸性 溶液和
溶液和 溶液按如下比例混合,探究浓度对反应速率的影响。
溶液按如下比例混合,探究浓度对反应速率的影响。
现象:实验①溶液很快由紫色变为青绿色,而实验②慢一点;变为青绿色后,实验②溶液很快褪至无色,而实验①褪色慢一点。
资料: 与
与 很难形成配合物;
很难形成配合物;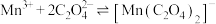 (青绿色),
(青绿色), 有强氧化性,而
有强氧化性,而 氧化性极弱。
氧化性极弱。
下列说法错误的是
 的酸性
的酸性 溶液和
溶液和 溶液按如下比例混合,探究浓度对反应速率的影响。
溶液按如下比例混合,探究浓度对反应速率的影响。序号 | 温度 |
|
|
|
|
|
① | 20℃ |
|
|
|
|
|
② | 20℃ |
|
|
|
|
|
资料:
 与
与 很难形成配合物;
很难形成配合物;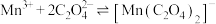 (青绿色),
(青绿色), 有强氧化性,而
有强氧化性,而 氧化性极弱。
氧化性极弱。下列说法错误的是
A. |
B. 溶液中能通过加盐酸酸化调 溶液中能通过加盐酸酸化调 |
C.溶液由青绿色褪至无色过程中,实验①中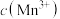 较小,导致褪色速率较慢 较小,导致褪色速率较慢 |
D.由实验可知,加入 越多, 越多, 溶液由紫色褪至无色的速率越快 溶液由紫色褪至无色的速率越快 |
您最近一年使用:0次
2023-06-02更新
|
234次组卷
|
2卷引用:河北省2022-2023学年高三下学期1月大联考化学试题
名校
6 . 氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。某实验小组以H2O2分解为例,探究浓度、催化剂、温度对反应速率的影响。在常温下按照下表所示的方案完成实验。
(1)实验①和②的目的是___________ 。同学甲在进行实验①和②时并没有观察到明显现象。资料显示,通常条件下过氧化氢稳定,不易分解。为了达到实验目的,可采取的改进方法是___________ (写出一种即可)。
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化如图所示。分析该图能得出的结论是___________ 。

(3)同学乙设计了如图所示的实验装置对过氧化氢的分解速率进行定量分析,以生成20mL气体为准,其他影响实验的因素均已忽略。实验中需要测量的数据是___________ 。
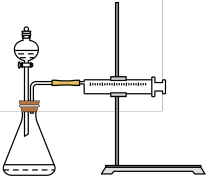
(4)向某体积固定的密闭容器中加入0.6molA、0.2molC和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
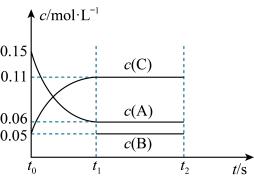
①写出反应的化学方程式:___________ ;
②B的起始的物质的量是___________ ;平衡时体系内的压强为初始状态的___________ 倍。
| 实验编号 | 温度(℃) | 反应物 | 催化剂 |
| ① | 20 | 25mL3%H2O2溶液 | 无 |
| ② | 20 | 25mL5%H2O2溶液 | 无 |
| ③ | 20 | 25mL5%H2O2溶液 | 0.1gMnO2 |
| ④ | 20 | 25mL5%H2O2溶液 | 1~2滴1mol/LFeCl3溶液 |
| ⑤ | 30 | 25mL5%H2O2溶液 | 0.1gMnO2 |
(1)实验①和②的目的是
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化如图所示。分析该图能得出的结论是

(3)同学乙设计了如图所示的实验装置对过氧化氢的分解速率进行定量分析,以生成20mL气体为准,其他影响实验的因素均已忽略。实验中需要测量的数据是

(4)向某体积固定的密闭容器中加入0.6molA、0.2molC和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:

①写出反应的化学方程式:
②B的起始的物质的量是
您最近一年使用:0次
2023-10-04更新
|
20次组卷
|
2卷引用:广东省 广州市西关培英中学2023-2024学年高二上学期11月期中化学试题
7 . 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
(1)催化剂能加快化学反应速率的原因是______________________________________ 。
(2)实验①和②的目的是__________________________________ 。
实验时由于没有观察到明显现象而无法得出结论,资料显示,通常条件下H2O2较稳定,不易分解,为了达到实验目的,你对原实验方案的改进是_______________________ 。
(3)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。
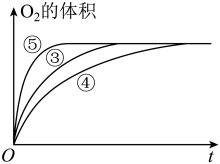
分析上图能够得出的实验结论是______________________ 。
| 实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
(2)实验①和②的目的是
实验时由于没有观察到明显现象而无法得出结论,资料显示,通常条件下H2O2较稳定,不易分解,为了达到实验目的,你对原实验方案的改进是
(3)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。

分析上图能够得出的实验结论是
您最近一年使用:0次
解题方法
8 . 臭氧氧化法是处理水体中有机污染物的常用方法。
(1)研究臭氧发生的原理
一种臭氧发生装置原理如图所示。阳极(惰性电极)的电极反应式为_______ 。
通常降解时采用一次性投加O3的方式,温度升高,相同时间内有机物降解度降低。提出猜想:溶液中溶解的O3减少。作出猜想的依据:_______ ;设计一个实验验证猜想_______ 。
(3)研究O3降解有机物的路径
资料:臭氧除直接降解有机物外,O3在溶液中能产生羟基自由基(·OH),·OH也能降解水中有机物。
①写出产生羟基自由基(·OH)的化学方程式:_______ 。
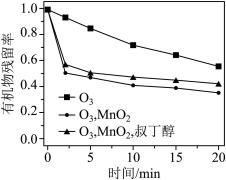
实验:取三份废水,保持其它条件相同。第一份直接通入12.5mg/LO3;第二份在加入一定量MnO2的同时通入1.25mg/LO3;第三份在加入一定量MnO2与叔丁醇的同时通入12.5mg/LO3(叔丁醇能迅速结合·OH而将其除去),分别测量三份废水中有机物的残留率随时间的变化,结果如图所示。_______ 。
(4)研究O3降解有机物的机理
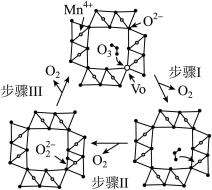
MnO2催化O3反应的一种机理如图所示,“Vo”表示MnO2表面氧空位。根据此机理,实际具有催化活性的催化剂为_______ 。(以含字母x的化学式表示其组成)。研究表明:利用蜂窝陶瓷所含的氧化物为载体负载MnO2对臭氧降解有机物能力有较好的促进作用,而温度过高,则臭氧降解有机物能力显著降低,分析其发生变化的原因_______ 。
(1)研究臭氧发生的原理
一种臭氧发生装置原理如图所示。阳极(惰性电极)的电极反应式为

通常降解时采用一次性投加O3的方式,温度升高,相同时间内有机物降解度降低。提出猜想:溶液中溶解的O3减少。作出猜想的依据:
(3)研究O3降解有机物的路径
资料:臭氧除直接降解有机物外,O3在溶液中能产生羟基自由基(·OH),·OH也能降解水中有机物。
①写出产生羟基自由基(·OH)的化学方程式:
实验:取三份废水,保持其它条件相同。第一份直接通入12.5mg/LO3;第二份在加入一定量MnO2的同时通入1.25mg/LO3;第三份在加入一定量MnO2与叔丁醇的同时通入12.5mg/LO3(叔丁醇能迅速结合·OH而将其除去),分别测量三份废水中有机物的残留率随时间的变化,结果如图所示。
(4)研究O3降解有机物的机理
MnO2催化O3反应的一种机理如图所示,“Vo”表示MnO2表面氧空位。根据此机理,实际具有催化活性的催化剂为
您最近一年使用:0次
9 . 为了深入探究某个化学问题,往往需要我们会依据一定的原理作出假设,并设计一定的化学实验方案。某化学兴趣小组的同学,对实验室制备氧气的若干问题进行如下探究:
[探究一]为探究影响双氧水分解速率的某种因素,A小组记录了如下实验数据:
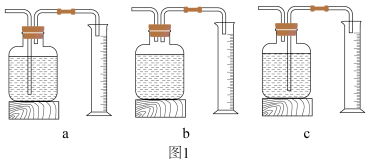
(1)写出本实验中反应的化学方程式为___________ ;测量 体积的装置是
体积的装置是___________ (选填下图1中的装置编号)。
(2)由实验I、Ⅱ、Ⅲ可知:影响双氧水分解速率的因素是:___________
[探究二]B小组查阅资料:在过氧化氢溶液的分解反应中,氧化铜也能作催化剂。于是他们用天平称量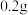 氧化铜,取5%过氧化氢溶液
氧化铜,取5%过氧化氢溶液 于试管中,进行如图2实验:
于试管中,进行如图2实验:
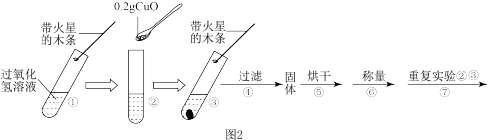
(3)填表:
(4)步骤①的目的是___________ 。
(5)步骤④需用到的玻璃仪器有铁架台(带铁圈)、烧杯、___________ 、___________ 。
(6)步骤⑦中应选用___________ 的过氧化氢溶液。
(7)过氧化氢能将二氧化硫氧化,请写出离子方程式为___________ 。
[探究一]为探究影响双氧水分解速率的某种因素,A小组记录了如下实验数据:
| 双氧水的质量 | 双氧水的浓度 |  的质量 的质量 | 相同时间内产生 的体积 的体积 | |
| I | 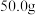 | 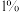 |  |  |
| Ⅱ | 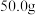 |  |  | 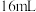 |
| Ⅲ | 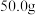 | 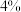 |  | 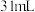 |
(1)写出本实验中反应的化学方程式为
 体积的装置是
体积的装置是
(2)由实验I、Ⅱ、Ⅲ可知:影响双氧水分解速率的因素是:
[探究二]B小组查阅资料:在过氧化氢溶液的分解反应中,氧化铜也能作催化剂。于是他们用天平称量
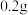 氧化铜,取5%过氧化氢溶液
氧化铜,取5%过氧化氢溶液 于试管中,进行如图2实验:
于试管中,进行如图2实验:
(3)填表:
| 步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
| 称得氧化铜的质量为 | 将固体加入盛有过氧化氢溶液的试管中,并把带火星的木条伸入试管,观察现象。 | 在过氧化氢溶液的分解实验中,氧化铜也能作催化剂。 |
(4)步骤①的目的是
(5)步骤④需用到的玻璃仪器有铁架台(带铁圈)、烧杯、
(6)步骤⑦中应选用
(7)过氧化氢能将二氧化硫氧化,请写出离子方程式为
您最近一年使用:0次
21-22高二上·安徽池州·期中
名校
10 . 某研究性学习小组利用 溶液和酸性
溶液和酸性 溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
(1)通过实验A、B,可探究出_______ (填外部因素)的改变对化学反应速率的影响,其中
_______ 、
_______ ,通过实验_______ (填实验序号)可探究出温度变化对化学反应速率的影响,其中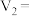
_______ 。
(2)若 ,则由此实验可以得出的结论是
,则由此实验可以得出的结论是_______ 。忽略溶液体积的变化,利用实验B中数据计算,0~8s内,用 的浓度变化表示的反应速率
的浓度变化表示的反应速率
_______ 。
(3)该小组的一位同学通过查阅资料发现,上述实验过程中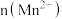 随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对
随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对 与草酸之间的反应有某种特殊作用,则该作用是
与草酸之间的反应有某种特殊作用,则该作用是_______ 。设计实验证明,分别取等体积等浓度的 和
和 混合,平均分成两份,一份中不加任何试剂,一份加入少量
混合,平均分成两份,一份中不加任何试剂,一份加入少量 固体,观察到两溶液都没有褪色,原因是:
固体,观察到两溶液都没有褪色,原因是:_______ 。

 溶液和酸性
溶液和酸性 溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:| 实验序号 | 实验温度/K | 溶液颜色褪至无色所需时间/s | |||||
酸性 溶液 溶液 |  溶液 溶液 |  | |||||
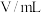 | 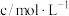 | 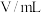 | 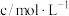 | 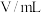 | |||
| A | 293 | 2 | 0.02 | 4 | 0.1 | 0 |  |
| B |  | 2 | 0.02 | 3 | 0.1 |  | 8 |
| C | 313 | 2 | 0.02 |  | 0.1 | 1 |  |


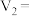
(2)若
 ,则由此实验可以得出的结论是
,则由此实验可以得出的结论是 的浓度变化表示的反应速率
的浓度变化表示的反应速率
(3)该小组的一位同学通过查阅资料发现,上述实验过程中
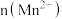 随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对
随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对 与草酸之间的反应有某种特殊作用,则该作用是
与草酸之间的反应有某种特殊作用,则该作用是 和
和 混合,平均分成两份,一份中不加任何试剂,一份加入少量
混合,平均分成两份,一份中不加任何试剂,一份加入少量 固体,观察到两溶液都没有褪色,原因是:
固体,观察到两溶液都没有褪色,原因是:
您最近一年使用:0次
2022-04-16更新
|
599次组卷
|
5卷引用:化学反应速率与化学平衡——课时2化学反应速率的影响因素
(已下线)化学反应速率与化学平衡——课时2化学反应速率的影响因素安徽省池州市贵池区2021-2022学年高二上学期期中考试化学试题(已下线)2.1.2 影响化学反应速率的因素 活化能 -2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)安徽省池州市贵池区2021-2022学年高二上学期期中考试化学试题黑龙江省鹤岗市第一中学2022-2023学年高三上学期10月月考化学试题