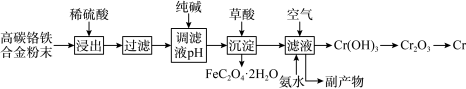
已知:Cr+H2SO4=CrSO4+H2↑。
请回答下列问题:
(1)稀硫酸酸浸过程中,提高“浸出率”的措施有
(2)用纯碱调节溶液酸度,若纯碱过量,则可能导致的后果是
(3)加入草酸发生反应的离子方程式为
(4)向滤液中通入空气,加入氨水后发生反应的化学方程式为
(5)已知高碳铬铁废料中铁铬元素质量之比为14∶13,上述流程中铁元素转化为草酸亚铁的利用率为80%。废料中提取金属铬的总转化率为95%,如果得到草酸亚铁晶体(FeC2O4∙2H2O)的质量为18.00t,则可以冶炼铬的质量为
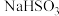 溶液(加入少量淀粉)中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝。为进一步研究有关因素对反应速率的影响,探究如下:
溶液(加入少量淀粉)中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝。为进一步研究有关因素对反应速率的影响,探究如下:(1)查阅资料知:
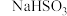 与过量KIO3反应分为两步进行,第一步反应的离子方程式为
与过量KIO3反应分为两步进行,第一步反应的离子方程式为 ,则第二步反应的离子方程式为
,则第二步反应的离子方程式为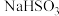 与过量KIO3反应中,慢反应是
与过量KIO3反应中,慢反应是(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响记录如表:
| 编号 | 0.01mol·L-1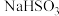 溶液/mL 溶液/mL | 0.01mol·L-1KIO3溶液/mL | H2O/mL | 反应温度/℃ | 液变蓝所用时间t/s |
| ① | 4.0 | 14.0 | 2.0 | 15 | t1 |
| ② | 6.0 | 14.0 | 0 | 15 | t2 |
| ③ | 6.0 | a | b | 25 | t3 |
(3)将
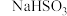 溶液与KIO3溶液在恒温条件下混合用速率检测仪检测出起始阶段反应速率逐渐增大。该小组对其原因提出假设,认为是生成的
溶液与KIO3溶液在恒温条件下混合用速率检测仪检测出起始阶段反应速率逐渐增大。该小组对其原因提出假设,认为是生成的 对反应起催化作用,故设计实验验证,试完成表中的内容。
对反应起催化作用,故设计实验验证,试完成表中的内容。| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
Ⅰ.在烧杯甲中将一定量的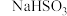 溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲) 溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲)Ⅱ.在烧杯乙中先加入少量 | 若v(甲) 若以(甲) |
3 . 对H2O2的分解速率影响因素进行研究。
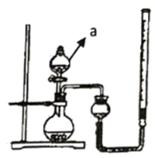
(1) A组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应。
| A | B | C |
10%H2O2/mL | 20.0 | V1 | V2 |
2 mol/LFeCl3/mL | 0 | 5.0 | 10.0 |
H2O/mL | V3 | V4 | 0 |
按要求回答下列问题:
①a装置的名称为
②若读数时发现,量气装置左端液面低于右端液面,则测得的气体体积
(2) B组在相同的温度下,利用下图甲装置对H2O2在不同条件下的分解速率进行了探究,得到乙曲线:
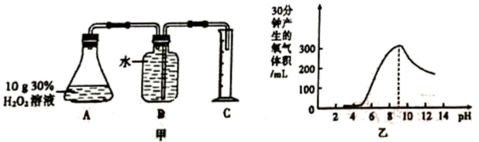
则B小组探究的是
(3)C小组利用如下装置探究100℃,H2O2在不同离子催化作用下反应24h的分解率,

实验编号 | 离子 | 加入量/(mg/L) | 分解率/% |
① | 无 | — | 2 |
② | Al3+ | 1.0 | 2 |
③ | Fe3+ | 1.0 | 15 |
④ | Cu2+ | 0.1 | 86 |
⑤ | Cr3+ | 0.1 | 96 |
则该小组实验时记录的数据应该是
 (未配平)。在4只小烧杯中分别加入
(未配平)。在4只小烧杯中分别加入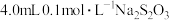 溶液与
溶液与 的稀硫酸。改变下表所示的条件:
的稀硫酸。改变下表所示的条件:| 小烧杯编号 | 小烧杯中新加入的物质 | 温度/℃ |
| i | 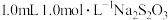 溶液 溶液 | 20 |
| ii | 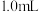 蒸馏水 蒸馏水 | 20 |
| iii | 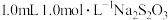 溶液 溶液 | 50 |
| iv | 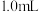 蒸馏水 蒸馏水 | 50 |
| A.i与ii对比可探究浓度对反应速率的影响 |
| B.i与iii对比可探究温度对反应速率的影响 |
C.生成沉淀的速率大小: |
| D.增大浓度、升高温度,反应速率增大 |
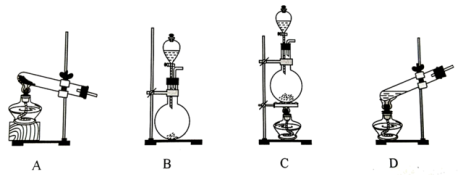
(1)标准状况下,22.4LO2的质量为
(2)在MnO2存在下用H2O2为原料制备O2,反应的化学方程式为
(3) 已知H2O2不与CI-反应。为探究FeCl3在H2O2制取O2反应中的作用, 某兴趣小组进行下列实验:向试管中加入5mL 11 mol∙L−1H2O2溶液,静置几分钟,无明显现象;滴加2滴1 mol∙L−1FeCl3溶液,立即产生大量气泡。
①加FeCl3溶液反应20min后,H2O2的浓度变为10.5 mol∙L−1,则20min内H2O2的平均反应速率为
②反应结束后,滴加KSCN溶液,试管中溶液呈红色。经测定,溶液中Fe3+的量没有变化。综合以上实验,可推断出:在H2O2制O2反应中,FeCl3作
(4)实验完毕,在离开实验室之前,应该完成的事项有
资料:该“碘钟实验”反应分A、B两步进行:
反应A:
 (慢)
(慢)反应B:
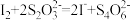 (快)
(快)(1)该“碘钟实验”的总反应是
(2)为证明反应A、B的存在,进行实验Ⅰ。
a.向K2S2O8溶液中加入试剂X的水溶液,溶液变为蓝色。
b.再向得到的蓝色溶液中加入试剂Y溶液,溶液的蓝色褪去。
试剂X是
(3)已知A反应的速率方程为: (
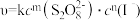 ),式中k为常数。为确定m、n值进行实验II。(溶液浓度均为0.01mol/L)
),式中k为常数。为确定m、n值进行实验II。(溶液浓度均为0.01mol/L)| 实验 序号 | 试剂体积V/mL | 显色时间 t/s | ||||
| K2S2O8溶液 | KI溶液 | 水 | Na2S2O3溶液 | 淀粉溶液 | ||
| ① | 10 | 10 | 0 | 4 | 1 | 27.0 |
| ② | 5 | 10 | 5 | 4 | 1 | 54.0 |
| ③ | 2.5 | 10 | V1 | 4 | 1 | 108.0 |
| ④ | 10 | 5 | 5 | 4 | 1 | 54.0 |
②通过数据计算得知:m=
(4)为探究其他因素对该“碘钟实验”的影响,进行实验III。(溶液浓度均为0.01mol/L)
| 试剂体积V/mL | ||||
| K2S2O8溶液 | KI溶液 | 水 | Na2S2O3溶液 | 淀粉溶液 |
| 10 | 5 | 3 | 6 | 1 |
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验III未产生颜色变化的原因:
| 实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/(mol•L-1) | 体积/mL | 浓度/(mol•L-1) | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.01 | 3.0 | 25 |
| ② | 0.20 | 2.0 | 0.01 | 3.0 | 25 |
| ③ | 0.20 | 2.0 | 0.01 | 3.0 | 50 |
(1)实验时发生反应的化学方程式为
(2)探究反应物浓度对反应速率影响的是实验
(3)测得实验①中溶液褪色的时间为30s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=
(4)实验过程中发现:在开始反应的一段时间内,反应速率较小,溶液褪色不明显;但不久反应速率明显增大,溶液很快褪色。导致上述现象的原因可能是
(5)草酸又称乙二酸,是一种二元弱酸。写出草酸在水中的第一步电离方程式:
| A.将食物存放在温度较低的地方 |
| B.火力发电厂将烟囱建的很高 |
| C.实验时,通常将颗粒状的固体药品研细混匀后进行反应 |
| D.将固体试剂溶于水配成溶液后再进行化学实验 |
反应i:H2O2(aq)+2I-(aq)+2H+(aq)=I2(aq)+2H2O(l)△H1=-247.5kJ·mol-1
反应ii:I2(aq)+2S2O
 (aq)=2I-(aq)+S4O
(aq)=2I-(aq)+S4O (aq)△H2=-1021.6kJ·mol-1
(aq)△H2=-1021.6kJ·mol-1(1)H2O2与S2O
 反应的热化学方程式为
反应的热化学方程式为(2)下列实验方案可证实上述反应过程。
将实验方案补充完整(所用试剂浓度均为0.01mol·L-1)。
①向酸化的H2O2溶液中加入
②向①中蓝色溶液中加入
(3)探究c(H+)对反应速率的影响,实验方案如表所示。(所用试剂除H2O以外,浓度均为0.01mol·L-1)
实验序号 | a | b | |
试剂 | H2O2/mL | 4.5 | X |
| H2SO4/mL | 4.5 | 2 | |
| Na2S2O3/mL | 8 | Y | |
| KI(含淀粉)/mL | 3 | Z | |
| H2O/mL | 0 | Q | |
| 将上述溶液迅速混合现象 | 溶液变蓝所需时间为t1秒 | 溶液变蓝所需时间为t2秒 | |
②对比实验a和实验b,t1
③结合(2)中现象解释溶液混合后一段时间才变蓝的原因:
④利用实验a的数据,计算t1时间内H2O2与S2O
 反应的平均反应速率(用H2O2浓度的变化表示),
反应的平均反应速率(用H2O2浓度的变化表示), CO2(g)+N2(g) ΔH=-365 kJ·mol-1。上述反应可用“Fe+”作催化剂,其总反应分两步进行:
CO2(g)+N2(g) ΔH=-365 kJ·mol-1。上述反应可用“Fe+”作催化剂,其总反应分两步进行:第一步:Fe++N2O=FeO++N2;
第二步:FeO++CO=Fe++CO2,第二步反应不影响总反应达到平衡所用的时间。
下列说法中正确的是
| A.FeO+也是该反应的催化剂 |
| B.第一步中Fe+与N2O的碰撞仅部分有效 |
| C.第二步反应速率大于第一步反应速率 |
| D.增大CO的浓度可显著增大处理N2O的反应速率 |




