名校
1 . 下列过程中,化学反应速率减小对人类无益的是
| A.金属的腐蚀 | B.食物的腐败 | C.塑料的老化 | D.氨的合成 |
您最近一年使用:0次
2022-10-16更新
|
706次组卷
|
24卷引用:辽宁省大连市普兰店第三十八中学2020-2021学年高二上学期第二次考试化学试题
辽宁省大连市普兰店第三十八中学2020-2021学年高二上学期第二次考试化学试题(已下线)2012-2013学年河北省衡水市第十四中学高二下学期期末考试化学试卷河南省项城三高2017-2018学年高一下学期第二次段考(B卷)化学试题(已下线)2018年9月3日 《每日一题》人教必修4-对化学反应速率的理解【校级联考】福建省闽侯二中五校教学联合体2017-2018学年高二上学期期中考试化学试题云南省玉溪市江川区第二中学2018-2019学年高一下学期开学考试化学试题吉林省吉林市第三中学2018-2019学年高一5月阶段测试化学试题吉林省辽源市田家炳高级中学2019-2020学年高二上学期期中考试化学试题北京师范大学珠海分校附属外国语学校2019-2020学年高一下学期期末考试化学试题黑龙江省哈尔滨市第三中学2022-2023学年高二上学期第二次验收化学试题河南省濮阳市元龙高级中学2021-2022学年高二下学期第一次质量检测化学试题辽宁省辽东南协作校2023-2024学年高二上学期10月月考化学试题四川省自贡市第一中学校2023-2024学年高二上学期12月月考化学试题(人教版2019)必修第二册 第六章 化学反应与能量 第二节 化学反应的速率与限度甘肃省白银市靖远县第四中学2020-2021学年高一下学期期中考试化学(文)试题黑龙江省鹤岗市第一中学2021-2022学年高二上学期开学考试化学试题黑龙江省佳木斯市第一中学2021-2022 学年高二上学期期中考试化学试题人教2019版选择性必修一第二章 第一节 化学反应速率 课后习题北京市丰台区2021-2022学年高二上学期期中练习化学(B)试题北京市中国农业大学附属中学2021-2022学年高二上学期期中学业水平调研化学试题北京市顺义区杨镇第一中学2022-2023学年高二上学期期中检测化学试题天津市南开大学附属中学2022-2023学年高二上学期期中阶段检测化学试题黑龙江省虎林市高级中学2022-2023学年高二上学期期中考试化学试题北京市丰台区2022-2023学年高二上学期期末考试化学试题
10-11高二上·新疆阿勒泰·阶段练习
名校
解题方法
2 . 下列过程中需要加快反应速率的是
| A.钢铁腐蚀 | B.工业炼钢 | C.食物腐烂 | D.塑料老化 |
您最近一年使用:0次
2021-02-08更新
|
121次组卷
|
25卷引用:2010年新疆哈巴河县高级中学高二上学期第一次月考化学试题
(已下线)2010年新疆哈巴河县高级中学高二上学期第一次月考化学试题(已下线)2013届山东省德州市某中学高三12月月考化学试卷甘肃省武威第十八中学2017-2018学年高二上学期第二次月考化学试题黑龙江省八校2020-2021学年高二上学期摸底考试化学试题(已下线)2011-2012年广西北海合浦县教育局教研室高二上学期期中考试化学(理)试卷(已下线)2011-2012年山东济南外国语学校高二下学期期中考试文科化学试卷(已下线)2012-2013学年甘肃永昌一中高二上学期期中考试文科化学试卷(已下线)2012-2013学年浙江省宁海县正学中学高二下学期第一次阶段性测试化学试卷2014-2015河南省周口中英文学校高一下学期期中考试化学试卷2014-2015学年安徽省淮北师大附属实验中学高一下期中化学试卷2015-2016学年河南省三门峡市陕州中学高二上学期期中测试化学试卷2016-2017学年河北省武邑中学高二上入学考试化学试卷2016-2017学年河北省武邑中学高二上8.28周考化学卷2016-2017学年河北省武邑中学高二上9.21周考化学卷安徽省滁州市定远县西片三校2017-2018学年高二上学期期末考试化学试题【全国百强校】福建省厦门第一中学2017-2018学年高二下学期期中考试化学试题黑龙江省伊春市第二中学2017-2018学年高一下学期期末考试(文)化学试题黑龙江省伊春市第二中学2018-2019学年高二(理)上学期期中考试化学试题湖南省邵东县创新实验学校2018-2019学年高一下学期期中考试化学试题2016-2017学年上海市闵行区七宝中学高二(上)开学化学试卷福建省福州福清市2017-2018学年高二上学期期中考试化学(理)试题吉林省辽源市田家炳高级中学校2020-2021学年高二上学期期中考试化学试题云南省玉溪第二中学2020-2021学年高二上学期期中质量检测化学试题新疆乌鲁木齐市第二十中学2020-2021学年高二上学期期末考试化学试题陕西省汉滨区五里高级中学2022-2023学年高二上学期期中考试化学试题
解题方法
3 . 某小组进行实验:向硫酸酸化的过氧化氢溶液中加入碘化钾、淀粉和硫代硫酸钠的混合溶液,一段时间后溶液变蓝。查阅资料知体系中存在两个主要反应:
反应i:H2O2(aq)+2I-(aq)+2H+(aq)=I2(aq)+2H2O(l)△H1=-247.5kJ·mol-1
反应ii:I2(aq)+2S2O (aq)=2I-(aq)+S4O
(aq)=2I-(aq)+S4O (aq)△H2=-1021.6kJ·mol-1
(aq)△H2=-1021.6kJ·mol-1
(1)H2O2与S2O 反应的热化学方程式为
反应的热化学方程式为___ 。
(2)下列实验方案可证实上述反应过程。
将实验方案补充完整(所用试剂浓度均为0.01mol·L-1)。
①向酸化的H2O2溶液中加入___ 溶液,溶液几秒后变为蓝色。
②向①中蓝色溶液中加入___ 溶液,溶液立即褪色。
(3)探究c(H+)对反应速率的影响,实验方案如表所示。(所用试剂除H2O以外,浓度均为0.01mol·L-1)
①将实验b补充完整,X=___ 、Q=___ 。
②对比实验a和实验b,t1___ (填“>”或“<”)t2。
③结合(2)中现象解释溶液混合后一段时间才变蓝的原因:___ 。
④利用实验a的数据,计算t1时间内H2O2与S2O 反应的平均反应速率(用H2O2浓度的变化表示),
反应的平均反应速率(用H2O2浓度的变化表示),___ mol·L-1·s-1。
反应i:H2O2(aq)+2I-(aq)+2H+(aq)=I2(aq)+2H2O(l)△H1=-247.5kJ·mol-1
反应ii:I2(aq)+2S2O
 (aq)=2I-(aq)+S4O
(aq)=2I-(aq)+S4O (aq)△H2=-1021.6kJ·mol-1
(aq)△H2=-1021.6kJ·mol-1(1)H2O2与S2O
 反应的热化学方程式为
反应的热化学方程式为(2)下列实验方案可证实上述反应过程。
将实验方案补充完整(所用试剂浓度均为0.01mol·L-1)。
①向酸化的H2O2溶液中加入
②向①中蓝色溶液中加入
(3)探究c(H+)对反应速率的影响,实验方案如表所示。(所用试剂除H2O以外,浓度均为0.01mol·L-1)
实验序号 | a | b | |
试剂 | H2O2/mL | 4.5 | X |
| H2SO4/mL | 4.5 | 2 | |
| Na2S2O3/mL | 8 | Y | |
| KI(含淀粉)/mL | 3 | Z | |
| H2O/mL | 0 | Q | |
| 将上述溶液迅速混合现象 | 溶液变蓝所需时间为t1秒 | 溶液变蓝所需时间为t2秒 | |
②对比实验a和实验b,t1
③结合(2)中现象解释溶液混合后一段时间才变蓝的原因:
④利用实验a的数据,计算t1时间内H2O2与S2O
 反应的平均反应速率(用H2O2浓度的变化表示),
反应的平均反应速率(用H2O2浓度的变化表示),
您最近一年使用:0次
2020-11-06更新
|
109次组卷
|
3卷引用:河南省豫南九校2020-2021学年高二上学期第二次联考化学试题
名校
4 . 处理、回收CO是环境科学家研究的热点课题。CO用于处理大气污染物N2O,发生的反应为:N2O(g)+CO(g)  CO2(g)+N2(g) ΔH=-365 kJ·mol-1。上述反应可用“Fe+”作催化剂,其总反应分两步进行:
CO2(g)+N2(g) ΔH=-365 kJ·mol-1。上述反应可用“Fe+”作催化剂,其总反应分两步进行:
第一步:Fe++N2O=FeO++N2;
第二步:FeO++CO=Fe++CO2,第二步反应不影响总反应达到平衡所用的时间。
下列说法中正确的是
 CO2(g)+N2(g) ΔH=-365 kJ·mol-1。上述反应可用“Fe+”作催化剂,其总反应分两步进行:
CO2(g)+N2(g) ΔH=-365 kJ·mol-1。上述反应可用“Fe+”作催化剂,其总反应分两步进行:第一步:Fe++N2O=FeO++N2;
第二步:FeO++CO=Fe++CO2,第二步反应不影响总反应达到平衡所用的时间。
下列说法中正确的是
| A.FeO+也是该反应的催化剂 |
| B.第一步中Fe+与N2O的碰撞仅部分有效 |
| C.第二步反应速率大于第一步反应速率 |
| D.增大CO的浓度可显著增大处理N2O的反应速率 |
您最近一年使用:0次
2020-11-05更新
|
210次组卷
|
2卷引用:湖北省四地六校2020-2021学年高二上学期联合考试化学试题
名校
解题方法
5 . 下列反应条件的改变对4Fe+3O2+xH2O=2Fe2O3·xH2O速率的影响不正确的是
| A.增大O2的浓度能加快生锈速率 | B.潮湿环境中铁生锈的速率更快 |
| C.升高温度能加快生锈速率 | D.干燥空气中铁生锈速率更快 |
您最近一年使用:0次
2020-11-02更新
|
261次组卷
|
3卷引用:江苏省徐州市沛县2020-2021学年高二上学期第一次学情调研化学(必修)试题
名校
6 . 下列生产生活中需要增大化学反应速率的是
A.铁桥生锈 | B.牛奶变质 | C.塑料老化 | D.高炉炼铁 |
您最近一年使用:0次
2020-10-10更新
|
542次组卷
|
13卷引用:河北省邢台市2017-2018学年高二上学期第一次月考化学试题
河北省邢台市2017-2018学年高二上学期第一次月考化学试题云南省昆明市黄冈实验学校2017-2018学年高一下学期第三次月考化学试题四川省广安市北京师范大学广安实验学校2020-2021学年高二上学期9月月考化学试题河北省邢台市2020-2021学年高二上学期第一次9月联考化学试题重庆市第七中学校2020-2021学年高二上学期12月考化学试题河北省承德市联校2017-2018学年高二上学期期末考试化学试题新疆维吾尔自治区昌吉市第九中学2018-2019学年高二上学期期末考试化学试题甘肃省永昌四中2019-2020学年高二上学期期中考试化学试题人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第一节 化学反应速率陕西省黄陵中学2020-2021学年高二(本部)上学期期中考试化学试题甘肃省静宁县第一中学2021-2022学年高二上学期第一次月考(普通班)化学试题陕西省泾阳县2020-2021学年高二上学期期中考试化学试题天津市第三中学2022-2023学年高二上学期期中考试化学试题
名校
7 . 某研究小组探究催化剂对CO、NO转化的影响。将含NO和CO的尾气以一定的流速通过两种不同的催化剂进行反应:2NO(g)+2CO(g)  N2(g)+2CO2(g),ΔH<0,相同时间内测量逸出气体中NO含量, 从而确定尾气脱氮率(脱氮率即NO的转化率),结果如下图所示。以下说法正确的是( )
N2(g)+2CO2(g),ΔH<0,相同时间内测量逸出气体中NO含量, 从而确定尾气脱氮率(脱氮率即NO的转化率),结果如下图所示。以下说法正确的是( )
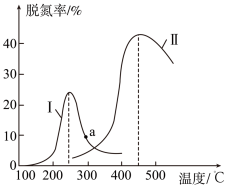
①两种催化剂均能降低活化能,但ΔH不变
②相同条件下,改变压强对脱氮率没有影响
③曲线Ⅱ中的催化剂适用于450 ℃左右脱氮
④曲线Ⅱ中催化剂脱氮率比曲线Ⅰ中的高
⑤ a 点是对应温度下的平衡脱氮率
⑥若低于200 ℃,图中曲线Ⅰ脱氮率随温度升高而变化不大的主要原因是催化剂的活性不高
 N2(g)+2CO2(g),ΔH<0,相同时间内测量逸出气体中NO含量, 从而确定尾气脱氮率(脱氮率即NO的转化率),结果如下图所示。以下说法正确的是( )
N2(g)+2CO2(g),ΔH<0,相同时间内测量逸出气体中NO含量, 从而确定尾气脱氮率(脱氮率即NO的转化率),结果如下图所示。以下说法正确的是( )
①两种催化剂均能降低活化能,但ΔH不变
②相同条件下,改变压强对脱氮率没有影响
③曲线Ⅱ中的催化剂适用于450 ℃左右脱氮
④曲线Ⅱ中催化剂脱氮率比曲线Ⅰ中的高
⑤ a 点是对应温度下的平衡脱氮率
⑥若低于200 ℃,图中曲线Ⅰ脱氮率随温度升高而变化不大的主要原因是催化剂的活性不高
| A.①③⑥ | B.①③④ | C.②③④ | D.①③⑤ |
您最近一年使用:0次
名校
解题方法
8 . 苯乙烯(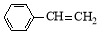 )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得: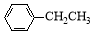

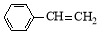 +H2(g)
+H2(g)
(1)已知:
计算上述反应生成1mol氢气的热效应___ (填吸放多少kJ)
(2)工业上,通常在乙苯(EB)蒸气中掺混N2(原料气中乙苯和N2的物质的量之比为1︰10,N2不参与反应),控制反应温度600℃,并保持体系总压为0.1Mpa不变的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图。
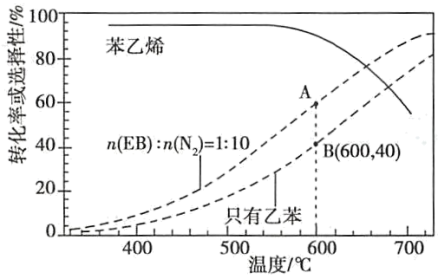
①A、B两点对应的正反应速率较大的是___ 。
②控制反应温度为600℃的理由是___ 。
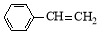 )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得: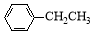

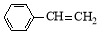 +H2(g)
+H2(g)(1)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ/mol | 412 | 348 | 612 | 436 |
计算上述反应生成1mol氢气的热效应
(2)工业上,通常在乙苯(EB)蒸气中掺混N2(原料气中乙苯和N2的物质的量之比为1︰10,N2不参与反应),控制反应温度600℃,并保持体系总压为0.1Mpa不变的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图。

①A、B两点对应的正反应速率较大的是
②控制反应温度为600℃的理由是
您最近一年使用:0次
解题方法
9 . 某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有__ 。
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应容器中,收集产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中:V1=__ ,V6=__ ,V9=__ ;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因__ 。
(1)上述实验中发生反应的化学方程式有
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应容器中,收集产生的气体,记录获得相同体积的气体所需时间。
| A | B | C | D | E | F | |
| 4mol·L-1H2SO4溶液/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
您最近一年使用:0次
10 . 为了提升食品的品质,在食品加工中可合理使用添加剂。下列添加剂与反应速率有关的是
| A.着色剂 | B.调味剂 | C.防腐剂 | D.增白剂 |
您最近一年使用:0次
2020-05-01更新
|
262次组卷
|
5卷引用:山西省太原市第五中学2020-2021学年高二上学期10月月考试题



