名校
1 . 近年来甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样。现有实验室中模拟甲醇合成反应,在2 L密闭容器内,400 ℃时反应:CO(g)+2H2(g) CH3OH(g) △H<0,体系中n(CO)随时间的变化如表:
CH3OH(g) △H<0,体系中n(CO)随时间的变化如表:
(1)图中表示CH3OH的变化的曲线是_______ 。
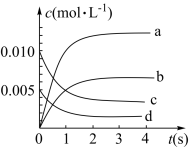
(2)用H2表示从0~2s内该反应的平均速率v(H2)=_______ 。
(3)能说明该反应已达到平衡状态的是_______ 。
a.反应中CO与CH3OH的物质的量之比为1:1
b.容器内压强保持不变
c.2v逆(CO)=v正(H2)
d.单位时间内每消耗1molCO,同时生成1molCH3OH
(4)CH3OH与O2的反应可将化学能转化为电能,工作原理如图所示,则CH3OH应从_______ (填A或B)通入,K+移向 _______ (填a、b极) 当电路中累计有2mol电子通过时,消耗的氧气体积为(在标准状况下)_______ L

 CH3OH(g) △H<0,体系中n(CO)随时间的变化如表:
CH3OH(g) △H<0,体系中n(CO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 5 |
| n(CO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |

(2)用H2表示从0~2s内该反应的平均速率v(H2)=
(3)能说明该反应已达到平衡状态的是
a.反应中CO与CH3OH的物质的量之比为1:1
b.容器内压强保持不变
c.2v逆(CO)=v正(H2)
d.单位时间内每消耗1molCO,同时生成1molCH3OH
(4)CH3OH与O2的反应可将化学能转化为电能,工作原理如图所示,则CH3OH应从

您最近一年使用:0次
名校
解题方法
2 . 光气(COCl2)在农药、医药等领域都有许多用途。一定温度下,恒容密闭容器中,CO与Cl2在催化剂的作用下发生反应:CO(g)+Cl2(g)⇌COCl2(g)。下列说法能充分说明该反应已经达到化学平衡状态的是
| A.每生成1mol光气,消耗1mol一氧化碳 |
| B.CO、Cl2、COCl2的浓度相等 |
| C.CO、Cl2、COCl2在密闭容器中共存 |
| D.CO、Cl2、COCl2的浓度不再变化 |
您最近一年使用:0次
2020-07-03更新
|
254次组卷
|
2卷引用:北京市中国人民大学附属中学 2019-2020 学年高一下学期期末练习化学试题
名校
3 . 乙酸乙酯是一种非常重要的有机化工原料,用途十分广泛.根据所学内容填空。
I.由乙烯合成乙酸乙酯的流程如下;
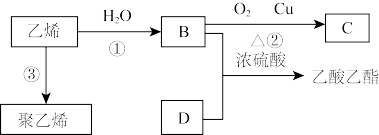
(1)写出B与D反应的化学方程式________ ;反应类型:_________ ;
(2)写出反应③的化学方程式:_________ 。
II.实验室用如图所示装置制备乙酸乙酯.
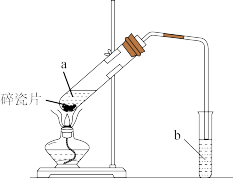
(1)实验前,向试管a中加入3mL______ ,然后边振荡试管边慢慢加入2mL______ 和2mL乙酸。
(2)试管b中盛放的试剂是饱和_____ 溶液。试管b中的导管不能伸入液面下的原因是____ 。
(3)反应结束后,从试管b中分离出乙酸乙酯的方法是______ 。
(4)下列描述不能说明乙醇与乙酸的反应已达到化学平衡状态的有_____ (填序号)。
a.单位时间里,生成lmol乙酸乙酯,同时生成lmol水
b.单位时间区,生成lmol乙酸乙酯,同时生成1mol乙酸
c.单位时间里,消耗lmol乙醇,同时消耗1mol乙酸
d.正反应的速率与逆反应的速率相等
e.混合物中各物质的浓度不再变化
I.由乙烯合成乙酸乙酯的流程如下;

(1)写出B与D反应的化学方程式
(2)写出反应③的化学方程式:
II.实验室用如图所示装置制备乙酸乙酯.

(1)实验前,向试管a中加入3mL
(2)试管b中盛放的试剂是饱和
(3)反应结束后,从试管b中分离出乙酸乙酯的方法是
(4)下列描述不能说明乙醇与乙酸的反应已达到化学平衡状态的有
a.单位时间里,生成lmol乙酸乙酯,同时生成lmol水
b.单位时间区,生成lmol乙酸乙酯,同时生成1mol乙酸
c.单位时间里,消耗lmol乙醇,同时消耗1mol乙酸
d.正反应的速率与逆反应的速率相等
e.混合物中各物质的浓度不再变化
您最近一年使用:0次
2020-07-16更新
|
682次组卷
|
3卷引用:黑龙江省大庆中学2019-2020学年高一下学期期末考试化学试题
4 . 二氧化碳是用途非常广泛的化工基础原料,回答下列问题:
(1)工业上可以用CO2来生产燃料甲醇。
已知:CO2(g) +3H2(g) ⇌ CH3OH(l) +H2O(l) H= -130kJmol-1
2H2(g)+O2(g)=2H2O(l) H=-572kJmol-1
CH3OH(1)的燃烧热H=________ kJmol-1。
(2)在催化剂作用下,CO2和CH4可直接转化为乙酸:CO2(g)+CH4(g)=CH3COOH(g) H>0,在不同温度下乙酸的生成速率变化如图所示。
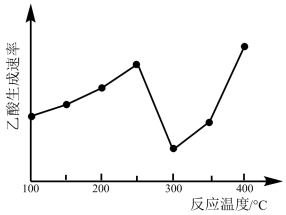
①当温度在250°C-300°C范围时,乙酸的生成速率减慢的主要原因是___________ 。
②欲使乙酸的平衡产率提高,应采取的措施是__________ (任写一条措施即可)。
(3)一定条件下,在密闭容器中发生反应,2CO(g) ⇌C(s)+CO2(g).
①下列能说明该反应达到平衡的是______________ 。
A 容器内混合物的质量不变
B CO和CO2的物质的量之比不再变化
C 混合气体的平均摩尔质量不再变化
D 生成amolCO2的同时消耗2amol.CO
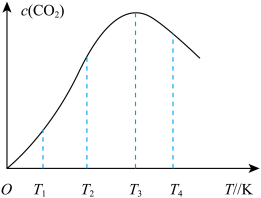
②向某恒容容器中通入一定量的CO发生上述反应,在不同温度下CO2的物质的量浓度c (CO2)随温度的变化如上图所示,则该反应为________ (填“放热”或“吸热”)反应。
③向容积可变的某恒压容器中通入amolCO,T°C时反应经过10min达平衡,CO的体积分数为75%。CO的平衡转化率为________ 。在容积改变的条件下,反应速率可用单位时间内反应物成生成物的物质的量变化来表示,则0-10min内平均反应速率v(CO2)=________ 。
(1)工业上可以用CO2来生产燃料甲醇。
已知:CO2(g) +3H2(g) ⇌ CH3OH(l) +H2O(l) H= -130kJmol-1
2H2(g)+O2(g)=2H2O(l) H=-572kJmol-1
CH3OH(1)的燃烧热H=
(2)在催化剂作用下,CO2和CH4可直接转化为乙酸:CO2(g)+CH4(g)=CH3COOH(g) H>0,在不同温度下乙酸的生成速率变化如图所示。

①当温度在250°C-300°C范围时,乙酸的生成速率减慢的主要原因是
②欲使乙酸的平衡产率提高,应采取的措施是
(3)一定条件下,在密闭容器中发生反应,2CO(g) ⇌C(s)+CO2(g).
①下列能说明该反应达到平衡的是
A 容器内混合物的质量不变
B CO和CO2的物质的量之比不再变化
C 混合气体的平均摩尔质量不再变化
D 生成amolCO2的同时消耗2amol.CO

②向某恒容容器中通入一定量的CO发生上述反应,在不同温度下CO2的物质的量浓度c (CO2)随温度的变化如上图所示,则该反应为
③向容积可变的某恒压容器中通入amolCO,T°C时反应经过10min达平衡,CO的体积分数为75%。CO的平衡转化率为
您最近一年使用:0次
2019-12-16更新
|
506次组卷
|
2卷引用:广东省深圳市新安中学2019-2020学年高二上学期期中考试化学试题



