名校
1 . 合成氨是人工固氮比较成熟的技术,在工业上有重要的用途。
(1)已知化学键的键能如下表,
_______ 。
(2)恒温条件下,在体积固定的容器中发生合成氨的反应,下列叙述表明反应已达平衡状态的是_______ 。
①体系压强保持不变
②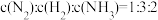
③每消耗 ,有
,有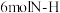 键发生断裂
键发生断裂
④混合气体的密度保持不变
⑤混合气体的平均摩尔质量保持不变
⑥v正(NH3)=0
(3)合成氨反应的平衡常数与温度的对应关系如下表:
试解释平衡常数随温度的升高而减小的原因_______ 。工业上合成氨一般以α-铁触媒为催化剂,400~500℃条件下反应,选取该反应温度而非室温或更高温度的原因是_______ 。
(4)在恒温条件下实验室模拟合成氨反应,甲、乙两容器充入相同量的N2与H2后体积相同,甲容器保持体积不变,乙容器保持压强不变,则反应到达平衡状态时,转化率甲_______ 乙(填“>”、“<”或“=”)。
(1)已知化学键的键能如下表,

| 化学键 | H-H | N≡N | N-H | N-N |
| 键能(kJ·mol-1) | 435.9 | 946.5 | 391.1 | 192.8 |
(2)恒温条件下,在体积固定的容器中发生合成氨的反应,下列叙述表明反应已达平衡状态的是
①体系压强保持不变
②
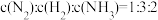
③每消耗
 ,有
,有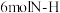 键发生断裂
键发生断裂④混合气体的密度保持不变
⑤混合气体的平均摩尔质量保持不变
⑥v正(NH3)=0
(3)合成氨反应的平衡常数与温度的对应关系如下表:
| 温度(℃) | 25 | 400 | 450 |
| 平衡常数 | 5×108 | 0.507 | 0.152 |
试解释平衡常数随温度的升高而减小的原因
(4)在恒温条件下实验室模拟合成氨反应,甲、乙两容器充入相同量的N2与H2后体积相同,甲容器保持体积不变,乙容器保持压强不变,则反应到达平衡状态时,转化率甲
您最近一年使用:0次
名校
2 . 合成氨是人工固氮比较成熟的技术,在工业上有重要的用途。
(1)已知化学键的键能如下表,则N2(g)+3H2(g) 2NH3(g) △H=
2NH3(g) △H=___ 。
(2)恒温条件下,在体积固定的容器中发生合成氨的反应,下列叙述表明反应已达平衡状态的是_____ 。
①体系压强保持不变 ②c(N2):c(H2):c(NH3)=1:3:2
③每消耗1mol N2,有6mol N﹣H键发生断裂 ④混合气体的密度保持不变
⑤混合气体的平均摩尔质量保持不变 ⑥v正(NH3)=0
(3)合成氨反应的平衡常数与温度的对应关系如下表:
试解释平衡常数随温度的升高而减小的原因________ 。工业上合成氨一般以α﹣铁触媒为催化剂,400~500℃条件下反应,选取该反应温度而非室温或更高温度的原因是_________ 。
(4)肼(N2H4)又称联氨,可看成是氨气中的氢原子被氨基取代后的产物,常用作火箭的液体燃料。肼燃料电池的原理如图所示,则负极发生的电极反应式为___________
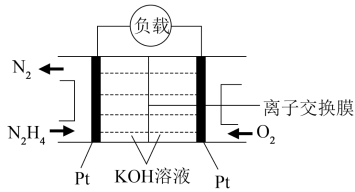
(1)已知化学键的键能如下表,则N2(g)+3H2(g)
 2NH3(g) △H=
2NH3(g) △H=| 化学键 | H﹣H | N≡N | N﹣H | N﹣N |
| 键能/kJ•mol﹣1 | 435.9 | 946.5 | 391.1 | 192.8 |
①体系压强保持不变 ②c(N2):c(H2):c(NH3)=1:3:2
③每消耗1mol N2,有6mol N﹣H键发生断裂 ④混合气体的密度保持不变
⑤混合气体的平均摩尔质量保持不变 ⑥v正(NH3)=0
(3)合成氨反应的平衡常数与温度的对应关系如下表:
| 温度(℃) | 25 | 400 | 450 |
| 平衡常数 | 5×108 | 0.507 | 0.152 |
(4)肼(N2H4)又称联氨,可看成是氨气中的氢原子被氨基取代后的产物,常用作火箭的液体燃料。肼燃料电池的原理如图所示,则负极发生的电极反应式为

您最近一年使用:0次
3 . 合成氨是人工固氮比较成熟的技术,在工业上有重要的用途。
(1)已知化学键的键能如下表,则N2(g)+3H2(g) 2NH3(g) △H=
2NH3(g) △H=_____________ 。
(2)恒温条件下,在体积固定的容器中发生合成氨的反应,下列叙述表明反应已达平衡状态的是_____________ 。
①体系压强保持不变 ②c(N2):c(H2):c(NH3)=1:3:2
③每消耗1 mol N2,有6 mol N-H键发生断裂 ④混合气体的密度保持不变
⑤混合气体的平均摩尔质量保持不变 ⑥v正(NH3)=0
(3)合成氨反应的平衡常数与温度的对应关系如下表:
试解释平衡常数随温度的升高而减小的原因__________________________ 。工业上合成氨一般以α-铁触媒为催化剂,400~500℃条件下反应,选取该反应温度而非室温或更高温度的原因是____________________________________________________ 。
(4)在恒温条件下实验室模拟合成氨反应,甲、乙两容器充入相同量的N2与H2后体积相同,甲容器保持体积不变,乙容器保持压强不变,则反应到达平衡状态时,转化率甲_____________ 乙(填“>”、“<”或“=”)。反应达平衡后向甲容器中再充入一定量的NH3,则甲容器中H2的转化率_____________ (填“增大”、“减小”或“不变”)。
(5)肼(N2H4)又称联氨可看成是氨气中的氢原子被氨基取代后的产物,常用作火箭的液体燃料。肼燃料电池的原理如下图所示,则负极发生的电极反应式为______________________ 。
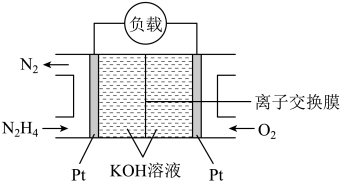
(1)已知化学键的键能如下表,则N2(g)+3H2(g)
 2NH3(g) △H=
2NH3(g) △H=| 化学键 | H—H |  | N—H | N—N |
| 键能(kJ·mol-1) | 435.9 | 946.5 | 391.1 | 192.8 |
(2)恒温条件下,在体积固定的容器中发生合成氨的反应,下列叙述表明反应已达平衡状态的是
①体系压强保持不变 ②c(N2):c(H2):c(NH3)=1:3:2
③每消耗1 mol N2,有6 mol N-H键发生断裂 ④混合气体的密度保持不变
⑤混合气体的平均摩尔质量保持不变 ⑥v正(NH3)=0
(3)合成氨反应的平衡常数与温度的对应关系如下表:
| 温度(℃) | 25 | 400 | 450 |
| 平衡常数 | 5×108 | 0.507 | 0.152 |
试解释平衡常数随温度的升高而减小的原因
(4)在恒温条件下实验室模拟合成氨反应,甲、乙两容器充入相同量的N2与H2后体积相同,甲容器保持体积不变,乙容器保持压强不变,则反应到达平衡状态时,转化率甲
(5)肼(N2H4)又称联氨可看成是氨气中的氢原子被氨基取代后的产物,常用作火箭的液体燃料。肼燃料电池的原理如下图所示,则负极发生的电极反应式为

您最近一年使用:0次
4 . 在人们高度重视环境和保护环境的今天,消除和利用硫氧化物、氮氧化物、碳氧化物对改善大气质量具有重要的意义。
(1)在绝热的某刚性容器中置入2mol 和1mol
和1mol ,发生反应:
,发生反应:
 。下列说法中能够判断该反应一定处于平衡状态的有
。下列说法中能够判断该反应一定处于平衡状态的有_______ (填数字序号)。
①容器中 、
、 、
、 共存
共存
②单位时间内生成2mol 的同时消耗2mol
的同时消耗2mol
③反应容器中压强不随时间变化
④容器中温度恒定不变
⑤容器中 、
、 、
、 的物质的量之比为2∶1∶2
的物质的量之比为2∶1∶2
(2)氮氧化物是造成光化学污染的罪魁祸首,用一氧化碳还原氮氧化物,可防止氮氧化物污染,如反应:
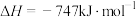 。
。
①已知该反应在不同条件下的化学反应速率如下:
a. b.
b.
c. d.
d.
上述4种情况反应速率最快的是_______ (填字母)
②实验测得反应
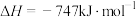 ,
,
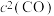 ,
,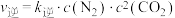 (
( 、
、 为速率常数,只与温度有关)。一定温度下达到平衡时
为速率常数,只与温度有关)。一定温度下达到平衡时 。
。
达到平衡后,仅升高温度,平衡向_______ 移动(填“正反应方向”“逆反应方向”或“不”),
_______ (填“增大”“减小”或“不变”)。
(3)已知:
 。将1mol CO和2mol
。将1mol CO和2mol 充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:

①
_______ 0(填“>”或“<”)。
②由图可知,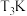 前反应中CO的转化率随温度升高而增大,原因是
前反应中CO的转化率随温度升高而增大,原因是_______ 。
③已知c点时容器内的压强为p,在 温度下该反应的压强平衡常数
温度下该反应的压强平衡常数 为
为_______ (用含p的关系式表示)。( 为以分压表示的平衡常数,分压=总压×物质的量分数)
为以分压表示的平衡常数,分压=总压×物质的量分数)
(1)在绝热的某刚性容器中置入2mol
 和1mol
和1mol ,发生反应:
,发生反应:
 。下列说法中能够判断该反应一定处于平衡状态的有
。下列说法中能够判断该反应一定处于平衡状态的有①容器中
 、
、 、
、 共存
共存②单位时间内生成2mol
 的同时消耗2mol
的同时消耗2mol
③反应容器中压强不随时间变化
④容器中温度恒定不变
⑤容器中
 、
、 、
、 的物质的量之比为2∶1∶2
的物质的量之比为2∶1∶2(2)氮氧化物是造成光化学污染的罪魁祸首,用一氧化碳还原氮氧化物,可防止氮氧化物污染,如反应:

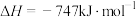 。
。①已知该反应在不同条件下的化学反应速率如下:
a.
 b.
b.
c.
 d.
d.
上述4种情况反应速率最快的是
②实验测得反应

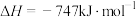 ,
,
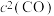 ,
,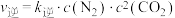 (
( 、
、 为速率常数,只与温度有关)。一定温度下达到平衡时
为速率常数,只与温度有关)。一定温度下达到平衡时 。
。达到平衡后,仅升高温度,平衡向

(3)已知:

 。将1mol CO和2mol
。将1mol CO和2mol 充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
①

②由图可知,
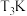 前反应中CO的转化率随温度升高而增大,原因是
前反应中CO的转化率随温度升高而增大,原因是③已知c点时容器内的压强为p,在
 温度下该反应的压强平衡常数
温度下该反应的压强平衡常数 为
为 为以分压表示的平衡常数,分压=总压×物质的量分数)
为以分压表示的平衡常数,分压=总压×物质的量分数)
您最近一年使用:0次
名校
解题方法
5 . 在人们高度重视环境和保护环境的今天,消除和利用硫氧化物、氮氧化物、碳氧化物对改善大气质量具有重要的意义。
(1)在绝热的某刚性容器中置入 和
和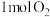 ,发生反应:
,发生反应:
 。下列说法中能够判断该反应一定处于平衡状态的有
。下列说法中能够判断该反应一定处于平衡状态的有___________ (填数字序号)。
①容器中 、
、 、
、 共存 ②单位时间内生成
共存 ②单位时间内生成 的同时消耗
的同时消耗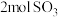
③反应容器中压强不随时间变化 ④容器中温度恒定不变
⑤容器中 、
、 、
、 的物质的量之比为2∶1∶2
的物质的量之比为2∶1∶2
(2)氮氧化物是造成光化学污染的罪魁祸首,用一氧化碳还原氮氧化物,可防止氮氧化物污染,如反应:
 =
= 。
。
①已知该反应在不同条件下的化学反应速率如下:
a.v(CO)=1.5 mol·L-1·min-1 b.v(NO)=0.03 mol·L-1·s-1
c.v(N2)=0.6 mol·L-1·min-1 d.v(CO2)=1.6 mol·L-1·min-1
上述4种情况反应速率最快的是___________ (填字母)。
②实验测得反应2CO(g)+2NO(g) 2CO2(g)+N2 (g)
2CO2(g)+N2 (g)  =
= ,v正=k正•c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。在一定温度下达到平衡时v正 = v逆,则
,v正=k正•c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。在一定温度下达到平衡时v正 = v逆,则
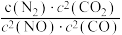 ,达到平衡后,仅升高温度,平衡向
,达到平衡后,仅升高温度,平衡向___________ 移动(填“正反应方向”“逆反应方向”或“不”)。k正增大的倍数___________ (填“>”、“<”或“=”)k逆增大的倍数。
(3)已知:
 。将1mol CO和
。将1mol CO和 充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
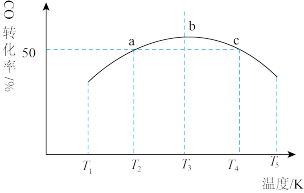
①
___________ 0(填“>”或“<”)。
②由图可知,T3前反应中CO的转化率随温度升高而增大,原因是___________ 。
③已知c点时容器内的压强为p,在 温度下该反应的压强平衡常数
温度下该反应的压强平衡常数 为
为___________ (用含p的关系式表示)。( 为以分压表示的平衡常数,分压=总压×物质的量分数)
为以分压表示的平衡常数,分压=总压×物质的量分数)
(1)在绝热的某刚性容器中置入
 和
和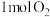 ,发生反应:
,发生反应:
 。下列说法中能够判断该反应一定处于平衡状态的有
。下列说法中能够判断该反应一定处于平衡状态的有①容器中
 、
、 、
、 共存 ②单位时间内生成
共存 ②单位时间内生成 的同时消耗
的同时消耗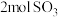
③反应容器中压强不随时间变化 ④容器中温度恒定不变
⑤容器中
 、
、 、
、 的物质的量之比为2∶1∶2
的物质的量之比为2∶1∶2(2)氮氧化物是造成光化学污染的罪魁祸首,用一氧化碳还原氮氧化物,可防止氮氧化物污染,如反应:

 =
= 。
。①已知该反应在不同条件下的化学反应速率如下:
a.v(CO)=1.5 mol·L-1·min-1 b.v(NO)=0.03 mol·L-1·s-1
c.v(N2)=0.6 mol·L-1·min-1 d.v(CO2)=1.6 mol·L-1·min-1
上述4种情况反应速率最快的是
②实验测得反应2CO(g)+2NO(g)
 2CO2(g)+N2 (g)
2CO2(g)+N2 (g)  =
= ,v正=k正•c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。在一定温度下达到平衡时v正 = v逆,则
,v正=k正•c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。在一定温度下达到平衡时v正 = v逆,则
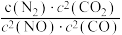 ,达到平衡后,仅升高温度,平衡向
,达到平衡后,仅升高温度,平衡向(3)已知:

 。将1mol CO和
。将1mol CO和 充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
①

②由图可知,T3前反应中CO的转化率随温度升高而增大,原因是
③已知c点时容器内的压强为p,在
 温度下该反应的压强平衡常数
温度下该反应的压强平衡常数 为
为 为以分压表示的平衡常数,分压=总压×物质的量分数)
为以分压表示的平衡常数,分压=总压×物质的量分数)
您最近一年使用:0次
6 . 科学家越来越重视氮的氧化物对环境带来的污染问题。氮元素的各种价态与物质类别的对应关系如图所示。
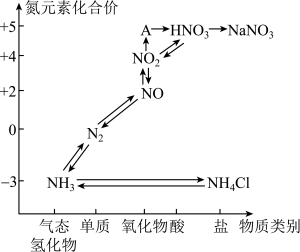
(1)A的化学式为___________ ,图中的物质属于离子化合物的是___________ (填化学式)。
(2)工业上用 经过一系列反应制取硝酸。这一转化过程的第一步反应的化学方程式为
经过一系列反应制取硝酸。这一转化过程的第一步反应的化学方程式为___________ 。
(3)铵态氮肥在存储和使用时,不能与熟石灰、草木灰(主要成分为 )等碱性物质混合,其主要原因是___________(填字母)。
)等碱性物质混合,其主要原因是___________(填字母)。
(4)一定条件下,在恒容密闭容器中发生可逆反应 。下列情况能说明该反应一定达到化学平衡的是
。下列情况能说明该反应一定达到化学平衡的是___________ (填序号)。
①
②
③体系的压强不再发生变化
④混合气体的密度不变⑤3 mol H-H键断裂的同时有2 mol N-H键也断裂
(5)汽车尾气中含有CO、 有毒气体,在催化剂作用下,它们可以相互反应生成两种无毒气体,该反应的化学方程式为
有毒气体,在催化剂作用下,它们可以相互反应生成两种无毒气体,该反应的化学方程式为___________ 。
(6)活性炭也可对汽车尾气进行处理,原理为 。一定条件下,在容积为1L的密闭容器中进行该反应,起始时充入0.4 mol
。一定条件下,在容积为1L的密闭容器中进行该反应,起始时充入0.4 mol  和0.6 mol
和0.6 mol  ,10 s后反应达到平衡状态,测得NO的物质的量为0.2 mol。该条件下,0~10 s内平均反应速率
,10 s后反应达到平衡状态,测得NO的物质的量为0.2 mol。该条件下,0~10 s内平均反应速率
___________ ; 的平衡转化率为
的平衡转化率为___________ 。

(1)A的化学式为
(2)工业上用
 经过一系列反应制取硝酸。这一转化过程的第一步反应的化学方程式为
经过一系列反应制取硝酸。这一转化过程的第一步反应的化学方程式为(3)铵态氮肥在存储和使用时,不能与熟石灰、草木灰(主要成分为
 )等碱性物质混合,其主要原因是___________(填字母)。
)等碱性物质混合,其主要原因是___________(填字母)。| A.混合后生成不溶性物质,降低肥效 | B.混合后增加土壤碱性 |
| C.混合后会放出氨气,降低肥效 | D.混合后会造成钾元素的损失,降低肥效 |
 。下列情况能说明该反应一定达到化学平衡的是
。下列情况能说明该反应一定达到化学平衡的是①

②

③体系的压强不再发生变化
④混合气体的密度不变⑤3 mol H-H键断裂的同时有2 mol N-H键也断裂
(5)汽车尾气中含有CO、
 有毒气体,在催化剂作用下,它们可以相互反应生成两种无毒气体,该反应的化学方程式为
有毒气体,在催化剂作用下,它们可以相互反应生成两种无毒气体,该反应的化学方程式为(6)活性炭也可对汽车尾气进行处理,原理为
 。一定条件下,在容积为1L的密闭容器中进行该反应,起始时充入0.4 mol
。一定条件下,在容积为1L的密闭容器中进行该反应,起始时充入0.4 mol  和0.6 mol
和0.6 mol  ,10 s后反应达到平衡状态,测得NO的物质的量为0.2 mol。该条件下,0~10 s内平均反应速率
,10 s后反应达到平衡状态,测得NO的物质的量为0.2 mol。该条件下,0~10 s内平均反应速率
 的平衡转化率为
的平衡转化率为
您最近一年使用:0次
7 . 目前世界各国都规划了碳达峰、碳中和的时间节点,以CO2为碳源,将其转化为能源物质。选择性加氢合成CH3OH,合成过程中发生下列反应:
反应i:CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H1=-akJ‧mol-1
反应ii:CO(g)+2H2(g)⇌CH3OH(g) ∆H2
反应iii:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H3=-bkJ‧mol-1
回答下列问题:
(1)根据盖斯定律,∆H2=。___________ kJ‧mol-1(用含a,b的代数式表示)。
(2)在一绝热、刚性容器中,只发生反应iii。下列说法表明反应已达到平衡状态的是___________(填序号)。
(3)中科院兰州化物所用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,反应过程如图所示。催化剂中添加助剂Na、K、Cu(也起催化作用)后可改变反应的选择性。

在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表所示:
欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加Na助剂是否效果最好?_________ (填“是”或“否”),请叙述原因:___________ 。
(4)合成二甲醚反应:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ∆H=-74kJ‧mol-1。该反应正反应的活化能___________ (填“>”“<”或“=”) 逆反应的活化能。
(5)在一定条件下,将1molCO和2molH2充入IL恒容密闭容器中:发生反应:CO(g)+2H2(g)⇌CH3OH(g) ∆H2,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:
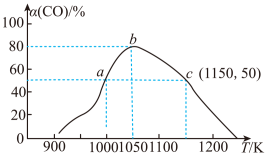
①温度为1000K时,反应开始至2min时,v(H2)=___________ mol‧L-1‧min-1
②CO的转化率随温度的升高先增大后变小的原因是___________ 。
(6)为实现CO2资源化利用,通过光电转化原理以CO2为原料制备甲酸产品(如图所示)。
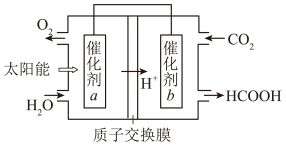
①光电转化过程中,阴极反应式为___________
②催化剂b附近生成lmolHCOOH时,标准状况下催化剂a附近理论上产生______ L气体。
反应i:CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H1=-akJ‧mol-1
反应ii:CO(g)+2H2(g)⇌CH3OH(g) ∆H2
反应iii:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H3=-bkJ‧mol-1
回答下列问题:
(1)根据盖斯定律,∆H2=。
(2)在一绝热、刚性容器中,只发生反应iii。下列说法表明反应已达到平衡状态的是___________(填序号)。
| A.混合气体的总物质的量不再变化 | B.n(CH3OH):n(H2O)=1:1 |
| C.v正(CH3OH)=3v逆(H2) | D.该反应的K不再变化 |

在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表所示:
| 助剂 | CO2转化率(%) | 各产物在所有产物中的占比 | ||
| C2H4 | C3H6 | 其他 | ||
| Na | 42.5 | 35.9 | 39.6 | 24.5 |
| K | 27.2 | 75.6 | 22.8 | 1.6 |
| Cu | 9.8 | 80.7 | 12.5 | 6.8 |
(4)合成二甲醚反应:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ∆H=-74kJ‧mol-1。该反应正反应的活化能
(5)在一定条件下,将1molCO和2molH2充入IL恒容密闭容器中:发生反应:CO(g)+2H2(g)⇌CH3OH(g) ∆H2,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:

①温度为1000K时,反应开始至2min时,v(H2)=
②CO的转化率随温度的升高先增大后变小的原因是
(6)为实现CO2资源化利用,通过光电转化原理以CO2为原料制备甲酸产品(如图所示)。

①光电转化过程中,阴极反应式为
②催化剂b附近生成lmolHCOOH时,标准状况下催化剂a附近理论上产生
您最近一年使用:0次
8 . “绿水青山就是金山银山”,在人们高度重视环境和保护环境的今天,处理和利用氮氧化物、碳氧化物、硫氧化物对改善大气质量具有重要的意义
(1)氮氧化物是造成光化学污染的罪魁祸首,用一氧化碳还原氮氧化物可防止氮氧化物污染,如反应2CO(g)+2NO(g)=2CO2(g)+N2(g) △H=-747 kJ/mol。
已知:ⅰ.2C(s)+O2(g)=2CO(g) △H=-221 kJ/mol
ⅱ.N2(g)+O2(g)=2NO(g) △H=+181 kJ/mol
则表示C(s)燃烧热的热化学方程式为___________ 。
(2)向某恒容绝热密闭容器中充入2 mol SO2和1 mol O2,发生反应:2SO2(g)+O2(g) 2SO3(g) △H,下列说法中能够判断该反应处于平衡状态的有
2SO3(g) △H,下列说法中能够判断该反应处于平衡状态的有___________ (填标号)。
A.SO2(g)与SO3(g)的物质的量之比恒定不变
B.SO2(g)与O2(g)的物质的量之比恒定不变
C.容器中温度恒定不变
D.混合物中S元素的质量分数恒定不变
(3)已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H。将1 mol CO2和3 mol H2充入1 L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO2的转化率与温度的对应关系如图所示:
CH3OH(g)+H2O(g) △H。将1 mol CO2和3 mol H2充入1 L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO2的转化率与温度的对应关系如图所示:
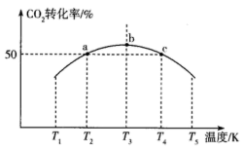
①△H___________ 0(填“>”或“<”)。
②能否根据a点CO2的转化率求出反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)在T2K下的平衡常数?
CH3OH(g)+H2O(g)在T2K下的平衡常数?___________ (填“能”或“不能”),理由是___________ 。
③已知c点时容器内的气体压强为p,在T4K下该反应的平衡常数Kp为___________ (用含p的代数式表示,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
(1)氮氧化物是造成光化学污染的罪魁祸首,用一氧化碳还原氮氧化物可防止氮氧化物污染,如反应2CO(g)+2NO(g)=2CO2(g)+N2(g) △H=-747 kJ/mol。
已知:ⅰ.2C(s)+O2(g)=2CO(g) △H=-221 kJ/mol
ⅱ.N2(g)+O2(g)=2NO(g) △H=+181 kJ/mol
则表示C(s)燃烧热的热化学方程式为
(2)向某恒容绝热密闭容器中充入2 mol SO2和1 mol O2,发生反应:2SO2(g)+O2(g)
 2SO3(g) △H,下列说法中能够判断该反应处于平衡状态的有
2SO3(g) △H,下列说法中能够判断该反应处于平衡状态的有A.SO2(g)与SO3(g)的物质的量之比恒定不变
B.SO2(g)与O2(g)的物质的量之比恒定不变
C.容器中温度恒定不变
D.混合物中S元素的质量分数恒定不变
(3)已知:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H。将1 mol CO2和3 mol H2充入1 L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO2的转化率与温度的对应关系如图所示:
CH3OH(g)+H2O(g) △H。将1 mol CO2和3 mol H2充入1 L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO2的转化率与温度的对应关系如图所示:
①△H
②能否根据a点CO2的转化率求出反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)在T2K下的平衡常数?
CH3OH(g)+H2O(g)在T2K下的平衡常数?③已知c点时容器内的气体压强为p,在T4K下该反应的平衡常数Kp为
您最近一年使用:0次
解题方法
9 . 合成氨是人类科学技术发展史上的一项重大突破,目前工业上用氢气和氮气直接合成氨。
(1)固氮一直是科学家致力研究的重要课题,有关热力学数据如下:
常温下,大气固氮的倾向______ 工业固氮(填“大于”或“小于”)。
(2)N2(g)与H2(g)反应的能量变化如图所示。
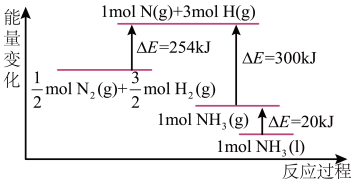
则N2(g)与H2(g)制备NH3(l)的热化学方程式为__________________ 。
(3)T ℃时,在 2 L恒容密闭容器中加入 1.2 mol N2和2 mol H2模拟一定条件下工业固氮[N2(g)+3H2(g)⇌2NH3(g)],体系中n(NH3)随时间的变化如图。
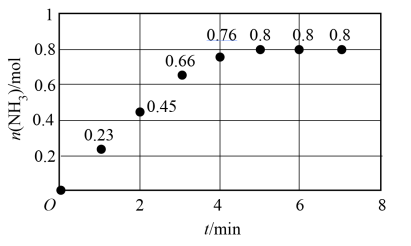
①前2分钟内的平均反应速率v(NH3)=______ mol·L-1·min-1。
②下列情况能说明该反应已达到平衡状态的是______ (选填序号)。
A.混合气体的密度不变
B.单位时间内断裂n mol N—H键的同时形成n mol H—H键
C.容器内的总压强不再变化
D.3v 正(H2)=2v 逆(NH3)
③有关工业固氮的说法正确的是______ (选填序号)。
A.使用催化剂可提高反应物的转化率
B.循环使用N2、H2可提高NH3的产率
C.温度控制在500℃左右有利于反应向正方向进行
D.增大压强有利于加快反应速率,所以压强越大越好
④T ℃时,该反应的平衡常数为______ 。
(4)研究表明某些过渡金属催化剂可以加速氨气的分解,某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解的初始速率(单位:mmol·min-1)与催化剂的对应关系如表所示。
在不同催化剂的催化作用下,氨气分解反应中的活化能最大的催化剂是______ (填化学式)。
(1)固氮一直是科学家致力研究的重要课题,有关热力学数据如下:
| 反应 | 大气固氮N2(g)+O2(g)⇌2NO(g) | 工业固氮N2(g)+3H2(g)⇌2NH3(g) | ||||
| 温度/℃ | 25 | 2000 | 25 | 350 | 400 | 450 |
| 平衡常数(K) | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.504 | 0.152 |
(2)N2(g)与H2(g)反应的能量变化如图所示。

则N2(g)与H2(g)制备NH3(l)的热化学方程式为
(3)T ℃时,在 2 L恒容密闭容器中加入 1.2 mol N2和2 mol H2模拟一定条件下工业固氮[N2(g)+3H2(g)⇌2NH3(g)],体系中n(NH3)随时间的变化如图。

①前2分钟内的平均反应速率v(NH3)=
②下列情况能说明该反应已达到平衡状态的是
A.混合气体的密度不变
B.单位时间内断裂n mol N—H键的同时形成n mol H—H键
C.容器内的总压强不再变化
D.3v 正(H2)=2v 逆(NH3)
③有关工业固氮的说法正确的是
A.使用催化剂可提高反应物的转化率
B.循环使用N2、H2可提高NH3的产率
C.温度控制在500℃左右有利于反应向正方向进行
D.增大压强有利于加快反应速率,所以压强越大越好
④T ℃时,该反应的平衡常数为
(4)研究表明某些过渡金属催化剂可以加速氨气的分解,某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解的初始速率(单位:mmol·min-1)与催化剂的对应关系如表所示。
| 催化剂 | Fe | Pd | Ru | Rh | Pt | Ni |
| 初始速率 | 0.5 | 1.8 | 7.9 | 4.0 | 2.2 | 3.0 |
您最近一年使用:0次
2020-09-28更新
|
173次组卷
|
2卷引用:福建省泉州市2021届高三质量监测(一) 化学试题
10 . 某铬盐厂净化含Cr(Ⅵ)废水并提取Cr2O3的一种工艺流程如图所示。

已知:Ksp[Cr(OH)3]=6.3×10-31
Ksp[Fe(OH)3]=2.6×10-39
Ksp[Fe(OH)2]=4.9×10-17
(1)步骤Ⅰ中,发生的反应为2H++2CrO42- Cr2O72-+H2O,B中含铬元素的离子有
Cr2O72-+H2O,B中含铬元素的离子有___ (填离子符号)。
(2)当清液中Cr3+的浓度≤1.5mg·L-1时,可认为已达铬的排放标准。若测得清液的pH=5,则清液尚不符合铬的排放标准,因为此时Cr3+的浓度=__ mg·L-1。
(3)步骤Ⅱ还可用其他物质代替NaHSO3作还原剂。
①若用FeSO4·7H2O作还原剂,步骤Ⅲ中参加反应的阳离子一定有__ (填离子符号)。
②若用铁屑作还原剂,当铁的投放量相同时,经计算,C溶液的pH与c(Cr2O72-)的对应关系如下表所示:
有人认为pH=6时,c(Cr2O72-)变小的原因是Cr2O72-基本上都已转化为Cr3+。这种说法是否正确,为什么?___ 。
③用铁屑作还原剂时,为使所得产品中含铁元素杂质的含量尽可能低,需要控制的条件有___ 。

已知:Ksp[Cr(OH)3]=6.3×10-31
Ksp[Fe(OH)3]=2.6×10-39
Ksp[Fe(OH)2]=4.9×10-17
(1)步骤Ⅰ中,发生的反应为2H++2CrO42-
 Cr2O72-+H2O,B中含铬元素的离子有
Cr2O72-+H2O,B中含铬元素的离子有(2)当清液中Cr3+的浓度≤1.5mg·L-1时,可认为已达铬的排放标准。若测得清液的pH=5,则清液尚不符合铬的排放标准,因为此时Cr3+的浓度=
(3)步骤Ⅱ还可用其他物质代替NaHSO3作还原剂。
①若用FeSO4·7H2O作还原剂,步骤Ⅲ中参加反应的阳离子一定有
②若用铁屑作还原剂,当铁的投放量相同时,经计算,C溶液的pH与c(Cr2O72-)的对应关系如下表所示:
| pH | 3 | 4 | 5 | 6 |
| c(Cr2O72-)/mol·L-1 | 7.02×10-21 | 7.02×10-7 | 1.25×10-3 | 2.21×10-34 |
有人认为pH=6时,c(Cr2O72-)变小的原因是Cr2O72-基本上都已转化为Cr3+。这种说法是否正确,为什么?
③用铁屑作还原剂时,为使所得产品中含铁元素杂质的含量尽可能低,需要控制的条件有
您最近一年使用:0次



