1 . 科学家越来越重视氮的氧化物对环境带来的污染问题。氮元素的各种价态与物质类别的对应关系如图所示。
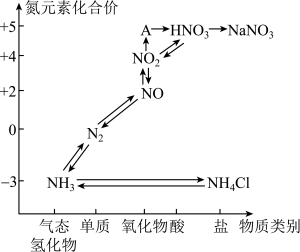
(1)A的化学式为___________ ,图中的物质属于离子化合物的是___________ (填化学式)。
(2)工业上用 经过一系列反应制取硝酸。这一转化过程的第一步反应的化学方程式为
经过一系列反应制取硝酸。这一转化过程的第一步反应的化学方程式为___________ 。
(3)铵态氮肥在存储和使用时,不能与熟石灰、草木灰(主要成分为 )等碱性物质混合,其主要原因是___________(填字母)。
)等碱性物质混合,其主要原因是___________(填字母)。
(4)一定条件下,在恒容密闭容器中发生可逆反应 。下列情况能说明该反应一定达到化学平衡的是
。下列情况能说明该反应一定达到化学平衡的是___________ (填序号)。
①
②
③体系的压强不再发生变化
④混合气体的密度不变⑤3 mol H-H键断裂的同时有2 mol N-H键也断裂
(5)汽车尾气中含有CO、 有毒气体,在催化剂作用下,它们可以相互反应生成两种无毒气体,该反应的化学方程式为
有毒气体,在催化剂作用下,它们可以相互反应生成两种无毒气体,该反应的化学方程式为___________ 。
(6)活性炭也可对汽车尾气进行处理,原理为 。一定条件下,在容积为1L的密闭容器中进行该反应,起始时充入0.4 mol
。一定条件下,在容积为1L的密闭容器中进行该反应,起始时充入0.4 mol  和0.6 mol
和0.6 mol  ,10 s后反应达到平衡状态,测得NO的物质的量为0.2 mol。该条件下,0~10 s内平均反应速率
,10 s后反应达到平衡状态,测得NO的物质的量为0.2 mol。该条件下,0~10 s内平均反应速率
___________ ; 的平衡转化率为
的平衡转化率为___________ 。

(1)A的化学式为
(2)工业上用
 经过一系列反应制取硝酸。这一转化过程的第一步反应的化学方程式为
经过一系列反应制取硝酸。这一转化过程的第一步反应的化学方程式为(3)铵态氮肥在存储和使用时,不能与熟石灰、草木灰(主要成分为
 )等碱性物质混合,其主要原因是___________(填字母)。
)等碱性物质混合,其主要原因是___________(填字母)。| A.混合后生成不溶性物质,降低肥效 | B.混合后增加土壤碱性 |
| C.混合后会放出氨气,降低肥效 | D.混合后会造成钾元素的损失,降低肥效 |
 。下列情况能说明该反应一定达到化学平衡的是
。下列情况能说明该反应一定达到化学平衡的是①

②

③体系的压强不再发生变化
④混合气体的密度不变⑤3 mol H-H键断裂的同时有2 mol N-H键也断裂
(5)汽车尾气中含有CO、
 有毒气体,在催化剂作用下,它们可以相互反应生成两种无毒气体,该反应的化学方程式为
有毒气体,在催化剂作用下,它们可以相互反应生成两种无毒气体,该反应的化学方程式为(6)活性炭也可对汽车尾气进行处理,原理为
 。一定条件下,在容积为1L的密闭容器中进行该反应,起始时充入0.4 mol
。一定条件下,在容积为1L的密闭容器中进行该反应,起始时充入0.4 mol  和0.6 mol
和0.6 mol  ,10 s后反应达到平衡状态,测得NO的物质的量为0.2 mol。该条件下,0~10 s内平均反应速率
,10 s后反应达到平衡状态,测得NO的物质的量为0.2 mol。该条件下,0~10 s内平均反应速率
 的平衡转化率为
的平衡转化率为
您最近一年使用:0次
名校
解题方法
2 . 在人们高度重视环境和保护环境的今天,消除和利用硫氧化物、氮氧化物、碳氧化物对改善大气质量具有重要的意义。
(1)在绝热的某刚性容器中置入 和
和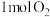 ,发生反应:
,发生反应:
 。下列说法中能够判断该反应一定处于平衡状态的有
。下列说法中能够判断该反应一定处于平衡状态的有___________ (填数字序号)。
①容器中 、
、 、
、 共存 ②单位时间内生成
共存 ②单位时间内生成 的同时消耗
的同时消耗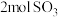
③反应容器中压强不随时间变化 ④容器中温度恒定不变
⑤容器中 、
、 、
、 的物质的量之比为2∶1∶2
的物质的量之比为2∶1∶2
(2)氮氧化物是造成光化学污染的罪魁祸首,用一氧化碳还原氮氧化物,可防止氮氧化物污染,如反应:
 =
= 。
。
①已知该反应在不同条件下的化学反应速率如下:
a.v(CO)=1.5 mol·L-1·min-1 b.v(NO)=0.03 mol·L-1·s-1
c.v(N2)=0.6 mol·L-1·min-1 d.v(CO2)=1.6 mol·L-1·min-1
上述4种情况反应速率最快的是___________ (填字母)。
②实验测得反应2CO(g)+2NO(g) 2CO2(g)+N2 (g)
2CO2(g)+N2 (g)  =
= ,v正=k正•c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。在一定温度下达到平衡时v正 = v逆,则
,v正=k正•c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。在一定温度下达到平衡时v正 = v逆,则
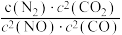 ,达到平衡后,仅升高温度,平衡向
,达到平衡后,仅升高温度,平衡向___________ 移动(填“正反应方向”“逆反应方向”或“不”)。k正增大的倍数___________ (填“>”、“<”或“=”)k逆增大的倍数。
(3)已知:
 。将1mol CO和
。将1mol CO和 充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
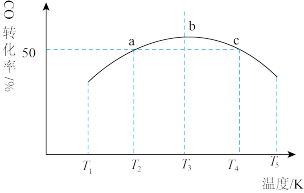
①
___________ 0(填“>”或“<”)。
②由图可知,T3前反应中CO的转化率随温度升高而增大,原因是___________ 。
③已知c点时容器内的压强为p,在 温度下该反应的压强平衡常数
温度下该反应的压强平衡常数 为
为___________ (用含p的关系式表示)。( 为以分压表示的平衡常数,分压=总压×物质的量分数)
为以分压表示的平衡常数,分压=总压×物质的量分数)
(1)在绝热的某刚性容器中置入
 和
和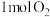 ,发生反应:
,发生反应:
 。下列说法中能够判断该反应一定处于平衡状态的有
。下列说法中能够判断该反应一定处于平衡状态的有①容器中
 、
、 、
、 共存 ②单位时间内生成
共存 ②单位时间内生成 的同时消耗
的同时消耗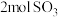
③反应容器中压强不随时间变化 ④容器中温度恒定不变
⑤容器中
 、
、 、
、 的物质的量之比为2∶1∶2
的物质的量之比为2∶1∶2(2)氮氧化物是造成光化学污染的罪魁祸首,用一氧化碳还原氮氧化物,可防止氮氧化物污染,如反应:

 =
= 。
。①已知该反应在不同条件下的化学反应速率如下:
a.v(CO)=1.5 mol·L-1·min-1 b.v(NO)=0.03 mol·L-1·s-1
c.v(N2)=0.6 mol·L-1·min-1 d.v(CO2)=1.6 mol·L-1·min-1
上述4种情况反应速率最快的是
②实验测得反应2CO(g)+2NO(g)
 2CO2(g)+N2 (g)
2CO2(g)+N2 (g)  =
= ,v正=k正•c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。在一定温度下达到平衡时v正 = v逆,则
,v正=k正•c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。在一定温度下达到平衡时v正 = v逆,则
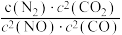 ,达到平衡后,仅升高温度,平衡向
,达到平衡后,仅升高温度,平衡向(3)已知:

 。将1mol CO和
。将1mol CO和 充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
①

②由图可知,T3前反应中CO的转化率随温度升高而增大,原因是
③已知c点时容器内的压强为p,在
 温度下该反应的压强平衡常数
温度下该反应的压强平衡常数 为
为 为以分压表示的平衡常数,分压=总压×物质的量分数)
为以分压表示的平衡常数,分压=总压×物质的量分数)
您最近一年使用:0次
解题方法
3 . 元素化合价和物质类别是认识物质的两个重要维度,如图是氮元素的“价一类二维图”。
(1)Y的化学式为___________ , 的用途有
的用途有___________ (任写一种)。
(2)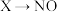 的化学方程式为
的化学方程式为___________ 。
(3)检验 中阳离子的实验操作和现象为
中阳离子的实验操作和现象为___________ 。
(4)向 浓度分别为
浓度分别为 和
和 的
的 和
和 的混合酸中加入过量的铜屑,待反应结束后,可产生标准状况下的
的混合酸中加入过量的铜屑,待反应结束后,可产生标准状况下的
___________  (反应中气体只生成
(反应中气体只生成 )。
)。
(5)汽车尾气中会产生大量的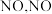 生成过程中的能量变化如图所示:
生成过程中的能量变化如图所示: 和
和 完全反应生成
完全反应生成 ,会
,会___________ (填“吸收”或“放出”)___________  能量。
能量。
②利用催化剂可将汽车尾气中的 和
和 转化为两种无毒气体,化学方程式为
转化为两种无毒气体,化学方程式为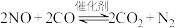 。向一恒容密闭容器中充入
。向一恒容密闭容器中充入 和
和 。下列可以表明上述反应已达到平衡状态的是
。下列可以表明上述反应已达到平衡状态的是___________ (填字母)。
A.容器中的气体压强保持不变
B. 的浓度不再改变
的浓度不再改变
C.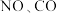 的浓度之比为
的浓度之比为
D.相同时间内,若反应消耗 同时生成
同时生成
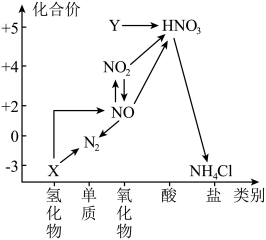
(1)Y的化学式为
 的用途有
的用途有(2)
 的化学方程式为
的化学方程式为(3)检验
 中阳离子的实验操作和现象为
中阳离子的实验操作和现象为(4)向
 浓度分别为
浓度分别为 和
和 的
的 和
和 的混合酸中加入过量的铜屑,待反应结束后,可产生标准状况下的
的混合酸中加入过量的铜屑,待反应结束后,可产生标准状况下的
 (反应中气体只生成
(反应中气体只生成 )。
)。(5)汽车尾气中会产生大量的
 生成过程中的能量变化如图所示:
生成过程中的能量变化如图所示: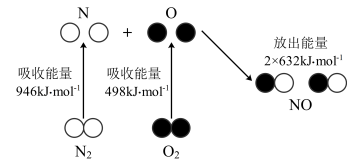
 和
和 完全反应生成
完全反应生成 ,会
,会 能量。
能量。②利用催化剂可将汽车尾气中的
 和
和 转化为两种无毒气体,化学方程式为
转化为两种无毒气体,化学方程式为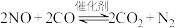 。向一恒容密闭容器中充入
。向一恒容密闭容器中充入 和
和 。下列可以表明上述反应已达到平衡状态的是
。下列可以表明上述反应已达到平衡状态的是A.容器中的气体压强保持不变
B.
 的浓度不再改变
的浓度不再改变C.
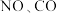 的浓度之比为
的浓度之比为
D.相同时间内,若反应消耗
 同时生成
同时生成
您最近一年使用:0次
名校
解题方法
4 . 氨和铵盐用途广泛。
(1)工业合成氨的反应是 N2+3H2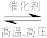 2NH3 。
2NH3 。
① 一定温度下,在某500mL的密闭容器中充入3mol H2 和 1 mol N2,3min后反应达平衡,H2的物质的量为0.75mol,求
a. H2的转化率,___________
b.平衡时NH3的体积分数___________ 。(写出计算过程)
② 对上述反应,下列说法不正确的是___________
A.正反应方向和逆反应方向均能进行的化学反应统称为可逆反应
B.当可逆反应的正反应速率和逆反应速率相等时,该反应达到化学平衡状态
C.化学反应的限度决定了反应物在该条件下的最大转化率
D.改变可逆反应的反应条件可以在一定程度上改变其化学平衡状态
(2)已知日常所用的干电池中,其电极分别为碳棒和锌皮,以糊状NH4Cl和ZnCl2作为电解质,电极反应可简化为2NH + 2e-=2NH3+H2 (还加入填充物MnO2,用于吸收H2生成水,NH3与Zn2+结合为稳定物质)。根据以上信息,日常所用的干电池的正极是
+ 2e-=2NH3+H2 (还加入填充物MnO2,用于吸收H2生成水,NH3与Zn2+结合为稳定物质)。根据以上信息,日常所用的干电池的正极是___________ ,负极是___________ 。当生成25.5克NH3时,转移___________ mol电子。
(1)工业合成氨的反应是 N2+3H2
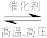 2NH3 。
2NH3 。① 一定温度下,在某500mL的密闭容器中充入3mol H2 和 1 mol N2,3min后反应达平衡,H2的物质的量为0.75mol,求
a. H2的转化率,
b.平衡时NH3的体积分数
② 对上述反应,下列说法不正确的是
A.正反应方向和逆反应方向均能进行的化学反应统称为可逆反应
B.当可逆反应的正反应速率和逆反应速率相等时,该反应达到化学平衡状态
C.化学反应的限度决定了反应物在该条件下的最大转化率
D.改变可逆反应的反应条件可以在一定程度上改变其化学平衡状态
(2)已知日常所用的干电池中,其电极分别为碳棒和锌皮,以糊状NH4Cl和ZnCl2作为电解质,电极反应可简化为2NH
 + 2e-=2NH3+H2 (还加入填充物MnO2,用于吸收H2生成水,NH3与Zn2+结合为稳定物质)。根据以上信息,日常所用的干电池的正极是
+ 2e-=2NH3+H2 (还加入填充物MnO2,用于吸收H2生成水,NH3与Zn2+结合为稳定物质)。根据以上信息,日常所用的干电池的正极是
您最近一年使用:0次
5 . 氢能是公认的清洁能源,作为低碳和零碳能源正在脱颖而出。我国已在氢能领域取得了多方面的进展,在不久的将来有望成为氢能技术和应用领先的国家之一,也被国际公认为最有可能率先实现氢燃料电池和氢能汽车产业化的国家。同时,氢气在现代工业上也有着广泛的用途。
(1)实验测得,1mol氢气燃烧生成水蒸气的能量变化如图:
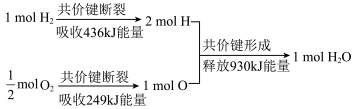
①从化学键的角度看,氢气和氧气分子比较,较稳定的是___________ ,该反应的生成物能量总和(填“大于”“小于”或“等于”)___________ 反应物能量总和。
②若2mol氢气完全燃烧生成水蒸气,放出的热量为___________ kJ。
(2)利用氢气还原 可实现碳循环,有利于“碳中和”目标的实现,在体积为1L的密闭容器中,充入1mol
可实现碳循环,有利于“碳中和”目标的实现,在体积为1L的密闭容器中,充入1mol 和3mol
和3mol ,一定条件下发生反应:
,一定条件下发生反应: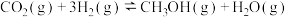 ,测得
,测得 和
和 的浓度随时间变化如图所示:
的浓度随时间变化如图所示:
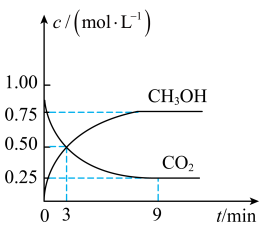
①用氢气表示该反应前3min的反应速率为___________  。
。
②有关该反应的下列说法正确的是___________ (填标号)。
A.混合气体的密度不随时间的变化而变化,则说明上述反应达到平衡状态
B.平衡时 的转化率为75%
的转化率为75%
C.平衡时混合气体中 (g)的体积分数是30%
(g)的体积分数是30%
D.该条件下,第9min时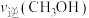 大于第3min时
大于第3min时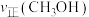
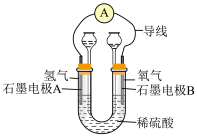
(3)如图为氢氧燃料电池的实验装置示意图,通入氧气的电极为___________ (填“正”或“负”)极,溶液中的氢离子移向石墨电极___________ (填“A”或“B”)极,反应一段时间后,稀硫酸的浓度变___________ (填“大”或“小”)。
(1)实验测得,1mol氢气燃烧生成水蒸气的能量变化如图:

①从化学键的角度看,氢气和氧气分子比较,较稳定的是
②若2mol氢气完全燃烧生成水蒸气,放出的热量为
(2)利用氢气还原
 可实现碳循环,有利于“碳中和”目标的实现,在体积为1L的密闭容器中,充入1mol
可实现碳循环,有利于“碳中和”目标的实现,在体积为1L的密闭容器中,充入1mol 和3mol
和3mol ,一定条件下发生反应:
,一定条件下发生反应: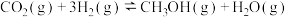 ,测得
,测得 和
和 的浓度随时间变化如图所示:
的浓度随时间变化如图所示:
①用氢气表示该反应前3min的反应速率为
 。
。②有关该反应的下列说法正确的是
A.混合气体的密度不随时间的变化而变化,则说明上述反应达到平衡状态
B.平衡时
 的转化率为75%
的转化率为75%C.平衡时混合气体中
 (g)的体积分数是30%
(g)的体积分数是30%D.该条件下,第9min时
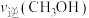 大于第3min时
大于第3min时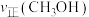
(3)如图为氢氧燃料电池的实验装置示意图,通入氧气的电极为

您最近一年使用:0次
名校
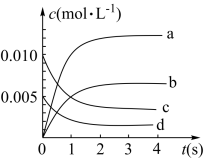
6 . 近年来甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样。现有实验室中模拟甲醇的合成反应,在2L密闭容器内,400℃时反应: ,体系中
,体系中 随时间的变化如表:
随时间的变化如表:
根据图表回答下列问题:
(1)图中表示 的变化的曲线是
的变化的曲线是___________ 。
(2)用 表示从0~2s内该反应的平均速率
表示从0~2s内该反应的平均速率
___________ 。
(3)能说明该反应已达到平衡状态的是___________ 。
a.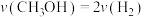 b.容器内压强保持不变
b.容器内压强保持不变
c.生成 的同时消耗
的同时消耗 d.容器内密度保持不变
d.容器内密度保持不变
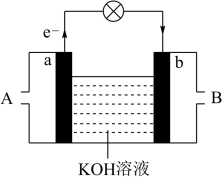
(4)已知 与
与 的反应可将化学能转化为电能,其工作原理如图所示,图中
的反应可将化学能转化为电能,其工作原理如图所示,图中 从
从___________ (填A或B)通入,a极的电极反应式是___________ 。
 ,体系中
,体系中 随时间的变化如表:
随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 5 |
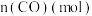 | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
(1)图中表示
 的变化的曲线是
的变化的曲线是
(2)用
 表示从0~2s内该反应的平均速率
表示从0~2s内该反应的平均速率
(3)能说明该反应已达到平衡状态的是
a.
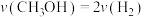 b.容器内压强保持不变
b.容器内压强保持不变c.生成
 的同时消耗
的同时消耗 d.容器内密度保持不变
d.容器内密度保持不变(4)已知
 与
与 的反应可将化学能转化为电能,其工作原理如图所示,图中
的反应可将化学能转化为电能,其工作原理如图所示,图中 从
从
您最近一年使用:0次
2023-05-03更新
|
501次组卷
|
2卷引用:福建省南平市浦城第一中学2022-2023学年高一下学期期中考试化学试题
7 . 回答下列问题:
(1)①若在一个容积为2 L的密闭容器中加入0.2 molN2的和0.6 molH2的,在一定条件下发生反应:N2+3H2 2NH3
2NH3  ,若在5分钟时反应达到平衡,此时测得2NH3的物质的量为0.2 mol。则平衡时H2的转化率为
,若在5分钟时反应达到平衡,此时测得2NH3的物质的量为0.2 mol。则平衡时H2的转化率为_______ 。
②平衡后,若要提高H2的转化率,可以采取的措施有_______ 。
A.加了催化剂 B.增大容器体积 C.降低反应体系的温度 D.加入一定量N2
③下列各项能作为判断该反应达到化学平衡状态的依据是_______ (填序号字母)。
A.容器内N2、H2、NH3的物质的量浓度之比为1∶3∶2 B.v(N2)正=3v(H2)逆
C.容器内压强保持不变 D.混合气体的密度保持不变
(2)化学反应的焓变通常用实验进行测定:实验测得,标准状况下11.2L甲烷在氧气中充分燃烧生成液态水和二氧化碳气体时释放出akJ的热量,试写出表示甲烷燃烧的热化学方程式:_______ 。
(3)砷(As)是第四周期VA族元素,可以形As2S3、As2O5、H3AsO3、H3AsO4成等化合物,有着广泛的用途。回答下列问题:
①画出砷的原子结构示意图_______ 。
②工业上常将含砷废渣(主要成分为As2S3)制成浆状,通O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式_______ 。该反应需要在加压下进行,原因是_______ 。
③已知:



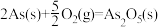

则反应的As2O5(s)+3H2O(l)=2H3AsO4(s)
_______ 。
(1)①若在一个容积为2 L的密闭容器中加入0.2 molN2的和0.6 molH2的,在一定条件下发生反应:N2+3H2
 2NH3
2NH3  ,若在5分钟时反应达到平衡,此时测得2NH3的物质的量为0.2 mol。则平衡时H2的转化率为
,若在5分钟时反应达到平衡,此时测得2NH3的物质的量为0.2 mol。则平衡时H2的转化率为②平衡后,若要提高H2的转化率,可以采取的措施有
A.加了催化剂 B.增大容器体积 C.降低反应体系的温度 D.加入一定量N2
③下列各项能作为判断该反应达到化学平衡状态的依据是
A.容器内N2、H2、NH3的物质的量浓度之比为1∶3∶2 B.v(N2)正=3v(H2)逆
C.容器内压强保持不变 D.混合气体的密度保持不变
(2)化学反应的焓变通常用实验进行测定:实验测得,标准状况下11.2L甲烷在氧气中充分燃烧生成液态水和二氧化碳气体时释放出akJ的热量,试写出表示甲烷燃烧的热化学方程式:
(3)砷(As)是第四周期VA族元素,可以形As2S3、As2O5、H3AsO3、H3AsO4成等化合物,有着广泛的用途。回答下列问题:
①画出砷的原子结构示意图
②工业上常将含砷废渣(主要成分为As2S3)制成浆状,通O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式
③已知:




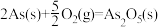

则反应的As2O5(s)+3H2O(l)=2H3AsO4(s)

您最近一年使用:0次
2022-12-12更新
|
79次组卷
|
2卷引用:四川省内江市威远中学校2022-2023学年高二上学期第二次月考(期中考试)化学试题
名校
8 . 金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途。目前生产钛的方法之一是先将TiO2转化为TiCl4,再进一步还原得到钛。以下是碳氯化法制备TiCl4:TiO2(s)+2Cl2(g)+2C(s)⇌TiCl4(g)+2CO(g) △H=-51kJ/mol(放热反应)。
(1)对于该反应:增大压强,平衡_______ 移动(填“正向”、“不”或“逆向”);温度升高,平衡转化率_______ (填“变大”、“变小”或“不变”)。
(2)恒温恒容时,下列叙述一定能说明该反应达到平衡状态的是_______。
(3)在200℃达到平衡时,TiO2几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因可能是________________________ 。
(4)在某温度下,该恒容体系已经达到平衡,若向其中加入少量炭,TiCl4的体积分数将__________ ;若加入少量氯气,TiCl4的体积分数将__________ 。
A.减少 B.不变 C.增大
(1)对于该反应:增大压强,平衡
(2)恒温恒容时,下列叙述一定能说明该反应达到平衡状态的是_______。
| A.混合气体的压强保持不变 | B.2v正(Cl2)=v逆(TiCl4) |
| C.混合气体的密度保持不变 | D.Cl2和CO物质的量相等 |
(4)在某温度下,该恒容体系已经达到平衡,若向其中加入少量炭,TiCl4的体积分数将
A.减少 B.不变 C.增大
您最近一年使用:0次
名校
9 . 甲醇 是一种重要的化工原料,在生产生活中有重要用途。现在2L的恒容密闭容器中充入
是一种重要的化工原料,在生产生活中有重要用途。现在2L的恒容密闭容器中充入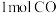 和
和 ,一定条件下发生反应:
,一定条件下发生反应: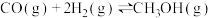 。测得CO和
。测得CO和 的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
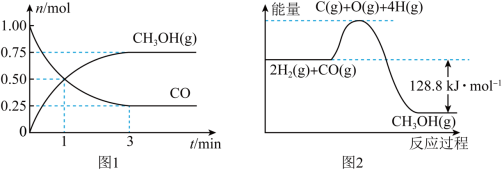
(1)从反应开始至达到平衡,以 表示的反应的平均反应速率
表示的反应的平均反应速率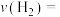
___________ ;下列措施能增大反应速率的是___________ 。
A.升高温度 B.降低压强 C.减小 的浓度 D.加入合适的催化剂
的浓度 D.加入合适的催化剂
(2)反应达到平衡状态时 的转化率为
的转化率为___________ 。
(3)在相同条件下,若向该密闭容器中充入 与
与 ,二者充分反应后,根据反应的特点推测,能够
,二者充分反应后,根据反应的特点推测,能够___________ (填放出或吸收)的热量___________ (填“>”“<”或“=”)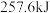 。
。
 是一种重要的化工原料,在生产生活中有重要用途。现在2L的恒容密闭容器中充入
是一种重要的化工原料,在生产生活中有重要用途。现在2L的恒容密闭容器中充入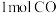 和
和 ,一定条件下发生反应:
,一定条件下发生反应: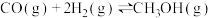 。测得CO和
。测得CO和 的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
(1)从反应开始至达到平衡,以
 表示的反应的平均反应速率
表示的反应的平均反应速率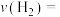
A.升高温度 B.降低压强 C.减小
 的浓度 D.加入合适的催化剂
的浓度 D.加入合适的催化剂(2)反应达到平衡状态时
 的转化率为
的转化率为(3)在相同条件下,若向该密闭容器中充入
 与
与 ,二者充分反应后,根据反应的特点推测,能够
,二者充分反应后,根据反应的特点推测,能够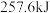 。
。
您最近一年使用:0次
2023-05-11更新
|
503次组卷
|
3卷引用:吉林省延边第二中学2022-2023学年高一下学期5月期中考试化学试题
名校
10 . 氨在化肥生产、贮氢及燃煤烟气脱硫脱硝等领域用途非常广泛。
(1)尿素[CO(NH2)2]与氰酸铵(NH4CNO)互为____ ;(选填:“同一物质”或“同系物”或“同分异构体”),氰酸铵属于____ 化合物(选填:“离子”或“共价”)。
(2)液氨是一种贮氢材料,已知:断开1mol共价键吸收的能量数据如表:
则合成氨反应:N2(g)+3H2(g) 2NH3(g),生成2mol氨气放出
2NH3(g),生成2mol氨气放出____ kJ热量,若1molN2与3molH2在一定条件下反应,达到平衡时放出36.32kJ热量,则此时NH3所占的体积分数为____ 。
(3)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g) 5N2(g)+6H2O(g)。能说明该反应已达到平衡状态的标志是
5N2(g)+6H2O(g)。能说明该反应已达到平衡状态的标志是____ (不定项选择)。
a.反应速率4v(NH3)=5v(N2)
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
(1)尿素[CO(NH2)2]与氰酸铵(NH4CNO)互为
(2)液氨是一种贮氢材料,已知:断开1mol共价键吸收的能量数据如表:
| 共价键 | H-H | N-H | N≡N |
| kJ·mol-1 | 436 | 390.8 | 946 |
 2NH3(g),生成2mol氨气放出
2NH3(g),生成2mol氨气放出(3)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)
 5N2(g)+6H2O(g)。能说明该反应已达到平衡状态的标志是
5N2(g)+6H2O(g)。能说明该反应已达到平衡状态的标志是a.反应速率4v(NH3)=5v(N2)
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
您最近一年使用:0次



