1 . “绿水青山就是金山银山”,在人们高度重视环境和保护环境的今天,处理和利用氮氧化物、碳氧化物、硫氧化物对改善大气质量具有重要的意义
(1)氮氧化物是造成光化学污染的罪魁祸首,用一氧化碳还原氮氧化物可防止氮氧化物污染,如反应2CO(g)+2NO(g)=2CO2(g)+N2(g) △H=-747 kJ/mol。
已知:ⅰ.2C(s)+O2(g)=2CO(g) △H=-221 kJ/mol
ⅱ.N2(g)+O2(g)=2NO(g) △H=+181 kJ/mol
则表示C(s)燃烧热的热化学方程式为___________ 。
(2)向某恒容绝热密闭容器中充入2 mol SO2和1 mol O2,发生反应:2SO2(g)+O2(g) 2SO3(g) △H,下列说法中能够判断该反应处于平衡状态的有
2SO3(g) △H,下列说法中能够判断该反应处于平衡状态的有___________ (填标号)。
A.SO2(g)与SO3(g)的物质的量之比恒定不变
B.SO2(g)与O2(g)的物质的量之比恒定不变
C.容器中温度恒定不变
D.混合物中S元素的质量分数恒定不变
(3)已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H。将1 mol CO2和3 mol H2充入1 L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO2的转化率与温度的对应关系如图所示:
CH3OH(g)+H2O(g) △H。将1 mol CO2和3 mol H2充入1 L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO2的转化率与温度的对应关系如图所示:
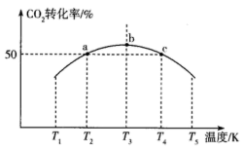
①△H___________ 0(填“>”或“<”)。
②能否根据a点CO2的转化率求出反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)在T2K下的平衡常数?
CH3OH(g)+H2O(g)在T2K下的平衡常数?___________ (填“能”或“不能”),理由是___________ 。
③已知c点时容器内的气体压强为p,在T4K下该反应的平衡常数Kp为___________ (用含p的代数式表示,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
(1)氮氧化物是造成光化学污染的罪魁祸首,用一氧化碳还原氮氧化物可防止氮氧化物污染,如反应2CO(g)+2NO(g)=2CO2(g)+N2(g) △H=-747 kJ/mol。
已知:ⅰ.2C(s)+O2(g)=2CO(g) △H=-221 kJ/mol
ⅱ.N2(g)+O2(g)=2NO(g) △H=+181 kJ/mol
则表示C(s)燃烧热的热化学方程式为
(2)向某恒容绝热密闭容器中充入2 mol SO2和1 mol O2,发生反应:2SO2(g)+O2(g)
 2SO3(g) △H,下列说法中能够判断该反应处于平衡状态的有
2SO3(g) △H,下列说法中能够判断该反应处于平衡状态的有A.SO2(g)与SO3(g)的物质的量之比恒定不变
B.SO2(g)与O2(g)的物质的量之比恒定不变
C.容器中温度恒定不变
D.混合物中S元素的质量分数恒定不变
(3)已知:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H。将1 mol CO2和3 mol H2充入1 L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO2的转化率与温度的对应关系如图所示:
CH3OH(g)+H2O(g) △H。将1 mol CO2和3 mol H2充入1 L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO2的转化率与温度的对应关系如图所示:
①△H
②能否根据a点CO2的转化率求出反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)在T2K下的平衡常数?
CH3OH(g)+H2O(g)在T2K下的平衡常数?③已知c点时容器内的气体压强为p,在T4K下该反应的平衡常数Kp为
您最近一年使用:0次
名校
2 . 二甲醚(DME)作为一种新兴的基本有机化工原料,在制药、燃料、农药等化学工业中有许多用途,还是未来制取低碳烯烃的主要原料之一、回答下列问题。
(1)已知: 的燃烧热
的燃烧热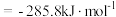 ,CO(g)的燃烧热
,CO(g)的燃烧热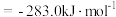 ,二甲醚
,二甲醚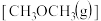 的燃烧热
的燃烧热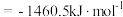 ,H2O(g)=H2O(l) △H=-44.0kJmol-1。则
,H2O(g)=H2O(l) △H=-44.0kJmol-1。则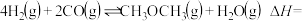
___________  。
。
(2)恒温恒容条件下,能说明 达到平衡的标志是___________(填序号)。
达到平衡的标志是___________(填序号)。
(3)在T℃时,向容积为1L的恒容容器中充入物质的量之和为3mol的 和CO且
和CO且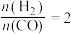 ,发生反应
,发生反应 ,达到平衡时
,达到平衡时 的体积分数对应图甲中a点。
的体积分数对应图甲中a点。
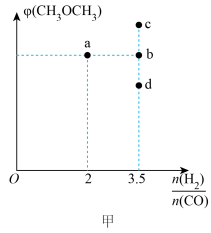
当起始 =3.5时,反应达到平衡状态后,CH3OCH3的体积分数可能对应图甲中的
=3.5时,反应达到平衡状态后,CH3OCH3的体积分数可能对应图甲中的___________ (填“b”“c”或“d”)点。
(4)某温度下,将2.0molCO(g)和4.0molH2(g)充入容积为2L的密闭容器中,反应达到平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图乙所示,关于温度和压强的关系判断正确的是___________(填序号)。

(5)在恒温恒压(p)条件下,密闭容器中充入2.0molCO(g)和4.0molH2(g)发生应4H2(g)+2CO(g)⇌CH3OCH3(g)+H2O(g),平衡时H2的转化率为50%。达到平衡时,p(H2)=_________ ;平衡常数Kp=_________ (以分压表示,分压=总压×物质的量分数)。
(1)已知:
 的燃烧热
的燃烧热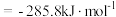 ,CO(g)的燃烧热
,CO(g)的燃烧热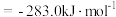 ,二甲醚
,二甲醚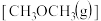 的燃烧热
的燃烧热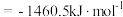 ,H2O(g)=H2O(l) △H=-44.0kJmol-1。则
,H2O(g)=H2O(l) △H=-44.0kJmol-1。则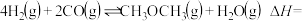
 。
。(2)恒温恒容条件下,能说明
 达到平衡的标志是___________(填序号)。
达到平衡的标志是___________(填序号)。| A.H2、CO、CH3OCH3、H2O的反应速率之比为4:2:1:1 |
| B.H2、CO、CH3OCH3、H2O的物质的量之比为4:2:1:1 |
| C.混合气体的平均摩尔质量保持不变 |
| D.容器中气体的密度保持不变 |
(3)在T℃时,向容积为1L的恒容容器中充入物质的量之和为3mol的
 和CO且
和CO且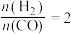 ,发生反应
,发生反应 ,达到平衡时
,达到平衡时 的体积分数对应图甲中a点。
的体积分数对应图甲中a点。
当起始
 =3.5时,反应达到平衡状态后,CH3OCH3的体积分数可能对应图甲中的
=3.5时,反应达到平衡状态后,CH3OCH3的体积分数可能对应图甲中的(4)某温度下,将2.0molCO(g)和4.0molH2(g)充入容积为2L的密闭容器中,反应达到平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图乙所示,关于温度和压强的关系判断正确的是___________(填序号)。

A.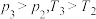 | B.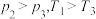 |
C.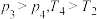 | D.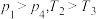 |
(5)在恒温恒压(p)条件下,密闭容器中充入2.0molCO(g)和4.0molH2(g)发生应4H2(g)+2CO(g)⇌CH3OCH3(g)+H2O(g),平衡时H2的转化率为50%。达到平衡时,p(H2)=
您最近一年使用:0次
23-24高二·全国·假期作业
名校
解题方法
3 . 合成气(主要成分为CO、H2及少量CO、H2O)在工业上有广泛用途。合成甲醇的主要反应为:CO(g)+2H2(g) CH3OH(g) ΔH<0。将CO与H2混合气体充入密闭容器中,投料比
CH3OH(g) ΔH<0。将CO与H2混合气体充入密闭容器中,投料比 =
= ,测得平衡时混合气体中CH3OH的物质的量分数[φ(CH3OHK)]与温度(T)、压强(p)之间的关系如图所示。
,测得平衡时混合气体中CH3OH的物质的量分数[φ(CH3OHK)]与温度(T)、压强(p)之间的关系如图所示。
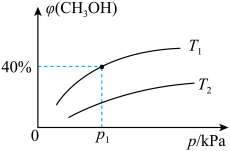
(1)T1、p1时,CO的转化率为_______ (保留3位有效数字)﹔压强平衡常数Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,用含p1的代数式表示)。在该条件下,若CO、H2、CH3OH气体的起始物质的量之比为2∶1∶2,则反应开始时v(CO)正______ v(CO)逆。
(2)恒温恒容条件下,下列叙述不能说明反应达到化学平衡状态的是_______ 。
 CH3OH(g) ΔH<0。将CO与H2混合气体充入密闭容器中,投料比
CH3OH(g) ΔH<0。将CO与H2混合气体充入密闭容器中,投料比 =
= ,测得平衡时混合气体中CH3OH的物质的量分数[φ(CH3OHK)]与温度(T)、压强(p)之间的关系如图所示。
,测得平衡时混合气体中CH3OH的物质的量分数[φ(CH3OHK)]与温度(T)、压强(p)之间的关系如图所示。
(1)T1、p1时,CO的转化率为
(2)恒温恒容条件下,下列叙述不能说明反应达到化学平衡状态的是
| A.CO、H2的物质的量浓度不再随时间的变化而变化 |
| B.混合气体的平均摩尔质量不再随时间的变化而变化 |
| C.混合气体的密度不再随时间的变化而变化 |
| D.若将容器改为绝热恒容容器时,平衡常数K不随时间变化而变化 |
您最近一年使用:0次
名校
4 . 磁选后的炼铁高钛炉渣,主要成分有 、
、 、
、 、MgO、CaO以及少量的
、MgO、CaO以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。

该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表:
回答下列问题:
Ⅰ.
(1)提高“酸溶”速率的措施有______ (任写一点即可)。
(2)“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,依次析出的金属离子是______ 。
(3)“水解”操作中, 转化为
转化为 的离子方程式是
的离子方程式是______ 。分析化学上,测定 酸性溶液中钛元素的含量通常涉及两步反应:①用Al粉还原
酸性溶液中钛元素的含量通常涉及两步反应:①用Al粉还原 得到
得到 ;②用
;②用 溶液滴定,
溶液滴定,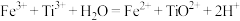 。反应②的滴定实验可选用
。反应②的滴定实验可选用______ (填化学式)溶液作指示剂。
Ⅱ.金属钛(Ti)在工业领域有着重要用途。目前生产钛的方法之一是先将转化为 ,再进一步还原得到钛。工业上将转化为
,再进一步还原得到钛。工业上将转化为 的方法为:碳氯化法。600℃,
的方法为:碳氯化法。600℃,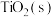 与
与 、
、 充分反应后,混合气体中各组分的分压如下表:
充分反应后,混合气体中各组分的分压如下表:
(4) 与C、
与C、 反应的化学方程式为
反应的化学方程式为______ 。
(5)平衡常数表达式
______ ;恒温恒容时,下列叙述一定能说明该反应达到平衡状态的是______ 。
A.混合气体的压强保持不变B.
C.混合气体的密度保持不变D. 和CO物质的量相等
和CO物质的量相等
(6)若反应容器的容积为2L,4min后测得固体的质量减少了47.2g,则 的平均反应速率为
的平均反应速率为______ 。
 、
、 、
、 、MgO、CaO以及少量的
、MgO、CaO以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表:
| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 2.2 | 3.5 | 9.5 | 12.4 |
沉淀完全( )的pH )的pH | 3.2 | 4.7 | 11.1 | 13.8 |
Ⅰ.
(1)提高“酸溶”速率的措施有
(2)“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,依次析出的金属离子是
(3)“水解”操作中,
 转化为
转化为 的离子方程式是
的离子方程式是 酸性溶液中钛元素的含量通常涉及两步反应:①用Al粉还原
酸性溶液中钛元素的含量通常涉及两步反应:①用Al粉还原 得到
得到 ;②用
;②用 溶液滴定,
溶液滴定,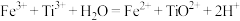 。反应②的滴定实验可选用
。反应②的滴定实验可选用Ⅱ.金属钛(Ti)在工业领域有着重要用途。目前生产钛的方法之一是先将转化为
 ,再进一步还原得到钛。工业上将转化为
,再进一步还原得到钛。工业上将转化为 的方法为:碳氯化法。600℃,
的方法为:碳氯化法。600℃,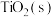 与
与 、
、 充分反应后,混合气体中各组分的分压如下表:
充分反应后,混合气体中各组分的分压如下表:| 物质 |  | CO |  |  |
| 分压(MPa) | 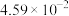 | 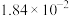 |  |  |
(4)
 与C、
与C、 反应的化学方程式为
反应的化学方程式为(5)平衡常数表达式

A.混合气体的压强保持不变B.

C.混合气体的密度保持不变D.
 和CO物质的量相等
和CO物质的量相等(6)若反应容器的容积为2L,4min后测得固体的质量减少了47.2g,则
 的平均反应速率为
的平均反应速率为
您最近一年使用:0次
2023-11-28更新
|
120次组卷
|
2卷引用:河南省洛阳市2023-2024学年高二上期期中考试化学试题
5 . B、Al、Ga等第ⅢA族元素,N、P、As等第VA族元素的单质及其化合物在生产、生活中有重要的用途。
(1)根据元素周期律的知识,下列说法不 正确的是_______ 。
①As与H2在低温时可剧烈化合为AsH3,AsH3电子式为: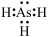
②酸性:HNO3>H3AsO4
③原子半径:N<As
④Al(OH)3为两性氢氧化物,既能溶于硝酸也能溶于氨水
(2)我国的“天宫”空间站的核心舱“天和”选择了高效柔性砷化镓(GaAs)薄膜太阳能电池来供电。镓元素在元素周期表中的位置是第四周期ⅢA族,镓的原子结构示意图为_______ 。
(3)把在空气中久置的铝片5.0g投入盛有50mL0.1mol·L-1盐酸的烧杯中,该铝片与盐酸反应,产生氢气的速率v(H2)与反应时间t的关系可用如图所示的坐标曲线来表示,下列推论错误的是_______ (填字母代号)。
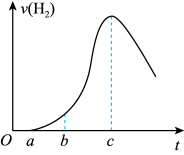
a.O→a不产生氢气是因为表面的氧化物隔离了铝和稀盐酸
b.b→c段产生氢气的速率增加较快的主要原因之一是温度升高
c.t=c时,反应处于平衡状态
d.t>c时,产生氢气的速率降低的主要原因是溶液中H+浓度下降
(4)雌黄(As2S3)和雄黄(As4S4)都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。在雌黄(As2S3)和雄黄(As4S4)中,S元素均为-2价,一定条件下,雌黄和雄黄的转化关系如图所示。
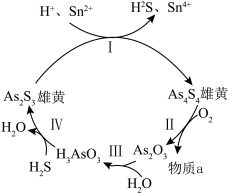
①以上转换关系中发生的Ⅰ、Ⅱ、Ⅲ、Ⅳ反应,属于氧化还原反应的是_______ 。(填字母)
②Ⅱ中若0.1molAs4S4反应转移2.8mole-,则消耗标况下O2的体积是_______ L,a物质是_______ 。
(5)砷酸钠(Na3AsO4)具有氧化性,298K时,在100mL烧杯中加入10mL0.1mol/LNa3AsO4溶液、20mL0.1mol/LKI溶液和20mL0.05mol/L硫酸溶液,发生下列反应:AsO (无色)+2I-+2H+⇌AsO
(无色)+2I-+2H+⇌AsO (无色)+I2(浅黄色)+H2O,测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。下列情况表明上述可逆反应达到平衡状态的是
(无色)+I2(浅黄色)+H2O,测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。下列情况表明上述可逆反应达到平衡状态的是_______ (填字母代号)。
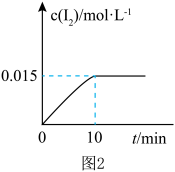
a.溶液pH保持不变 b.c(AsO )+c(AsO
)+c(AsO )不再变化
)不再变化
c.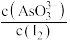 保持变化 d.c(I-)=0.07mol·L-1
保持变化 d.c(I-)=0.07mol·L-1
(1)根据元素周期律的知识,下列说法
①As与H2在低温时可剧烈化合为AsH3,AsH3电子式为:
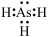
②酸性:HNO3>H3AsO4
③原子半径:N<As
④Al(OH)3为两性氢氧化物,既能溶于硝酸也能溶于氨水
(2)我国的“天宫”空间站的核心舱“天和”选择了高效柔性砷化镓(GaAs)薄膜太阳能电池来供电。镓元素在元素周期表中的位置是第四周期ⅢA族,镓的原子结构示意图为
(3)把在空气中久置的铝片5.0g投入盛有50mL0.1mol·L-1盐酸的烧杯中,该铝片与盐酸反应,产生氢气的速率v(H2)与反应时间t的关系可用如图所示的坐标曲线来表示,下列推论错误的是

a.O→a不产生氢气是因为表面的氧化物隔离了铝和稀盐酸
b.b→c段产生氢气的速率增加较快的主要原因之一是温度升高
c.t=c时,反应处于平衡状态
d.t>c时,产生氢气的速率降低的主要原因是溶液中H+浓度下降
(4)雌黄(As2S3)和雄黄(As4S4)都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。在雌黄(As2S3)和雄黄(As4S4)中,S元素均为-2价,一定条件下,雌黄和雄黄的转化关系如图所示。

①以上转换关系中发生的Ⅰ、Ⅱ、Ⅲ、Ⅳ反应,属于氧化还原反应的是
②Ⅱ中若0.1molAs4S4反应转移2.8mole-,则消耗标况下O2的体积是
(5)砷酸钠(Na3AsO4)具有氧化性,298K时,在100mL烧杯中加入10mL0.1mol/LNa3AsO4溶液、20mL0.1mol/LKI溶液和20mL0.05mol/L硫酸溶液,发生下列反应:AsO
 (无色)+2I-+2H+⇌AsO
(无色)+2I-+2H+⇌AsO (无色)+I2(浅黄色)+H2O,测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。下列情况表明上述可逆反应达到平衡状态的是
(无色)+I2(浅黄色)+H2O,测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。下列情况表明上述可逆反应达到平衡状态的是
a.溶液pH保持不变 b.c(AsO
 )+c(AsO
)+c(AsO )不再变化
)不再变化c.
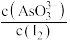 保持变化 d.c(I-)=0.07mol·L-1
保持变化 d.c(I-)=0.07mol·L-1
您最近一年使用:0次
6 . 目前,世界各国相继规划了碳达峰、碳中和。开发CO2利用技术、降低空气中CO2含量成为研究热点。可采用以下方法将CO2进行资源化利用。
(1)CO2催化加氢制甲醇。一定温度下,在某恒容密闭容器中充入一定量的CO2和H2,发生反应:CO2(g)+3H2(g) CH3OH(g) + H2O(g)。下列叙述能说明反应已达到平衡状态的是_______(填标号)
CH3OH(g) + H2O(g)。下列叙述能说明反应已达到平衡状态的是_______(填标号)
(2)CO2催化加氢合成乙烯。在10L某恒容密闭容器中,充入1.4mol CO2和4.2mol H2,发生反应:2CO2(g)+6H2(g) C2 H4(g) + 4H2O(g) ΔH。反应达到平衡后,四种组分的物质的量分数x随温度T的变化如图所示。
C2 H4(g) + 4H2O(g) ΔH。反应达到平衡后,四种组分的物质的量分数x随温度T的变化如图所示。
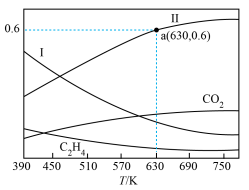
①该反应的ΔH_______ 0(填“>”或“<”),曲线Ⅰ和曲线Ⅱ分别表示_______ (填化学式,下同)和_______ 的变化曲线。
②根据图中a点,计算该温度下平衡时的n(H2O)=_______ mol,c(C2H4)=_______ mol•L-1,CO2 的转化率为_______ %(保留三位有效数字)。
③若平衡时a点容器内气体的总压强为0.25MPa,则该反应平衡常数KP=_______ (MPa)-3(列出计算式即可,分压=总压×物质的量分数,KP就是用分压代替平衡浓度求算的平衡常数)
(3)CO2用途广泛,写出其基于物理性质的一种用途:_______ 。
(1)CO2催化加氢制甲醇。一定温度下,在某恒容密闭容器中充入一定量的CO2和H2,发生反应:CO2(g)+3H2(g)
 CH3OH(g) + H2O(g)。下列叙述能说明反应已达到平衡状态的是_______(填标号)
CH3OH(g) + H2O(g)。下列叙述能说明反应已达到平衡状态的是_______(填标号)| A.混合气体的密度不再随时间变化 |
| B.气体的压强不再随时间变化 |
| C.CH3OH的物质的量分数不再随时间变化 |
| D.单位时间内每形成3mol H—H键,同时断开3mol C—H键。 |
 C2 H4(g) + 4H2O(g) ΔH。反应达到平衡后,四种组分的物质的量分数x随温度T的变化如图所示。
C2 H4(g) + 4H2O(g) ΔH。反应达到平衡后,四种组分的物质的量分数x随温度T的变化如图所示。
①该反应的ΔH
②根据图中a点,计算该温度下平衡时的n(H2O)=
③若平衡时a点容器内气体的总压强为0.25MPa,则该反应平衡常数KP=
(3)CO2用途广泛,写出其基于物理性质的一种用途:
您最近一年使用:0次
2022-11-03更新
|
39次组卷
|
2卷引用:河南省周口市川汇区周口恒大中学2023-2024学年高二下学期开学化学试题
名校
7 . 回答下列问题:
(1)微生物作用下, 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如图:
。两步反应的能量变化示意图如图:

1mol (aq)全部氧化成
(aq)全部氧化成 (aq)的热化学方程式是
(aq)的热化学方程式是_______ 。
(2)高能燃料肼N2H4,俗称联氨。在工业生产中用途广泛。已知N2H4(l)+O2(g)=N2(g)+2H2O(l)ΔH=-622kJ·mol-1,计算16gN2H4(l)燃烧生成氮气和液态水(反应①)时放出的热量为_______ kJ。相同条件下,若生成氮气和水蒸气(反应②),则反应②放出的热量比①_______ (填“多”或“少”)。
(3)甲醇是一种重要的化工原料,CO可用于合成甲醇,发生反应:CO(g)+2H2(g)⇌CH3OH(g)。在一容积可变的密闭容器中充有1molCO与2molH2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(ɑ)与温度(T)、压强(p)的关系如图所示。
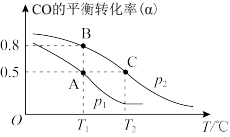
①p1_______ p2(填“>”“<”或“=”)
②A、B、C三点的平衡常数(KA、KB、KC)大小关系为_______ (用“>”“<”或“=”连接,下同)
③A、B、C三点容器内混合气体的平均摩尔质量(MA、MB、MC)大小关系为_______ 。
④下列可作为反应达到化学平衡状态的标志的是_______ (填字母)
A.CO、CH3OH的物质的量之比保持不变
B.生成1molCO的同时生成2molH2
C.CO、H2、CH3OH的物质的量之比为1:2:1
D.CH3OH的体积分数不再变化
(1)微生物作用下,
 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如图:
。两步反应的能量变化示意图如图:
1mol
 (aq)全部氧化成
(aq)全部氧化成 (aq)的热化学方程式是
(aq)的热化学方程式是(2)高能燃料肼N2H4,俗称联氨。在工业生产中用途广泛。已知N2H4(l)+O2(g)=N2(g)+2H2O(l)ΔH=-622kJ·mol-1,计算16gN2H4(l)燃烧生成氮气和液态水(反应①)时放出的热量为
(3)甲醇是一种重要的化工原料,CO可用于合成甲醇,发生反应:CO(g)+2H2(g)⇌CH3OH(g)。在一容积可变的密闭容器中充有1molCO与2molH2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(ɑ)与温度(T)、压强(p)的关系如图所示。

①p1
②A、B、C三点的平衡常数(KA、KB、KC)大小关系为
③A、B、C三点容器内混合气体的平均摩尔质量(MA、MB、MC)大小关系为
④下列可作为反应达到化学平衡状态的标志的是
A.CO、CH3OH的物质的量之比保持不变
B.生成1molCO的同时生成2molH2
C.CO、H2、CH3OH的物质的量之比为1:2:1
D.CH3OH的体积分数不再变化
您最近一年使用:0次
2022-08-18更新
|
132次组卷
|
3卷引用:河南省驻马店市环际大联考2023-2024学年高二上学期11月期中考试化学试题
名校
解题方法
8 . 氨的用途十分广泛,是制造硝酸和氮肥的重要原料。
(1)工业合成氨中,合成塔中每产生2 molNH3,放出92.2kJ热量。
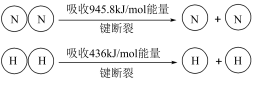
1 mol N-H键断裂吸收的能量约等于_______ kJ
(2)一定条件下,在恒温恒容的密闭容器中充入等物质的量N2和H2发生反应生成NH3,下列状态能说明反应达到平衡的是_______(填标号)。
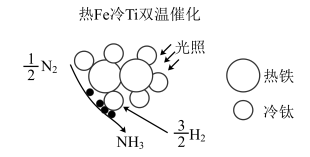
(3)近期我国科学家为了解决合成氨反应速率和平衡产率的矛盾,选择使用Fe-TiO2-xHy双催化剂,通过光辐射产生温差(如体系温度为495℃时,Fe的温度为547℃,而TiO2-xHy的温度为415℃)。结合图示解释该双催化剂的工作原理是_______ 。
(4)已知合成氨反应的速率方程为:ν=kcα(N2)cβ(H2)c-1(NH3),在合成氨过程中,需要不断分离出氨,可能的原因为_______
_______ 。
(5)以氨为原料生产尿素的方程式为2NH3(g)+CO2(g)⇌CO(NH2)2(1)+H2O(g)。
①为进一步提高NH3的平衡转化率,下列措施能达到目的的是_______ (填标号)。
A.增大CO2的浓度 B.增大压强 C.及时转移生成的尿素 D.使用更高效的催化剂
②尿素的合成分两步进行:a.2NH3(g)+CO2(g)⇌NH2COONH4(1) ΔH=-117 kJ/mol
b.NH2COONH4(1)⇌CO(NH2)2(1)+H2O(g) ΔH=+15 kJ/mol,第一步反应速率快,可判断活化能较大的是_______ (填“第一步”或“第二步”)。
③某实验小组为了模拟工业上合成尿素,在恒温恒容的真空密闭容器中充入一定量的CO2和NH3发生反应:2NH3(g)+CO2(g)⇌CO(NH2)2(1)+H2O(g),反应过程中混合气体中NH3的体积分数如下图所示。
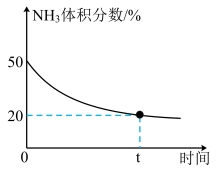
实验测得体系平衡时的压强为10MPa,计算该反应的平衡常数Kp=_______ (已知:分压=总压×体积分数)。
(1)工业合成氨中,合成塔中每产生2 molNH3,放出92.2kJ热量。

1 mol N-H键断裂吸收的能量约等于
(2)一定条件下,在恒温恒容的密闭容器中充入等物质的量N2和H2发生反应生成NH3,下列状态能说明反应达到平衡的是_______(填标号)。
| A.容器内压强不变 | B.N2的体积分数不变 |
| C.气体的密度不再改变 | D.V正(N2)=3V逆(H2) |

(4)已知合成氨反应的速率方程为:ν=kcα(N2)cβ(H2)c-1(NH3),在合成氨过程中,需要不断分离出氨,可能的原因为
(5)以氨为原料生产尿素的方程式为2NH3(g)+CO2(g)⇌CO(NH2)2(1)+H2O(g)。
①为进一步提高NH3的平衡转化率,下列措施能达到目的的是
A.增大CO2的浓度 B.增大压强 C.及时转移生成的尿素 D.使用更高效的催化剂
②尿素的合成分两步进行:a.2NH3(g)+CO2(g)⇌NH2COONH4(1) ΔH=-117 kJ/mol
b.NH2COONH4(1)⇌CO(NH2)2(1)+H2O(g) ΔH=+15 kJ/mol,第一步反应速率快,可判断活化能较大的是
③某实验小组为了模拟工业上合成尿素,在恒温恒容的真空密闭容器中充入一定量的CO2和NH3发生反应:2NH3(g)+CO2(g)⇌CO(NH2)2(1)+H2O(g),反应过程中混合气体中NH3的体积分数如下图所示。

实验测得体系平衡时的压强为10MPa,计算该反应的平衡常数Kp=
您最近一年使用:0次
2023-02-03更新
|
767次组卷
|
6卷引用:河南省焦作市博爱县第一中学2022-2023学年高二下学期5月月考化学试题
河南省焦作市博爱县第一中学2022-2023学年高二下学期5月月考化学试题湖北省高中名校联盟2022-2023学年高三第三次联合测评化学试题(已下线)湖北省七市(州)2023届高三3月联合统一调研测试化学试题变式题(原理综合题)(已下线)预测卷03-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)(已下线)T19-原理综合题湖北省高中名校联盟2022-2023学年高三下学期第三次联合测评化学试题
解题方法
9 . H2在化学工业中有重要用途,中国科学家在以H2为还原剂清除NO的研究方面取得了显著成果,其相关反应如下:
主反应:2NO(g) +2H2(g) N2(g) +2H2O(g) △H1
N2(g) +2H2O(g) △H1
副反应:2NO(g) +H2(g) N2O(g) +H2O(g)△H2
N2O(g) +H2O(g)△H2
试回答下列问题:
(1)已知相关反应过程中的能量变化如下:
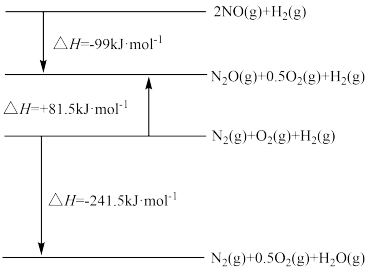
则主反应的△H1=_______ kJ· mol-1,该反应在_______ (填“ 低温”或“高温” )下能自发进行。
(2)研究表明主反应的速率可表示为v=k·c2(NO) ·c(H2)(k为速率常数)。根据Arrhenius方程:lg (R为常数,Ea为反应的活化能),可判断影响速率常数k的外界因素有
(R为常数,Ea为反应的活化能),可判断影响速率常数k的外界因素有_______ (填两种)。
(3)在催化剂作用下,将原料气NO、H2按 )=1充入某刚性密闭容器中,在不同温度下,反应相同时间时测得混合气体中N2、N2O的体积分数随温度的变化关系如图所示:
)=1充入某刚性密闭容器中,在不同温度下,反应相同时间时测得混合气体中N2、N2O的体积分数随温度的变化关系如图所示:
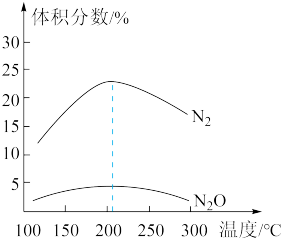
①由图可知,混合气体中N2的体积分数明显高于N2O的原因可能是_______ (填1种);温度高于205°C时,N2的体积分数随温度的升高而减小的原因可能是_______ (列出2点)。
②200°C时,下列事实能说明上述反应达到平衡状态的是_______ (填序号)。
a.混合气体的密度保持不变
b.N2的生成速率等于N2O的消耗速率
c. 保持不变
保持不变
d.H2O(g)的体积分数保持不变
(4)T° C时,向2 L添加催化剂的刚性恒温密闭容器中充入1 mol NO和3 mol H2,发生上述反应,容器内压强随时间的变化如下表(不考虑催化剂对压强的影响):
已知平衡时N2的选择性为90% [N2的选择性= 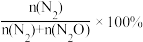 ],则NO的有效去除率 (NO转化为N2)为
],则NO的有效去除率 (NO转化为N2)为_______ % ;根据(2)中的速率方程计算主反应在60 min时的速率v=_______ 。(无需注明单位,用含k的代数式表示)。
主反应:2NO(g) +2H2(g)
 N2(g) +2H2O(g) △H1
N2(g) +2H2O(g) △H1副反应:2NO(g) +H2(g)
 N2O(g) +H2O(g)△H2
N2O(g) +H2O(g)△H2试回答下列问题:
(1)已知相关反应过程中的能量变化如下:

则主反应的△H1=
(2)研究表明主反应的速率可表示为v=k·c2(NO) ·c(H2)(k为速率常数)。根据Arrhenius方程:lg
 (R为常数,Ea为反应的活化能),可判断影响速率常数k的外界因素有
(R为常数,Ea为反应的活化能),可判断影响速率常数k的外界因素有(3)在催化剂作用下,将原料气NO、H2按
 )=1充入某刚性密闭容器中,在不同温度下,反应相同时间时测得混合气体中N2、N2O的体积分数随温度的变化关系如图所示:
)=1充入某刚性密闭容器中,在不同温度下,反应相同时间时测得混合气体中N2、N2O的体积分数随温度的变化关系如图所示: 
①由图可知,混合气体中N2的体积分数明显高于N2O的原因可能是
②200°C时,下列事实能说明上述反应达到平衡状态的是
a.混合气体的密度保持不变
b.N2的生成速率等于N2O的消耗速率
c.
 保持不变
保持不变d.H2O(g)的体积分数保持不变
(4)T° C时,向2 L添加催化剂的刚性恒温密闭容器中充入1 mol NO和3 mol H2,发生上述反应,容器内压强随时间的变化如下表(不考虑催化剂对压强的影响):
| 时间/ min | 0 | 20 | 40 | 60 | 80 |
| 压强/MPa | p0 | 0.96p0 | 0. 92p0 | 0. 90p0 | 0. 90p0 |
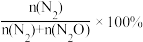 ],则NO的有效去除率 (NO转化为N2)为
],则NO的有效去除率 (NO转化为N2)为
您最近一年使用:0次
10 . 苯硫酚(C6H5-SH)是一种用途广泛的有机合成中间体。工业上常用氯苯(C6H5-Cl)和硫化氢(H2S)反应制备苯硫酚,该反应常伴有副产物苯(C6H6)生成,发生如下反应:
①主反应:C6H5-Cl(g)+H2S(g) C6H5-SH(g)+HCl(g) ΔH1=-16.8kJ·mol-1;
C6H5-SH(g)+HCl(g) ΔH1=-16.8kJ·mol-1;
②副反应:C6H5-Cl(g)+H2S(g) C6H6(g)+HCl(g)+
C6H6(g)+HCl(g)+ S8(g) ΔH2;
S8(g) ΔH2;
查阅相关资料可知,C6H5-SH(g) C6H6(g)+
C6H6(g)+ S8(g) ΔH3=-29.0kJ·mol-1。
S8(g) ΔH3=-29.0kJ·mol-1。
回答下列问题:
(1)在副反应中,反应物的键能总和_______ (填“>”、“<”或“=”)生成物的键能总和。
(2)为了提高C6H5-Cl(g)的转化率,可采取的措施有_______ (填一种即可)。
(3)在一定温度下,往容积为5L的恒容密闭容器中,充入2molC6H5-Cl(g)和2molH2S(g),发生上述反应,2min时,反应达到平衡,此时测得容器中反应前后混合气体的总压强之比为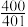 ,C6H5-SH(g)的物质的量分数为25%。
,C6H5-SH(g)的物质的量分数为25%。
①0~2min内,v(C6H5-Cl)=_______ mol·L-1·min-1。
②2min时,c(HCl)=_______ mol·L-1,H2S(g)的转化率为_______ %。
③该温度下,主反应的平衡常数K=_______ (写出计算式即可)。
④下列叙述能用来判断上述反应已达到平衡状态的是_______ (填标号)。
A.混合气体的总质量不再随时间改变
B.混合气体的总压强不再随时间改变
C.混合气体的密度不再随时间改变
D.混合气体的相对分子质量不再随时间改变
①主反应:C6H5-Cl(g)+H2S(g)
 C6H5-SH(g)+HCl(g) ΔH1=-16.8kJ·mol-1;
C6H5-SH(g)+HCl(g) ΔH1=-16.8kJ·mol-1;②副反应:C6H5-Cl(g)+H2S(g)
 C6H6(g)+HCl(g)+
C6H6(g)+HCl(g)+ S8(g) ΔH2;
S8(g) ΔH2;查阅相关资料可知,C6H5-SH(g)
 C6H6(g)+
C6H6(g)+ S8(g) ΔH3=-29.0kJ·mol-1。
S8(g) ΔH3=-29.0kJ·mol-1。回答下列问题:
(1)在副反应中,反应物的键能总和
(2)为了提高C6H5-Cl(g)的转化率,可采取的措施有
(3)在一定温度下,往容积为5L的恒容密闭容器中,充入2molC6H5-Cl(g)和2molH2S(g),发生上述反应,2min时,反应达到平衡,此时测得容器中反应前后混合气体的总压强之比为
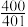 ,C6H5-SH(g)的物质的量分数为25%。
,C6H5-SH(g)的物质的量分数为25%。①0~2min内,v(C6H5-Cl)=
②2min时,c(HCl)=
③该温度下,主反应的平衡常数K=
④下列叙述能用来判断上述反应已达到平衡状态的是
A.混合气体的总质量不再随时间改变
B.混合气体的总压强不再随时间改变
C.混合气体的密度不再随时间改变
D.混合气体的相对分子质量不再随时间改变
您最近一年使用:0次
2021-12-18更新
|
127次组卷
|
2卷引用:河南省南阳地区 2021-2022学年高二上学期 12 月阶段检测化学试题



