解题方法
1 . 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,向碘水中滴加淀粉溶液,可观察到溶液_______ 。
(2)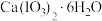 加热升温过程中剩余固体的质量分数随温度变化的关系如图所示:
加热升温过程中剩余固体的质量分数随温度变化的关系如图所示:
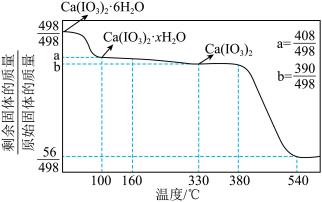
根据上述实验结果,可知
_______ ;540℃时,剩余固体的化学式为_______ 。
(3)已知下列热化学方程式:
反应Ⅰ:
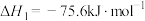
反应Ⅱ: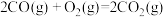
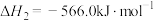
则反应Ⅲ: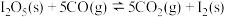

_______  。
。
(4)若在恒温恒容的密闭体系中进行上述反应Ⅲ,下列能说明反应Ⅲ达到平衡状态的是_______(填字母)。
(5)某温度下,向装有足量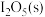 的2L恒容密闭容器中充入
的2L恒容密闭容器中充入
 ,此时压强为
,此时压强为 ,发生反应Ⅲ,若反应达到平衡后固体质量减小32.0g。计算该温度下反应的平衡常数
,发生反应Ⅲ,若反应达到平衡后固体质量减小32.0g。计算该温度下反应的平衡常数
_______ (用平衡分压代替平衡浓度计算,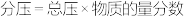 )。
)。
(6) 时,向装有足量
时,向装有足量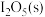 的2L恒容密闭容器中充入
的2L恒容密闭容器中充入
 发生反应Ⅲ,经5s反应达到平衡,消耗
发生反应Ⅲ,经5s反应达到平衡,消耗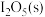 物质的量为
物质的量为 。
。
①0~5s内
_______  。
。
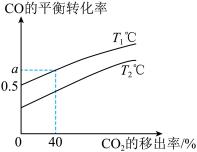
②下图是 的平衡转化率随
的平衡转化率随 的移出率关系图[
的移出率关系图[ 的移出率
的移出率 ],则图中
],则图中
_______  (填“>”、“<”或“=”),
(填“>”、“<”或“=”),
_______ 。
(1)大量的碘富集在海藻中,向碘水中滴加淀粉溶液,可观察到溶液
(2)
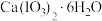 加热升温过程中剩余固体的质量分数随温度变化的关系如图所示:
加热升温过程中剩余固体的质量分数随温度变化的关系如图所示:
根据上述实验结果,可知

(3)已知下列热化学方程式:
反应Ⅰ:

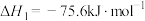
反应Ⅱ:
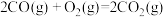
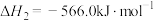
则反应Ⅲ:
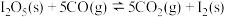

 。
。(4)若在恒温恒容的密闭体系中进行上述反应Ⅲ,下列能说明反应Ⅲ达到平衡状态的是_______(填字母)。
| A.平衡常数K保持不变 | B. 和 和 的物质的量相等 的物质的量相等 |
C. | D.混合气体的平均摩尔质量不变 |
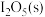 的2L恒容密闭容器中充入
的2L恒容密闭容器中充入
 ,此时压强为
,此时压强为 ,发生反应Ⅲ,若反应达到平衡后固体质量减小32.0g。计算该温度下反应的平衡常数
,发生反应Ⅲ,若反应达到平衡后固体质量减小32.0g。计算该温度下反应的平衡常数
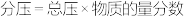 )。
)。(6)
 时,向装有足量
时,向装有足量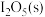 的2L恒容密闭容器中充入
的2L恒容密闭容器中充入
 发生反应Ⅲ,经5s反应达到平衡,消耗
发生反应Ⅲ,经5s反应达到平衡,消耗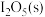 物质的量为
物质的量为 。
。①0~5s内

 。
。②下图是
 的平衡转化率随
的平衡转化率随 的移出率关系图[
的移出率关系图[ 的移出率
的移出率 ],则图中
],则图中
 (填“>”、“<”或“=”),
(填“>”、“<”或“=”),

您最近一年使用:0次
2 . 氨为重要的化工原料,有广泛用途。若起始时投入氮气和氢气分别为1mol、3mol,在不同温度和压强下合成氨。平衡混合物中氨的体积分数与温度关系如图。
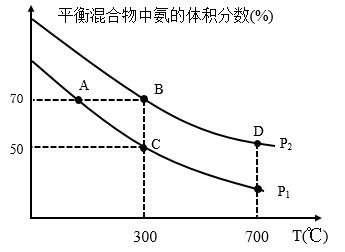
(1)恒压时,反应一定达到平衡状态的标志是_______ (填序号);
A.N2和H2的转化率相等
B.反应体系密度保持不变
C. 比值保持不变
比值保持不变
D.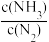 =2
=2
(2)P1_____ P2(填“>”、“<”、“=”、下同);平衡常数:B点_______ D点。
(3在A、B两点反应条件下,该反应从开始到平衡时生成氨气的平均速率:v(A)____ v(B)。

(1)恒压时,反应一定达到平衡状态的标志是
A.N2和H2的转化率相等
B.反应体系密度保持不变
C.
 比值保持不变
比值保持不变D.
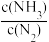 =2
=2(2)P1
(3在A、B两点反应条件下,该反应从开始到平衡时生成氨气的平均速率:v(A)
您最近一年使用:0次
3 . 氮及其化合物在工业上有重要用途。请回答下列有关问题:
(1)已知N2(g)+O2(g)=2NO(g) ΔH =+180.5kJ·mol-1,N2(g)+3H2(g) 2NH3(g)ΔH =-92.4kJ·mol-1,2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ·mol-1,写出氨气经催化氧化完全生成一氧化氮和水蒸气的热化学方程式为
2NH3(g)ΔH =-92.4kJ·mol-1,2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ·mol-1,写出氨气经催化氧化完全生成一氧化氮和水蒸气的热化学方程式为_________
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g),在恒温恒压下判断该反应达到化学平衡状态的依据是
2NH3(g),在恒温恒压下判断该反应达到化学平衡状态的依据是______ (填序号);
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2) (正)=v(H2) (逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)在有氧条件下,新型催化剂M能催化 与
与 生成
生成 。将一定比例的
。将一定比例的 、
、 和
和 的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图)。
的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图)。
反应相同时间 的去除率随反应温度的变化曲线如图所示,在
的去除率随反应温度的变化曲线如图所示,在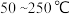 范围内随着温度的升高,
范围内随着温度的升高, 的去除率先迅速上升后上升缓慢,迅速上升段是催化剂活性随温度升高增大,与温度升高共同使
的去除率先迅速上升后上升缓慢,迅速上升段是催化剂活性随温度升高增大,与温度升高共同使 去除反应速率迅速增大,上升阶段缓慢主要是
去除反应速率迅速增大,上升阶段缓慢主要是____________ ;当反应温度高于 时,
时, 的去除率迅速下降的原因可能是
的去除率迅速下降的原因可能是_________ 。
(4)如图为利用肼 —空气燃料电池电解硫酸铜溶液的示意图。
—空气燃料电池电解硫酸铜溶液的示意图。
左图负极反应式为:___________ 。当上图阴极上放出2.24L气体 标准状况
标准状况 时,图中硫酸铜溶液的pH=
时,图中硫酸铜溶液的pH=______ (溶液体积变化忽略不计)。
(4)工业上生产尿素的化学方程式为:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6mol NH3和3mol CO2 。10min反应达到平衡,达到平衡时,c(NH3)=0.5mol·L-1。则10min内的平均反应速率υ(CO2)=
CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6mol NH3和3mol CO2 。10min反应达到平衡,达到平衡时,c(NH3)=0.5mol·L-1。则10min内的平均反应速率υ(CO2)=_______ mol·L-1·min-1。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3mol NH3,则此时反应的v正____ v逆(填“>”“<”或“=”)。
(1)已知N2(g)+O2(g)=2NO(g) ΔH =+180.5kJ·mol-1,N2(g)+3H2(g)
 2NH3(g)ΔH =-92.4kJ·mol-1,2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ·mol-1,写出氨气经催化氧化完全生成一氧化氮和水蒸气的热化学方程式为
2NH3(g)ΔH =-92.4kJ·mol-1,2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ·mol-1,写出氨气经催化氧化完全生成一氧化氮和水蒸气的热化学方程式为(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)
 2NH3(g),在恒温恒压下判断该反应达到化学平衡状态的依据是
2NH3(g),在恒温恒压下判断该反应达到化学平衡状态的依据是A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2) (正)=v(H2) (逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)在有氧条件下,新型催化剂M能催化
 与
与 生成
生成 。将一定比例的
。将一定比例的 、
、 和
和 的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图)。
的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图)。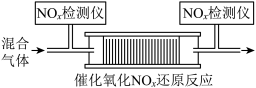
反应相同时间
 的去除率随反应温度的变化曲线如图所示,在
的去除率随反应温度的变化曲线如图所示,在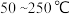 范围内随着温度的升高,
范围内随着温度的升高, 的去除率先迅速上升后上升缓慢,迅速上升段是催化剂活性随温度升高增大,与温度升高共同使
的去除率先迅速上升后上升缓慢,迅速上升段是催化剂活性随温度升高增大,与温度升高共同使 去除反应速率迅速增大,上升阶段缓慢主要是
去除反应速率迅速增大,上升阶段缓慢主要是 时,
时, 的去除率迅速下降的原因可能是
的去除率迅速下降的原因可能是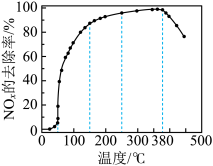
(4)如图为利用肼
 —空气燃料电池电解硫酸铜溶液的示意图。
—空气燃料电池电解硫酸铜溶液的示意图。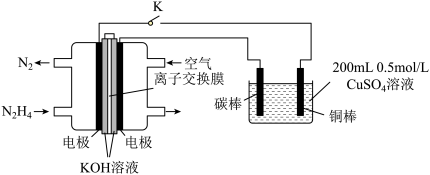
左图负极反应式为:
 标准状况
标准状况 时,图中硫酸铜溶液的pH=
时,图中硫酸铜溶液的pH=(4)工业上生产尿素的化学方程式为:2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6mol NH3和3mol CO2 。10min反应达到平衡,达到平衡时,c(NH3)=0.5mol·L-1。则10min内的平均反应速率υ(CO2)=
CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6mol NH3和3mol CO2 。10min反应达到平衡,达到平衡时,c(NH3)=0.5mol·L-1。则10min内的平均反应速率υ(CO2)=
您最近一年使用:0次



