解题方法
1 . 合成氨是人类科学技术发展史上的一项重大突破,目前工业上用氢气和氮气直接合成氨。
(1)固氮一直是科学家致力研究的重要课题,有关热力学数据如下:
常温下,大气固氮的倾向______ 工业固氮(填“大于”或“小于”)。
(2)N2(g)与H2(g)反应的能量变化如图所示。
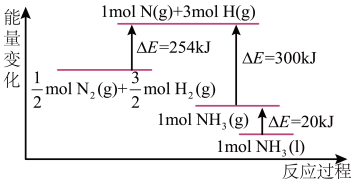
则N2(g)与H2(g)制备NH3(l)的热化学方程式为__________________ 。
(3)T ℃时,在 2 L恒容密闭容器中加入 1.2 mol N2和2 mol H2模拟一定条件下工业固氮[N2(g)+3H2(g)⇌2NH3(g)],体系中n(NH3)随时间的变化如图。
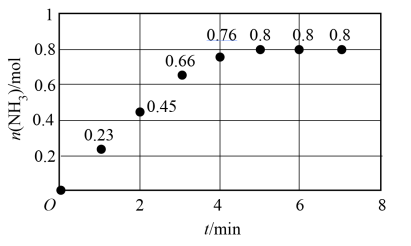
①前2分钟内的平均反应速率v(NH3)=______ mol·L-1·min-1。
②下列情况能说明该反应已达到平衡状态的是______ (选填序号)。
A.混合气体的密度不变
B.单位时间内断裂n mol N—H键的同时形成n mol H—H键
C.容器内的总压强不再变化
D.3v 正(H2)=2v 逆(NH3)
③有关工业固氮的说法正确的是______ (选填序号)。
A.使用催化剂可提高反应物的转化率
B.循环使用N2、H2可提高NH3的产率
C.温度控制在500℃左右有利于反应向正方向进行
D.增大压强有利于加快反应速率,所以压强越大越好
④T ℃时,该反应的平衡常数为______ 。
(4)研究表明某些过渡金属催化剂可以加速氨气的分解,某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解的初始速率(单位:mmol·min-1)与催化剂的对应关系如表所示。
在不同催化剂的催化作用下,氨气分解反应中的活化能最大的催化剂是______ (填化学式)。
(1)固氮一直是科学家致力研究的重要课题,有关热力学数据如下:
| 反应 | 大气固氮N2(g)+O2(g)⇌2NO(g) | 工业固氮N2(g)+3H2(g)⇌2NH3(g) | ||||
| 温度/℃ | 25 | 2000 | 25 | 350 | 400 | 450 |
| 平衡常数(K) | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.504 | 0.152 |
(2)N2(g)与H2(g)反应的能量变化如图所示。

则N2(g)与H2(g)制备NH3(l)的热化学方程式为
(3)T ℃时,在 2 L恒容密闭容器中加入 1.2 mol N2和2 mol H2模拟一定条件下工业固氮[N2(g)+3H2(g)⇌2NH3(g)],体系中n(NH3)随时间的变化如图。

①前2分钟内的平均反应速率v(NH3)=
②下列情况能说明该反应已达到平衡状态的是
A.混合气体的密度不变
B.单位时间内断裂n mol N—H键的同时形成n mol H—H键
C.容器内的总压强不再变化
D.3v 正(H2)=2v 逆(NH3)
③有关工业固氮的说法正确的是
A.使用催化剂可提高反应物的转化率
B.循环使用N2、H2可提高NH3的产率
C.温度控制在500℃左右有利于反应向正方向进行
D.增大压强有利于加快反应速率,所以压强越大越好
④T ℃时,该反应的平衡常数为
(4)研究表明某些过渡金属催化剂可以加速氨气的分解,某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解的初始速率(单位:mmol·min-1)与催化剂的对应关系如表所示。
| 催化剂 | Fe | Pd | Ru | Rh | Pt | Ni |
| 初始速率 | 0.5 | 1.8 | 7.9 | 4.0 | 2.2 | 3.0 |
您最近一年使用:0次
2020-09-28更新
|
173次组卷
|
2卷引用:吉林省长春市北师大附属学校2021-2022学年高三上学期第一次月考化学试题
名校
2 . 氮及其化合物在生产、环保研究等方面用途非常广泛,回答下列问题:
(1)用浓氨水除去Fe(OH)3样品中少量的Cu(OH)2,生成[Cu(NH3)4]2+,1mol[Cu(NH3)4]2+含______ molσ键。
(2)硝酸厂尾气可以回收制备硝酸。已知:
①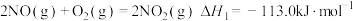
②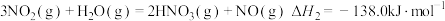
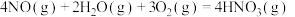 ,
,
______  。
。
(3)在隔绝空气的密闭容器中发生反应:FeSO4(aq)+NO(g) Fe(NO)SO4(aq)(棕黄色),下列叙述正确的是______。(填标号)
Fe(NO)SO4(aq)(棕黄色),下列叙述正确的是______。(填标号)
(4)向一恒容密闭容器中充入适量NH3和O2,在一定条件下发生反应,氧化产物是N2、NO、NO2、N2O中的一种,达到平衡时改变温度,反应物和生成物的浓度与温度关系如图所示:______ (填化学式),写出该反应的化学方程式:______ 。
②正反应
______ (填“>”“<”或“=”)0,判断依据是______
③T3℃时NH3的平衡转化率为______ 。
(1)用浓氨水除去Fe(OH)3样品中少量的Cu(OH)2,生成[Cu(NH3)4]2+,1mol[Cu(NH3)4]2+含
(2)硝酸厂尾气可以回收制备硝酸。已知:
①
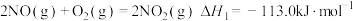
②
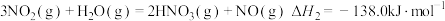
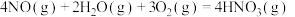 ,
,
 。
。(3)在隔绝空气的密闭容器中发生反应:FeSO4(aq)+NO(g)
 Fe(NO)SO4(aq)(棕黄色),下列叙述正确的是______。(填标号)
Fe(NO)SO4(aq)(棕黄色),下列叙述正确的是______。(填标号)| A.溶液颜色不变,反应达到平衡状态 | B.其他条件不变,充入少量O2,平衡不移动 |
| C.其他条件不变,加少量FeSO4,溶液颜色加深 | D.其他条件不变,微热,溶液颜色加深 |
(4)向一恒容密闭容器中充入适量NH3和O2,在一定条件下发生反应,氧化产物是N2、NO、NO2、N2O中的一种,达到平衡时改变温度,反应物和生成物的浓度与温度关系如图所示:

②正反应

③T3℃时NH3的平衡转化率为
您最近一年使用:0次
2024-03-19更新
|
386次组卷
|
3卷引用:2024届吉林省通化市梅河口市第五中学高三下学期一模化学试题
名校
3 . 甲醇 是一种重要的化工原料,在生产生活中有重要用途。现在2L的恒容密闭容器中充入
是一种重要的化工原料,在生产生活中有重要用途。现在2L的恒容密闭容器中充入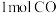 和
和 ,一定条件下发生反应:
,一定条件下发生反应: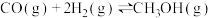 。测得CO和
。测得CO和 的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
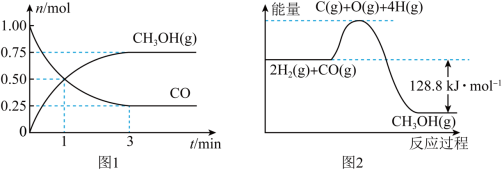
(1)从反应开始至达到平衡,以 表示的反应的平均反应速率
表示的反应的平均反应速率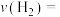
___________ ;下列措施能增大反应速率的是___________ 。
A.升高温度 B.降低压强 C.减小 的浓度 D.加入合适的催化剂
的浓度 D.加入合适的催化剂
(2)反应达到平衡状态时 的转化率为
的转化率为___________ 。
(3)在相同条件下,若向该密闭容器中充入 与
与 ,二者充分反应后,根据反应的特点推测,能够
,二者充分反应后,根据反应的特点推测,能够___________ (填放出或吸收)的热量___________ (填“>”“<”或“=”)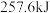 。
。
 是一种重要的化工原料,在生产生活中有重要用途。现在2L的恒容密闭容器中充入
是一种重要的化工原料,在生产生活中有重要用途。现在2L的恒容密闭容器中充入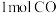 和
和 ,一定条件下发生反应:
,一定条件下发生反应: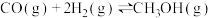 。测得CO和
。测得CO和 的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
(1)从反应开始至达到平衡,以
 表示的反应的平均反应速率
表示的反应的平均反应速率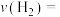
A.升高温度 B.降低压强 C.减小
 的浓度 D.加入合适的催化剂
的浓度 D.加入合适的催化剂(2)反应达到平衡状态时
 的转化率为
的转化率为(3)在相同条件下,若向该密闭容器中充入
 与
与 ,二者充分反应后,根据反应的特点推测,能够
,二者充分反应后,根据反应的特点推测,能够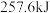 。
。
您最近一年使用:0次
2023-05-11更新
|
503次组卷
|
3卷引用:吉林省延边第二中学2022-2023学年高一下学期5月期中考试化学试题
解题方法
4 . 运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g) CO(g)+3H2(g) ∆H1=+216.4kJ/mol
CO(g)+3H2(g) ∆H1=+216.4kJ/mol
b. CO(g)+H2O(g) CO2(g)+H2(g) ∆H2= –41.2kJ/mol
CO2(g)+H2(g) ∆H2= –41.2kJ/mol
则反应CH4(g)+2H2O(g) CO2(g)+4H2(g) ∆H=
CO2(g)+4H2(g) ∆H= _________ 。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。
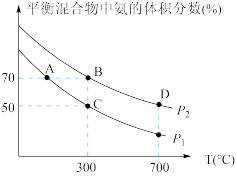
①恒压时,反应一定达到平衡状态的标志是_________ (填序号)
A. 和
和 的转化率相等 B.反应体系密度保持不变
的转化率相等 B.反应体系密度保持不变
C. 保持不变 D.
保持不变 D.
②P1_________ P2 (填“>” “<”“=”或“不确定”,下同);反应的平衡常数:B点_________ D点。
③C点 的转化率为
的转化率为_________ ;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)_________ υ(B)。
Ⅱ.用间接电化学法去除烟气中NO的原理如下图所示。

(3)已知阴极室溶液呈酸性,则阴极的电极反应式为_________ 。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)
 CO(g)+3H2(g) ∆H1=+216.4kJ/mol
CO(g)+3H2(g) ∆H1=+216.4kJ/molb. CO(g)+H2O(g)
 CO2(g)+H2(g) ∆H2= –41.2kJ/mol
CO2(g)+H2(g) ∆H2= –41.2kJ/mol则反应CH4(g)+2H2O(g)
 CO2(g)+4H2(g) ∆H=
CO2(g)+4H2(g) ∆H= (2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。

①恒压时,反应一定达到平衡状态的标志是
A.
 和
和 的转化率相等 B.反应体系密度保持不变
的转化率相等 B.反应体系密度保持不变C.
 保持不变 D.
保持不变 D.
②P1
③C点
 的转化率为
的转化率为Ⅱ.用间接电化学法去除烟气中NO的原理如下图所示。

(3)已知阴极室溶液呈酸性,则阴极的电极反应式为
您最近一年使用:0次
5 . 氨为重要的化工原料,有广泛用途,合成氨气的反应原理是:N2+3H2 2NH3。起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。
2NH3。起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。
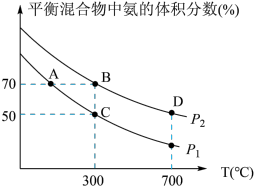
①恒压时,反应一定达到平衡状态的标志是_____ (填序号)
A.N2和H2的转化率相等 B.反应体系密度保持不变
C.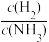 保持不变 D.
保持不变 D.
②该反应的平衡常数表达式K=_____ ,∆H_____ 。
③比较大小:P1_____ P2,理由是_____
④平衡时B、D两点的正反应速率:υ(B)___ υ(D)。(填“<”或“>”或“=”)
 2NH3。起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。
2NH3。起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。
①恒压时,反应一定达到平衡状态的标志是
A.N2和H2的转化率相等 B.反应体系密度保持不变
C.
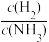 保持不变 D.
保持不变 D.
②该反应的平衡常数表达式K=
③比较大小:P1
④平衡时B、D两点的正反应速率:υ(B)
您最近一年使用:0次
真题
名校
6 . 砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________ 。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________ 。该反应需要在加压下进行,原因是________________________ 。
(3)已知:As(s)+ H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
(4)298 K时,将20 mL 3x mol·L−1 Na3AsO3、20 mL 3x mol·L−1 I2和20 mL NaOH溶液混合,发生反应: (aq)+I2(aq)+2OH−(aq)
(aq)+I2(aq)+2OH−(aq)
 (aq)+2I−(aq)+ H2O(l)。溶液中c(
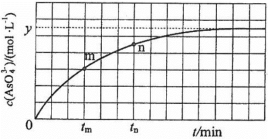
(aq)+2I−(aq)+ H2O(l)。溶液中c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
①下列可判断反应达到平衡的是__________ (填标号)。
a.溶液的pH不再变化
b.v(I−)=2v( )
)
c.c( )/c(
)/c( )不再变化
)不再变化
d.c(I−)=y mol·L−1
②tm时,v正_____ v逆(填“大于”“小于”或“等于”)。
③tm时v逆_____ tn时v逆(填“大于”“小于”或“等于”),理由是_____________ 。
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________ 。
(1)画出砷的原子结构示意图
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式
(3)已知:As(s)+
 H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1H2(g)+ O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+ O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =
(4)298 K时,将20 mL 3x mol·L−1 Na3AsO3、20 mL 3x mol·L−1 I2和20 mL NaOH溶液混合,发生反应:
 (aq)+I2(aq)+2OH−(aq)
(aq)+I2(aq)+2OH−(aq)
 (aq)+2I−(aq)+ H2O(l)。溶液中c(
(aq)+2I−(aq)+ H2O(l)。溶液中c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
①下列可判断反应达到平衡的是
a.溶液的pH不再变化
b.v(I−)=2v(
 )
)c.c(
 )/c(
)/c( )不再变化
)不再变化d.c(I−)=y mol·L−1
②tm时,v正
③tm时v逆
④若平衡时溶液的pH=14,则该反应的平衡常数K为
您最近一年使用:0次
2017-08-08更新
|
8543次组卷
|
16卷引用:吉林省长春市东北师大附中2020届高中毕业班三月份网络教学质量监测卷理科综合化学部分
吉林省长春市东北师大附中2020届高中毕业班三月份网络教学质量监测卷理科综合化学部分2017年全国普通高等学校招生统一考试理综化学(新课标Ⅲ卷精编版)内蒙古集宁一中2018届高三上学期第三次月考化学试题(已下线)黄金30题系列 高三化学 大题易丢分西藏拉萨北京实验中学2018届高三第五次月考理科综合化学试题(已下线)《考前20天终极攻略》-5月29日 化学反应原理综合(已下线)解密10 化学反应速率与化学平衡(教师版)——备战2018年高考化学之高频考点解密(已下线)解密20 原理综合题(教师版)——备战2018年高考化学之高频考点解密(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第5讲 数形结合思想的应用【教学案】(已下线)广东省深圳中学2020届高三2月份网络教学质量监测理综化学试题2020届湖南省湘潭市高三教学质量监测卷化学试题广西北流市实验中学2019-2020学年高二下学期期中考试理科综合化学试题(已下线)专题14 化学反应原理综合-备战2021届高考化学二轮复习题型专练广东省湛江市第二十一中学2021-2022学年高二上学期期中考试化学试题云南省昌宁县第一中学2021-2022学年高三下学期3月月考化学试题云南省玉溪市民族中学2021-2022学年高三1月份考试理综化学试题
解题方法
7 . 甲醇来源丰富、价格低廉,是一种重要的化工原料,有着重要的用途和应用前景。
Ⅰ.工业生产甲醇的常用方法是:CO(g)+2H2(g) CH3OH(g) △H = -91 kJ/mol。
CH3OH(g) △H = -91 kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l) △H = -580kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H = -570 kJ/mol
(1)计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H =__________ 。
(2)若在恒温恒容的容器内进行反应CO(g)+2H2(g) CH3OH(g),下列表示该反应
CH3OH(g),下列表示该反应没有 达到平衡状态的有__________(填字母序号)。
Ⅱ.制甲醇所需要的H2,可用下列反应制取:H2O(g)+CO(g) H2(g)+ CO2(g) △H<0,某温度下该反应达到平衡时,c(H2)·c(CO2)= c(CO)·c(H2O),若起始时c(CO)=1 mol/L-1,c(H2O)=1 mol/L-1,试回答下列问题:
H2(g)+ CO2(g) △H<0,某温度下该反应达到平衡时,c(H2)·c(CO2)= c(CO)·c(H2O),若起始时c(CO)=1 mol/L-1,c(H2O)=1 mol/L-1,试回答下列问题:
(3)该温度下,反应进行一阶段时间后,测得H2的浓度为0.5 mol/L-1,则此时该反应v(正)__________ v(逆)(填“>”、“<”或“=”);
(4)若反应温度不变,达到平衡后,H2O的转化率为________ 。
Ⅲ.某实验小组设计了甲醇以氢氧化钾为电解质溶液的燃料电池装置。
(5)试想该电池工作时,OH-向_______ 极移动(填“负”或“正”);
(6)工作一段时间后,测得溶液的pH减小,该电池负极反应的离子方程式为______________________ ,总反应的化学方程式为______________________ 。
Ⅰ.工业生产甲醇的常用方法是:CO(g)+2H2(g)
 CH3OH(g) △H = -91 kJ/mol。
CH3OH(g) △H = -91 kJ/mol。已知:2H2(g)+O2(g)=2H2O(l) △H = -580kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H = -570 kJ/mol
(1)计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H =
(2)若在恒温恒容的容器内进行反应CO(g)+2H2(g)
 CH3OH(g),下列表示该反应
CH3OH(g),下列表示该反应| A.CO百分含量保持不变 | B.容器中混合气体的密度不变化 |
| C.有1个H-H键生成的同时有 3个C-H键生成 | D.容器中混合气体的压强不变化 |
Ⅱ.制甲醇所需要的H2,可用下列反应制取:H2O(g)+CO(g)
 H2(g)+ CO2(g) △H<0,某温度下该反应达到平衡时,c(H2)·c(CO2)= c(CO)·c(H2O),若起始时c(CO)=1 mol/L-1,c(H2O)=1 mol/L-1,试回答下列问题:
H2(g)+ CO2(g) △H<0,某温度下该反应达到平衡时,c(H2)·c(CO2)= c(CO)·c(H2O),若起始时c(CO)=1 mol/L-1,c(H2O)=1 mol/L-1,试回答下列问题:(3)该温度下,反应进行一阶段时间后,测得H2的浓度为0.5 mol/L-1,则此时该反应v(正)
(4)若反应温度不变,达到平衡后,H2O的转化率为
Ⅲ.某实验小组设计了甲醇以氢氧化钾为电解质溶液的燃料电池装置。
(5)试想该电池工作时,OH-向
(6)工作一段时间后,测得溶液的pH减小,该电池负极反应的离子方程式为
您最近一年使用:0次
2017-07-21更新
|
114次组卷
|
2卷引用:吉林省扶余一中2016-2017学年高一下学期期末考试化学试题
8 . 氨在生活、生产、科研中有广泛用途。
(1)已知反应Ⅰ:2NH3(g) +CO2(g) =NH2CO2NH4(s) △H=−159.5 kJ/mol
反应Ⅱ:NH2CO2NH4(s) =CO(NH2)2 (s)+ H2O(g) △H=+116.5 kJ/mol
反应Ⅲ:H2O(l) = H2O(g) △H=+44.0 kJ/mol
则工业上以CO2、NH3为原料合成尿素和液态水的热化学方程式为___________________ ,该反应在____________ 条件下可以自发进行(填“高温”、“低温”或“任何温度下”);
(2)用NH3催化还原NxOy可以消除氮氧化物的污染。如有反应4NH3(g)+6NO(g) 5N2(g)+6H2O(l) △H<0,相同条件下在2 L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。
5N2(g)+6H2O(l) △H<0,相同条件下在2 L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。
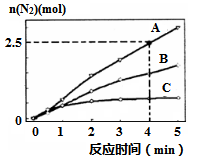
①0~4分钟在A催化剂作用下,反应速率υ(N2)=______ ;
②下列说法正确的是____________ ;
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea (C)
B.使用催化剂A达平衡时,N2最终产率更大
C.单位时间内氢氧键与氮氢键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当平衡常数不变时,说明反应已经达到平衡
(3)查阅资料可知:常温下,K稳[Ag(NH3)2+]=1.00×107,Ksp[AgCl]=2.50×10-10。
①银氨溶液中存在平衡:Ag+(aq)+2NH3(aq) Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=
Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=______________________ ;
②计算得到可逆反应AgCl (s)+2NH3(aq) Ag(NH3)2+ (aq)+Cl-(aq)的化学平衡常数K=
Ag(NH3)2+ (aq)+Cl-(aq)的化学平衡常数K=_________ ,1 L 1 mol/L氨水中最多可以溶解AgCl________ mol(保留2位有效数字);
(4)工业上以氨、丙烯和空气为原料,一定条件下合成丙烯腈(CH2=CH—CN),该反应的化学方程式为____________________________________ 。
(1)已知反应Ⅰ:2NH3(g) +CO2(g) =NH2CO2NH4(s) △H=−159.5 kJ/mol
反应Ⅱ:NH2CO2NH4(s) =CO(NH2)2 (s)+ H2O(g) △H=+116.5 kJ/mol
反应Ⅲ:H2O(l) = H2O(g) △H=+44.0 kJ/mol
则工业上以CO2、NH3为原料合成尿素和液态水的热化学方程式为
(2)用NH3催化还原NxOy可以消除氮氧化物的污染。如有反应4NH3(g)+6NO(g)
 5N2(g)+6H2O(l) △H<0,相同条件下在2 L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。
5N2(g)+6H2O(l) △H<0,相同条件下在2 L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。
①0~4分钟在A催化剂作用下,反应速率υ(N2)=
②下列说法正确的是
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea (C)
B.使用催化剂A达平衡时,N2最终产率更大
C.单位时间内氢氧键与氮氢键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当平衡常数不变时,说明反应已经达到平衡
(3)查阅资料可知:常温下,K稳[Ag(NH3)2+]=1.00×107,Ksp[AgCl]=2.50×10-10。
①银氨溶液中存在平衡:Ag+(aq)+2NH3(aq)
 Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=
Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=②计算得到可逆反应AgCl (s)+2NH3(aq)
 Ag(NH3)2+ (aq)+Cl-(aq)的化学平衡常数K=
Ag(NH3)2+ (aq)+Cl-(aq)的化学平衡常数K=(4)工业上以氨、丙烯和空气为原料,一定条件下合成丙烯腈(CH2=CH—CN),该反应的化学方程式为
您最近一年使用:0次



