1 . 随着时代的进步,人类对能源的需求量与日俱增,我国全球首套焦炉气化学合成法生产无水乙醇的工业示范项目打通全流程实现,项目投产成功。
(1)

___________ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
已知:
i.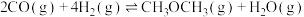

ii.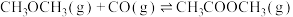

iii.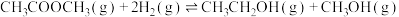

(2)在恒温恒容密闭容器中充入3mol 和6mol
和6mol 仅发生反应
仅发生反应
 ,下列叙述不正确的是___________(填标号)。
,下列叙述不正确的是___________(填标号)。
(3)醋酸酯加氢制乙醇是一个乙酰基产物制备乙醇的路线,历程一般认为可分为如下步骤(*代表催化剂位点,已知: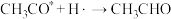 );
);
a.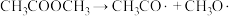 b.
b.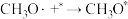 (快)
(快)
c. (慢) d.
(慢) d.
e. ……
……
其中,在b和c的步骤中,活化能较小的是________ (填标号,下同),控制总反应速率的步骤是_________ ,分析上述步骤,副产物除 外,还可能有
外,还可能有________ (写一种即可,合理即可)。
(4)甲醇也是新能源的重要组成部分。以 、
、 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:
iv.
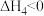
v.

vi.
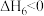
在不同压强下、按照 进行投料,在容器中发生上述3个反应,平衡时,CO和
进行投料,在容器中发生上述3个反应,平衡时,CO和 在含碳产物(即
在含碳产物(即 和CO)中物质的量分数及
和CO)中物质的量分数及 的转化率α随温度的变化如图,
的转化率α随温度的变化如图,

压强 、
、 、
、 由大到小的顺序为
由大到小的顺序为___________ ,曲线___________ (填“m”或“n”)代表 在含碳产物中物质的量分数,在
在含碳产物中物质的量分数,在 ℃
℃ 下,压强为
下,压强为 时,反应ⅴ的浓度平衡常数
时,反应ⅴ的浓度平衡常数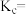
___________ (填含α的表达式)。
(1)


 、
、 、
、 的代数式表示)。
的代数式表示)。已知:
i.
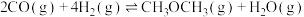

ii.
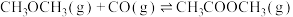

iii.
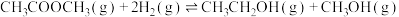

(2)在恒温恒容密闭容器中充入3mol
 和6mol
和6mol 仅发生反应
仅发生反应
 ,下列叙述不正确的是___________(填标号)。
,下列叙述不正确的是___________(填标号)。| A.混合气体总压强不随时间变化时,反应达到平衡状态 |
B.反应达到平衡时, 体积分数可能为33.33% 体积分数可能为33.33% |
C.反应达到平衡后,再同比例充入CO、 ,则CO、 ,则CO、 的平衡转化率不变 的平衡转化率不变 |
| D.反应达到平衡后,再加入高效催化剂,乙醇平衡产率保持不变 |
(3)醋酸酯加氢制乙醇是一个乙酰基产物制备乙醇的路线,历程一般认为可分为如下步骤(*代表催化剂位点,已知:
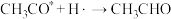 );
);a.
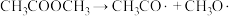 b.
b.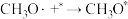 (快)
(快)c.
 (慢) d.
(慢) d.
e.
 ……
……其中,在b和c的步骤中,活化能较小的是
 外,还可能有
外,还可能有(4)甲醇也是新能源的重要组成部分。以
 、
、 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:iv.

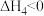
v.


vi.

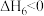
在不同压强下、按照
 进行投料,在容器中发生上述3个反应,平衡时,CO和
进行投料,在容器中发生上述3个反应,平衡时,CO和 在含碳产物(即
在含碳产物(即 和CO)中物质的量分数及
和CO)中物质的量分数及 的转化率α随温度的变化如图,
的转化率α随温度的变化如图,
压强
 、
、 、
、 由大到小的顺序为
由大到小的顺序为 在含碳产物中物质的量分数,在
在含碳产物中物质的量分数,在 ℃
℃ 下,压强为
下,压强为 时,反应ⅴ的浓度平衡常数
时,反应ⅴ的浓度平衡常数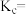
您最近一年使用:0次
2024-01-13更新
|
391次组卷
|
3卷引用:陕西省渭南市2023-2024学年高三上学期教学质量检测化学试卷
陕西省渭南市2023-2024学年高三上学期教学质量检测化学试卷 陕西省渭南市2023-2024学年高三教学质量检测(Ⅰ)化学试题(已下线)专题10 化学反应原理综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
名校
解题方法
2 . 碳达峰是指我国承诺2030年前,二氧化碳的排放不再增长。因此,诸多科学家都在大力研合理利用 和CO以减少碳的排放。
和CO以减少碳的排放。
(1) 可通过以下4种方式转化成有机物,从而有效实现碳循环。
可通过以下4种方式转化成有机物,从而有效实现碳循环。
a.
b.
c.
已知:
以上反应中,最环保节能的是_______ ,原子利用率最高的是_______ 。(填编号)
(2)我国科学家设计出一条仅11步的工业合成路线,实现了 到淀粉的合成。其第一步是把
到淀粉的合成。其第一步是把 还原为甲醇(CH3OH),该方法的化学方程式是:
还原为甲醇(CH3OH),该方法的化学方程式是: 。
。
回答下列问题:
①能说明该反应已达平衡状态的是_______ (填字母)。
A.单位时间内生成 的同时消耗了
的同时消耗了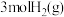
B.在恒温恒容的容器中,混合气体的平均摩尔质量保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,混合气体的密度不再变化
②该反应正逆反应的活化能大小为: (正)
(正)_______  (逆),且该反应在
(逆),且该反应在_______ 自发进行(填“高温”、“低温”“任何温度”或“任何温度都不”)
(3)利用CO高温时与磷石膏(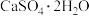 )反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
)反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
①在700℃时,主要的还原产物是一种硫的最低价盐,该物质为_______ 。
②在1150℃时,向盛有足量 的真空恒容密闭容器中充入一定量CO,反应体系起始压强为
的真空恒容密闭容器中充入一定量CO,反应体系起始压强为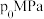 ,主要发生反应:
,主要发生反应: 。该反应达到平衡时,
。该反应达到平衡时,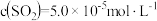 ,CO的转化率为50%,则初始时
,CO的转化率为50%,则初始时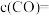
_______ mol/L,该反应的压强平衡常数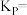
_______ MPa(忽略副反应;气体分压=总压×气体物质的量分数)。
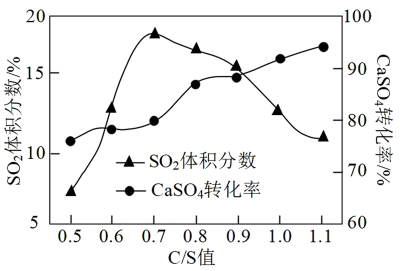
(4)工业上也可用炭粉还原磷石膏,该反应的产物与C/S值(炭粉与 的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、
的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、 和
和 ;当C/S值大于0.7时,反应所得气体中
;当C/S值大于0.7时,反应所得气体中 的体积分数下降,可能的原因是
的体积分数下降,可能的原因是_______ 。

 和CO以减少碳的排放。
和CO以减少碳的排放。(1)
 可通过以下4种方式转化成有机物,从而有效实现碳循环。
可通过以下4种方式转化成有机物,从而有效实现碳循环。a.

b.

c.

已知:

以上反应中,最环保节能的是
(2)我国科学家设计出一条仅11步的工业合成路线,实现了
 到淀粉的合成。其第一步是把
到淀粉的合成。其第一步是把 还原为甲醇(CH3OH),该方法的化学方程式是:
还原为甲醇(CH3OH),该方法的化学方程式是: 。
。回答下列问题:
①能说明该反应已达平衡状态的是
A.单位时间内生成
 的同时消耗了
的同时消耗了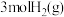
B.在恒温恒容的容器中,混合气体的平均摩尔质量保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,混合气体的密度不再变化
②该反应正逆反应的活化能大小为:
 (正)
(正) (逆),且该反应在
(逆),且该反应在(3)利用CO高温时与磷石膏(
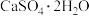 )反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
)反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。①在700℃时,主要的还原产物是一种硫的最低价盐,该物质为
②在1150℃时,向盛有足量
 的真空恒容密闭容器中充入一定量CO,反应体系起始压强为
的真空恒容密闭容器中充入一定量CO,反应体系起始压强为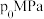 ,主要发生反应:
,主要发生反应: 。该反应达到平衡时,
。该反应达到平衡时,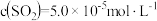 ,CO的转化率为50%,则初始时
,CO的转化率为50%,则初始时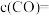
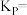
(4)工业上也可用炭粉还原磷石膏,该反应的产物与C/S值(炭粉与
 的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、
的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、 和
和 ;当C/S值大于0.7时,反应所得气体中
;当C/S值大于0.7时,反应所得气体中 的体积分数下降,可能的原因是
的体积分数下降,可能的原因是
您最近一年使用:0次
名校
3 . 碳达峰是指我国承诺2030年前,二氧化碳的排放不再增长。因此,诸多科学家都在大力研合理利用 和CO以减少碳的排放。
和CO以减少碳的排放。
(1) 可通过以下4种方式转化成有机物,从而有效实现碳循环。
可通过以下4种方式转化成有机物,从而有效实现碳循环。
a.
b.
c.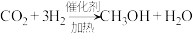
已知: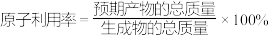
以上反应中,最环保节能的是_______ ,原子利用率最高的是_______ 。(填编号)
(2)我国科学家设计出一条仅11步的工业合成路线,实现了 到淀粉的合成。其第一步是把
到淀粉的合成。其第一步是把 还原为甲醇(
还原为甲醇( ),该方法的化学方程式是:
),该方法的化学方程式是:
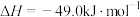 。回答下列问题:
。回答下列问题:
①能说明该反应已达平衡状态的是_______ (填字母)。
A.单位时间内生成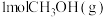 的同时消耗了
的同时消耗了
B.在恒温恒容的容器中,混合气体的平均摩尔质量保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,混合气体的密度不再变化
②该反应正逆反应的活化能大小为:Ea(正)_______ Ea(逆)(填“>”、“=”或“<”)
(3)利用CO高温时与磷石膏(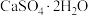 )反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
)反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
①在700℃时,主要的还原产物是一种硫的最低价盐,该物质为_______ (填化学式)。
②在1150℃时,向盛有足量 的真空恒容密闭容器中充入一定量CO,反应体系起始压强为
的真空恒容密闭容器中充入一定量CO,反应体系起始压强为 ,主要发生反应:
,主要发生反应: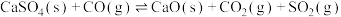 。该反应达到平衡时,
。该反应达到平衡时,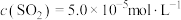 ,CO的转化率为50%,则初始时
,CO的转化率为50%,则初始时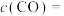
_______ mol/L,该反应的压强平衡常数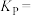
_______ MPa(忽略副反应;气体分压=总压×气体物质的量分数)。
(4)工业上也可用炭粉还原磷石膏,该反应的产物与C/S值(炭粉与 的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、
的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、 和
和 ;当C/S值大于0.7时,反应所得气体中
;当C/S值大于0.7时,反应所得气体中 的体积分数下降,可能的原因是
的体积分数下降,可能的原因是_______ 。
 和CO以减少碳的排放。
和CO以减少碳的排放。(1)
 可通过以下4种方式转化成有机物,从而有效实现碳循环。
可通过以下4种方式转化成有机物,从而有效实现碳循环。a.

b.

c.
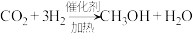
已知:
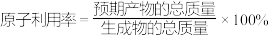
以上反应中,最环保节能的是
(2)我国科学家设计出一条仅11步的工业合成路线,实现了
 到淀粉的合成。其第一步是把
到淀粉的合成。其第一步是把 还原为甲醇(
还原为甲醇( ),该方法的化学方程式是:
),该方法的化学方程式是:
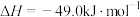 。回答下列问题:
。回答下列问题:①能说明该反应已达平衡状态的是
A.单位时间内生成
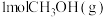 的同时消耗了
的同时消耗了
B.在恒温恒容的容器中,混合气体的平均摩尔质量保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,混合气体的密度不再变化
②该反应正逆反应的活化能大小为:Ea(正)
(3)利用CO高温时与磷石膏(
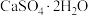 )反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
)反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。①在700℃时,主要的还原产物是一种硫的最低价盐,该物质为
②在1150℃时,向盛有足量
 的真空恒容密闭容器中充入一定量CO,反应体系起始压强为
的真空恒容密闭容器中充入一定量CO,反应体系起始压强为 ,主要发生反应:
,主要发生反应: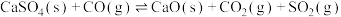 。该反应达到平衡时,
。该反应达到平衡时,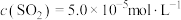 ,CO的转化率为50%,则初始时
,CO的转化率为50%,则初始时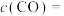
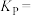
(4)工业上也可用炭粉还原磷石膏,该反应的产物与C/S值(炭粉与
 的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、
的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、 和
和 ;当C/S值大于0.7时,反应所得气体中
;当C/S值大于0.7时,反应所得气体中 的体积分数下降,可能的原因是
的体积分数下降,可能的原因是
您最近一年使用:0次
2022-09-21更新
|
142次组卷
|
2卷引用:重庆市璧山来凤中学校2022-2023学年高二上学期9月月考化学试题
解题方法
4 . 有机物A在标准状况下的密度为1.25g•L-1。以A为原料合成乙酸乙酯的路线如图所示。已知D的分子式为C2H4O2。

请回答下列问题:
(1)A的结构简式为___ ,D中官能团的名称是___ ,反应④的反应类型是___ 。
(2)反应②的化学方程式是__ ,反应⑤的化学方程式是__ 。
(3)某同学用如图所示的装置制取少量乙酸乙酯。实验结束后,试管甲中上层为透明的,不溶于水的油状液体。
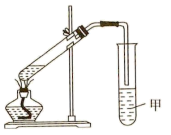
①实验开始前试管甲中的试剂为__ ,导管不能插入试管甲溶液中的原因是___ 。
②用1molB和1molD充分反应,理论上不能生成1mol乙酸乙酯,原因是__ 。

请回答下列问题:
(1)A的结构简式为
(2)反应②的化学方程式是
(3)某同学用如图所示的装置制取少量乙酸乙酯。实验结束后,试管甲中上层为透明的,不溶于水的油状液体。

①实验开始前试管甲中的试剂为
②用1molB和1molD充分反应,理论上不能生成1mol乙酸乙酯,原因是
您最近一年使用:0次
2021-06-19更新
|
256次组卷
|
2卷引用:云南大理部分学校2020-2021学年高一下学期6月份月考化学试题
解题方法
5 . 已知:①A从石油中获得是目前工业上生产的主要途径,A的产量通常用来衡量一个国家的石油化工发展水平;②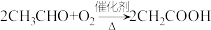 。现以A为主要原料合成乙酸乙酯,合成路线如图。
。现以A为主要原料合成乙酸乙酯,合成路线如图。
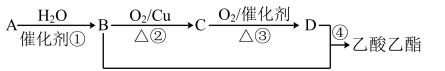
(1)写出A的结构式_______ 。
(2)B、D分子中的官能团名称分别是_______ 、_______ 。
(3)写出下列反应的化学方程式:①_______ ;②_______ ;④_______ ;
(4)下列描述能说明反应④已达到化学平衡状态的有_______ 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②正反应的速率与逆反应的速率相等
③单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
④混合物中各物质的浓度不再变化
⑤单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
(5)反应④制得的乙酸乙酯粗产品中含有少量乙酸、乙醇和水,现拟分离乙酸乙酯、乙酸和乙醇,某小组设计了如下分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。

试剂a是_______ ,试剂b是_______ ;分离方法①③分别是_______ 、_______ 。
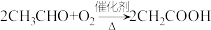 。现以A为主要原料合成乙酸乙酯,合成路线如图。
。现以A为主要原料合成乙酸乙酯,合成路线如图。
(1)写出A的结构式
(2)B、D分子中的官能团名称分别是
(3)写出下列反应的化学方程式:①
(4)下列描述能说明反应④已达到化学平衡状态的有
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②正反应的速率与逆反应的速率相等
③单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
④混合物中各物质的浓度不再变化
⑤单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
(5)反应④制得的乙酸乙酯粗产品中含有少量乙酸、乙醇和水,现拟分离乙酸乙酯、乙酸和乙醇,某小组设计了如下分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。

试剂a是
您最近一年使用:0次
6 . 2022年4月16日,中国空间站的3名航天员乘神舟十三号载人飞船平安返回地球。空间站处理CO2的一种重要方法是对CO2进行收集和再生处理,重新生成可供人体呼吸的氧气。其技术路线可分为以下三步:
Ⅰ.固态胺吸收与浓缩CO2
在水蒸气存在下固态胺吸收CO2反应生成酸式碳酸盐(该反应是放热反应),再解吸出CO2的简单方法是加热。
Ⅱ.CO2的加氢甲烷化
H2还原CO2制CH4的部分反应如下:
i.CO2(g)+H2(g) CO(g)+H2O(g) △H1=+41kJ•mol-1
CO(g)+H2O(g) △H1=+41kJ•mol-1
ii.CO(g)+3H2(g) CH4(g)+H2O(g) △H2=-246kJ•mol-1
CH4(g)+H2O(g) △H2=-246kJ•mol-1
(1)反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的△H=
CH4(g)+2H2O(g)的△H=________ kJ•mol-1。
(2)向恒容绝热的密闭容器中充入amolCO与2amolH2(g),进行反应ii,下列能判断反应已达化学平衡状态的是________
a.容器中混合气体密度不变 b.混合气体中c(CH4)与c(H2O)之比不变
c.v正(H2)=3v逆(H2O) d.容器内温度不变
Ⅲ.CO2和H2合成甲烷也是CO2资源化利用的重要方法。对于上述(1)的反应CO2(g)+4H2(g) CH4(g)+2H2O(g) △H,催化剂的选择是CO2甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如图所示:
CH4(g)+2H2O(g) △H,催化剂的选择是CO2甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如图所示:_______ 。
(4)对比上述两种催化剂的催化性能,工业上应选择的催化剂是_______ ,使用的合适温度为_______ 。
(5)控制起始时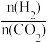 =4,p=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示:
=4,p=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示:________ (填“a”、“b”或“c”);温度低于500℃时,CO的物质的量分数约为0,说明此条件下,反应________ (填“i”或“ii”)化学平衡常数大,反应完全。
②M点(T<500℃)时,平衡分压p(CO2)=________ atm,反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的平衡常数Kp=
CH4(g)+2H2O(g)的平衡常数Kp=________ atm-2(用平衡分压代替平衡浓度计算,分压总压物质的量分数)。
Ⅰ.固态胺吸收与浓缩CO2
在水蒸气存在下固态胺吸收CO2反应生成酸式碳酸盐(该反应是放热反应),再解吸出CO2的简单方法是加热。
Ⅱ.CO2的加氢甲烷化
H2还原CO2制CH4的部分反应如下:
i.CO2(g)+H2(g)
 CO(g)+H2O(g) △H1=+41kJ•mol-1
CO(g)+H2O(g) △H1=+41kJ•mol-1ii.CO(g)+3H2(g)
 CH4(g)+H2O(g) △H2=-246kJ•mol-1
CH4(g)+H2O(g) △H2=-246kJ•mol-1(1)反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g)的△H=
CH4(g)+2H2O(g)的△H=(2)向恒容绝热的密闭容器中充入amolCO与2amolH2(g),进行反应ii,下列能判断反应已达化学平衡状态的是
a.容器中混合气体密度不变 b.混合气体中c(CH4)与c(H2O)之比不变
c.v正(H2)=3v逆(H2O) d.容器内温度不变
Ⅲ.CO2和H2合成甲烷也是CO2资源化利用的重要方法。对于上述(1)的反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g) △H,催化剂的选择是CO2甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如图所示:
CH4(g)+2H2O(g) △H,催化剂的选择是CO2甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如图所示: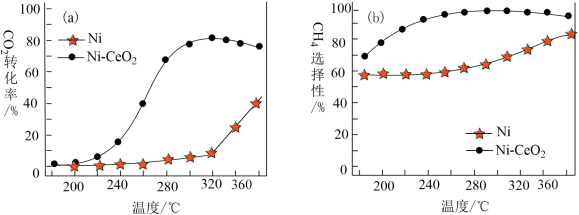
(4)对比上述两种催化剂的催化性能,工业上应选择的催化剂是
(5)控制起始时
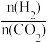 =4,p=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示:
=4,p=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示: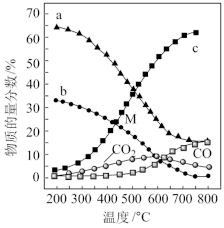
②M点(T<500℃)时,平衡分压p(CO2)=
 CH4(g)+2H2O(g)的平衡常数Kp=
CH4(g)+2H2O(g)的平衡常数Kp=
您最近一年使用:0次
2023-10-26更新
|
721次组卷
|
4卷引用:湖南省郴州市2024届高三上学期一模化学试题
名校
7 . 合成气(CO、 )可由煤、天然气和生物质等非石油路线获得,由合成气制取甲醇发生反应
)可由煤、天然气和生物质等非石油路线获得,由合成气制取甲醇发生反应
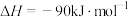 。回答下列问题:
。回答下列问题:
(1)在一恒温恒容的密闭容器中发生反应 ,不能说明该反应达到化学平衡状态的是___________(填字母)。
,不能说明该反应达到化学平衡状态的是___________(填字母)。
(2)用合成气制甲醇的反应为 (假设不发生其他反应)。三个容器中起始时容积相同,维持恒温,控制条件如表:
(假设不发生其他反应)。三个容器中起始时容积相同,维持恒温,控制条件如表:
达到平衡时,三个容器中甲醇的体积分数由大到小的顺序是___________ (填编号)。
(3)另一种合成甲醇方法是将 和
和 在催化剂条件下反应,现在10L恒容密闭容器中投入
在催化剂条件下反应,现在10L恒容密闭容器中投入 和
和 ,发生反应:
,发生反应: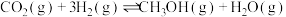 。在不同条件下测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
。在不同条件下测得平衡时甲醇的物质的量随温度、压强的变化如图所示:

①上述反应的
___________ 0(填“>”或“<”),图中压强
___________  (填“>”或“<”)。
(填“>”或“<”)。
②经测定知Q点时容器的压强是反应前压强的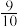 ,则Q点
,则Q点 的转化率为
的转化率为___________ (计算结果保留三位有效数字)。
③N点时,该反应的平衡常数K=___________ (计算结果用分数表示)。
 )可由煤、天然气和生物质等非石油路线获得,由合成气制取甲醇发生反应
)可由煤、天然气和生物质等非石油路线获得,由合成气制取甲醇发生反应
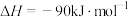 。回答下列问题:
。回答下列问题:(1)在一恒温恒容的密闭容器中发生反应
 ,不能说明该反应达到化学平衡状态的是___________(填字母)。
,不能说明该反应达到化学平衡状态的是___________(填字母)。| A.体系的压强保持不变 | B.混合气体的密度保持不变 |
C.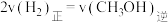 | D. 的浓度保持不变 的浓度保持不变 |
(2)用合成气制甲醇的反应为
 (假设不发生其他反应)。三个容器中起始时容积相同,维持恒温,控制条件如表:
(假设不发生其他反应)。三个容器中起始时容积相同,维持恒温,控制条件如表:| 编号 | 条件控制 | 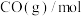 | 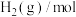 |  |
 | 维持恒容 | 0.2 | 0.4 | 0 |
 | 维持恒容 | 0.4 | 0.8 | 0 |
 | 维持恒压 | 0.4 | 0.8 | 0 |
(3)另一种合成甲醇方法是将
 和
和 在催化剂条件下反应,现在10L恒容密闭容器中投入
在催化剂条件下反应,现在10L恒容密闭容器中投入 和
和 ,发生反应:
,发生反应: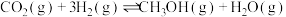 。在不同条件下测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
。在不同条件下测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
①上述反应的


 (填“>”或“<”)。
(填“>”或“<”)。②经测定知Q点时容器的压强是反应前压强的
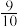 ,则Q点
,则Q点 的转化率为
的转化率为③N点时,该反应的平衡常数K=
您最近一年使用:0次
名校
8 . 我国向国际社会承诺2030年“碳达峰”,2060年实现“碳中和”。研发利用二氧化碳技术,降低空气中二氧化碳含量成为重要的任务。
(1)倡导绿色低碳的生活方式,下列措施与节能减碳矛盾的是_____
(2) 加氢合成
加氢合成 的反应为
的反应为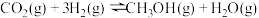 。
。
①下列说法正确的是_____
A.调控反应条件不能改变反应限度
B.投入 和
和 能得到
能得到
C.当 的消耗速率等于其生成速率时,该反应已停止
的消耗速率等于其生成速率时,该反应已停止
D.该反应在一定温度下能自发进行,则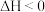
②一般认为,该反应经过如下步骤来实现:
反应Ⅰ: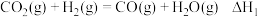 ;
;
反应Ⅱ: 。
。
则总反应的焓变
___________ (用包含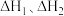 的代数式表示)。若某温度下,反应Ⅰ的平衡常数为
的代数式表示)。若某温度下,反应Ⅰ的平衡常数为 ,反应Ⅱ的平衡常数为
,反应Ⅱ的平衡常数为 ,则总反应的平衡常数
,则总反应的平衡常数
___________ (用包含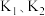 的代数式表示)
的代数式表示)
(3)二氧化碳甲烷化反应合成替代天然气,是利用二氧化碳的技术之一
甲烷化主反应: ;
;
①写出主反应的平衡常数表达式:___________
②某容器中加入一定量的 和
和 ,保持温度和压强不变的情况下,达平衡后再向该容器中注入
,保持温度和压强不变的情况下,达平衡后再向该容器中注入 稀释,主反应的化学平衡将
稀释,主反应的化学平衡将___________ (填“正向移动”、“逆向移动”或“不移动”),达到新平衡后, 的体积分数将
的体积分数将___________ (填“增大”、“减小”或“不变”)
(4) 与
与 是典型的温室气体,
是典型的温室气体, 重整制合成气提供了一条规模化综合利用碳源、氢源并转化温室气体的技术路线:
重整制合成气提供了一条规模化综合利用碳源、氢源并转化温室气体的技术路线: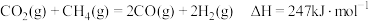
①该反应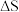
___________ 0(填“>”或“<”)
②有传闻 重整制合成气可以在任何条件下自发进行,你认为此传闻是否正确?
重整制合成气可以在任何条件下自发进行,你认为此传闻是否正确?___________ (填“正确”或“错误”),并写出原因___________ 。
(1)倡导绿色低碳的生活方式,下列措施与节能减碳矛盾的是_____
| A.购物时使用环保袋 | B.就餐时践行光盘行动 |
| C.使用节能灯代替白炽灯 | D.为食品保鲜,冰箱温度越低越好 |
 加氢合成
加氢合成 的反应为
的反应为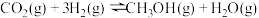 。
。①下列说法正确的是
A.调控反应条件不能改变反应限度
B.投入
 和
和 能得到
能得到
C.当
 的消耗速率等于其生成速率时,该反应已停止
的消耗速率等于其生成速率时,该反应已停止D.该反应在一定温度下能自发进行,则
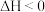
②一般认为,该反应经过如下步骤来实现:
反应Ⅰ:
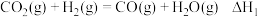 ;
;反应Ⅱ:
 。
。则总反应的焓变

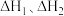 的代数式表示)。若某温度下,反应Ⅰ的平衡常数为
的代数式表示)。若某温度下,反应Ⅰ的平衡常数为 ,反应Ⅱ的平衡常数为
,反应Ⅱ的平衡常数为 ,则总反应的平衡常数
,则总反应的平衡常数
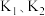 的代数式表示)
的代数式表示)(3)二氧化碳甲烷化反应合成替代天然气,是利用二氧化碳的技术之一
甲烷化主反应:
 ;
;①写出主反应的平衡常数表达式:
②某容器中加入一定量的
 和
和 ,保持温度和压强不变的情况下,达平衡后再向该容器中注入
,保持温度和压强不变的情况下,达平衡后再向该容器中注入 稀释,主反应的化学平衡将
稀释,主反应的化学平衡将 的体积分数将
的体积分数将(4)
 与
与 是典型的温室气体,
是典型的温室气体, 重整制合成气提供了一条规模化综合利用碳源、氢源并转化温室气体的技术路线:
重整制合成气提供了一条规模化综合利用碳源、氢源并转化温室气体的技术路线: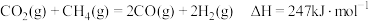
①该反应
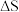
②有传闻
 重整制合成气可以在任何条件下自发进行,你认为此传闻是否正确?
重整制合成气可以在任何条件下自发进行,你认为此传闻是否正确?
您最近一年使用:0次
9 . 近年碳中和理念成为热门,通过“CO2→合成气→高附加值产品”的工艺路
线,可有效实现 CO2的资源化利用。请回答下列问题:
(1)CO2 加氢制合成气(CO、H2)时发生下列反应:
已知:①

②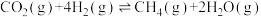

则

_______ 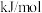
(2)CO2经催化加氢可合成烯烃: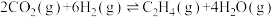
 。在 0.1MPa时,按 n(CO2)∶n(H2)=1∶3 投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
。在 0.1MPa时,按 n(CO2)∶n(H2)=1∶3 投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。

①在一个恒温恒容的密闭容器中,该可逆反应达到平衡的标志是_____ (填字母)。
A.容器内各物质的浓度不随时间变化 B.2v 正(CO2)=3v 逆(H2)
C.容器内压强不随时间变化 D.混合气体的密度不再改变
② 曲线 c 表示的物质为_______ (用化学式表示)。
(3)由CO2与H2反应合成甲醇: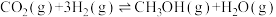
 。某温度下将1mol CO2和3molH2充入体积不变的 2L 密闭容器中,初始总压为 8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:
。某温度下将1mol CO2和3molH2充入体积不变的 2L 密闭容器中,初始总压为 8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:
该条件下的分压平衡常数 Kp= ______ (MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)电催化 CO2 制备燃料可实现资源综合利用。如图所示装置工作时,阴极只生成 HCOOH 时,每转移 2mol 电子,阴极室溶液质量增加_____ g。

线,可有效实现 CO2的资源化利用。请回答下列问题:
(1)CO2 加氢制合成气(CO、H2)时发生下列反应:
已知:①


②
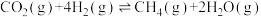

则


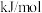
(2)CO2经催化加氢可合成烯烃:
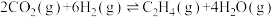
 。在 0.1MPa时,按 n(CO2)∶n(H2)=1∶3 投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
。在 0.1MPa时,按 n(CO2)∶n(H2)=1∶3 投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
①在一个恒温恒容的密闭容器中,该可逆反应达到平衡的标志是
A.容器内各物质的浓度不随时间变化 B.2v 正(CO2)=3v 逆(H2)
C.容器内压强不随时间变化 D.混合气体的密度不再改变
② 曲线 c 表示的物质为
(3)由CO2与H2反应合成甲醇:
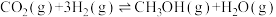
 。某温度下将1mol CO2和3molH2充入体积不变的 2L 密闭容器中,初始总压为 8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:
。某温度下将1mol CO2和3molH2充入体积不变的 2L 密闭容器中,初始总压为 8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:| 时间/h | 1 | 2 | 3 | 4 | 5 |
| p后/p前 | 0.92 | 0.85 | 0.79 | 0.75 | 0.75 |
(4)电催化 CO2 制备燃料可实现资源综合利用。如图所示装置工作时,阴极只生成 HCOOH 时,每转移 2mol 电子,阴极室溶液质量增加

您最近一年使用:0次
名校
10 . 空间站处理 的一种重要方法是对
的一种重要方法是对 进行收集和再生处理,重新生成可供人体呼吸的氧气。其技术路线可分为以下三步:
进行收集和再生处理,重新生成可供人体呼吸的氧气。其技术路线可分为以下三步:
Ⅰ.固态胺吸收与浓缩
在水蒸气存在下固态胺吸收 反应生成酸式碳酸盐(该反应是放热反应),再解吸出
反应生成酸式碳酸盐(该反应是放热反应),再解吸出 的简单方法是加热。
的简单方法是加热。
Ⅱ. 的加氢甲烷化
的加氢甲烷化
 还原
还原 制
制 的部分反应如下:
的部分反应如下:
i.CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g) 
ii.CO(g)+3H2 CH4(g)+H2O(g)
CH4(g)+H2O(g) 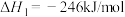
(1)反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的
CH4(g)+2H2O(g)的
___________ 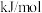 。
。
(2)向恒容绝热的密闭容器中充入amolCO与2amolH2,进行反应ii,下列能判断反应已达化学平衡状态的是___________ ;
a.容器中混合气体密度不变 b.混合气体中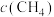 与
与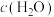 之比不变
之比不变
c.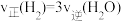 d.容器内温度不变
d.容器内温度不变
Ⅲ.和 合成甲烷也是资源化利用的重要方法。对于上述(1)的反应
合成甲烷也是资源化利用的重要方法。对于上述(1)的反应 ,催化剂的选择是甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得转化率和生成
,催化剂的选择是甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得转化率和生成 选择性随温度变化的影响如下图所示:
选择性随温度变化的影响如下图所示: 转化率仍在上升,其原因是
转化率仍在上升,其原因是___________ 。
(4)对比上述两种催化剂的催化性能,工业上应选择的催化剂是___________ ,使用的合适温度为___________ 。
(5)控制起始时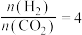 ,P=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示:
,P=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示:___________ (填增大,减小或者不变)。
②图中代表 的曲线是
的曲线是___________ (填“a”、“b”或“c”);温度低于500℃时,CO的物质的量分数约为0,说明此条件下,反应___________ (填“i”或“ii”)化学平衡常数大,反应完全。
③反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的平衡常数
CH4(g)+2H2O(g)的平衡常数
___________  (用平衡分压代替平衡浓度计算,分压总压物质的量分数)。
(用平衡分压代替平衡浓度计算,分压总压物质的量分数)。
 的一种重要方法是对
的一种重要方法是对 进行收集和再生处理,重新生成可供人体呼吸的氧气。其技术路线可分为以下三步:
进行收集和再生处理,重新生成可供人体呼吸的氧气。其技术路线可分为以下三步:Ⅰ.固态胺吸收与浓缩

在水蒸气存在下固态胺吸收
 反应生成酸式碳酸盐(该反应是放热反应),再解吸出
反应生成酸式碳酸盐(该反应是放热反应),再解吸出 的简单方法是加热。
的简单方法是加热。Ⅱ.
 的加氢甲烷化
的加氢甲烷化 还原
还原 制
制 的部分反应如下:
的部分反应如下:i.CO2(g)+H2(g)
 CO(g)+H2O(g)
CO(g)+H2O(g) 
ii.CO(g)+3H2
 CH4(g)+H2O(g)
CH4(g)+H2O(g) 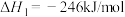
(1)反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g)的
CH4(g)+2H2O(g)的
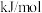 。
。(2)向恒容绝热的密闭容器中充入amolCO与2amolH2,进行反应ii,下列能判断反应已达化学平衡状态的是
a.容器中混合气体密度不变 b.混合气体中
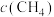 与
与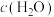 之比不变
之比不变c.
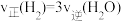 d.容器内温度不变
d.容器内温度不变Ⅲ.和
 合成甲烷也是资源化利用的重要方法。对于上述(1)的反应
合成甲烷也是资源化利用的重要方法。对于上述(1)的反应 ,催化剂的选择是甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得转化率和生成
,催化剂的选择是甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得转化率和生成 选择性随温度变化的影响如下图所示:
选择性随温度变化的影响如下图所示: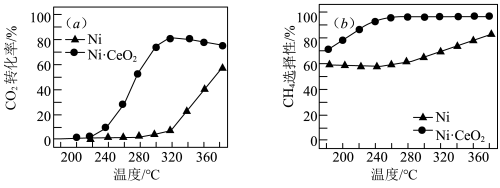
 转化率仍在上升,其原因是
转化率仍在上升,其原因是(4)对比上述两种催化剂的催化性能,工业上应选择的催化剂是
(5)控制起始时
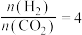 ,P=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示:
,P=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示: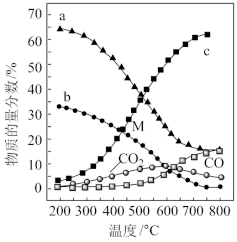
②图中代表
 的曲线是
的曲线是③反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g)的平衡常数
CH4(g)+2H2O(g)的平衡常数
 (用平衡分压代替平衡浓度计算,分压总压物质的量分数)。
(用平衡分压代替平衡浓度计算,分压总压物质的量分数)。
您最近一年使用:0次
2024-05-05更新
|
488次组卷
|
4卷引用:宁夏石嘴山市光明中学2024届高三第一次模拟考试理综化学试题
宁夏石嘴山市光明中学2024届高三第一次模拟考试理综化学试题(已下线)题型11 反应原理综合题(25题)-2024年高考化学常考点必杀300题(新高考通用)(已下线)提升练09 化学反应原理综合-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)湖南省衡阳市衡阳县第一中学2023-2024学年高三下学期4月月考化学试题



