解题方法
1 . 已知:①A从石油中获得是目前工业上生产的主要途径,A的产量通常用来衡量一个国家的石油化工发展水平;②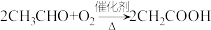 。现以A为主要原料合成乙酸乙酯,合成路线如图。
。现以A为主要原料合成乙酸乙酯,合成路线如图。
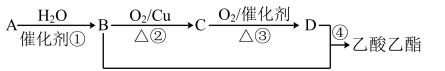
(1)写出A的结构式_______ 。
(2)B、D分子中的官能团名称分别是_______ 、_______ 。
(3)写出下列反应的化学方程式:①_______ ;②_______ ;④_______ ;
(4)下列描述能说明反应④已达到化学平衡状态的有_______ 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②正反应的速率与逆反应的速率相等
③单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
④混合物中各物质的浓度不再变化
⑤单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
(5)反应④制得的乙酸乙酯粗产品中含有少量乙酸、乙醇和水,现拟分离乙酸乙酯、乙酸和乙醇,某小组设计了如下分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。

试剂a是_______ ,试剂b是_______ ;分离方法①③分别是_______ 、_______ 。
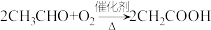 。现以A为主要原料合成乙酸乙酯,合成路线如图。
。现以A为主要原料合成乙酸乙酯,合成路线如图。
(1)写出A的结构式
(2)B、D分子中的官能团名称分别是
(3)写出下列反应的化学方程式:①
(4)下列描述能说明反应④已达到化学平衡状态的有
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②正反应的速率与逆反应的速率相等
③单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
④混合物中各物质的浓度不再变化
⑤单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
(5)反应④制得的乙酸乙酯粗产品中含有少量乙酸、乙醇和水,现拟分离乙酸乙酯、乙酸和乙醇,某小组设计了如下分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。

试剂a是
您最近一年使用:0次
名校
解题方法
2 . 如图是乙酸乙酯的绿色合成路线之一:
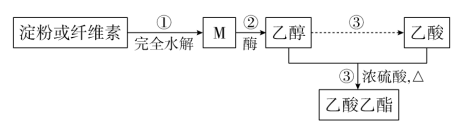
(1)M的分子式为__ 。
(2)下列说法不正确的是__ (填字母序号)。
A.淀粉和纤维素都属于天然高分子化合物
B.M可与新制的氢氧化铜悬浊液在加热条件下生成砖红色沉淀
C.所有的糖类都有甜味,都可以发生水解反应
D.用饱和碳酸钠溶液可以鉴别乙醇、乙酸和乙酸乙酯
(3)乙醇分子结构中的化学键如图所示:
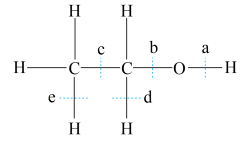
①乙醇与乙酸反应时,断裂的化学键是__ (填字母序号),乙醇在铜作催化剂时与氧气反应,断裂的化学键是__ (填字母序号),反应的化学方程式为__ 。
(4)乙醇和乙酸在一定条件下制备乙酸乙酯。
①乙酸中官能团的名称是_ 。
②生成乙酸乙酯的反应是可逆反应,下列能说明该反应已达到化学平衡状态的是_ (填序号)。
A.单位时间里,生成1mol乙酸乙酯,同时生成1mol水
B.单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
C.单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
D.正反应的速率与逆反应的速率相等
E.混合物中各物质的物质的量相等
(5)乙酸乙酯和丁酸互为同分异构体,丁酸有__ 种结构。

(1)M的分子式为
(2)下列说法不正确的是
A.淀粉和纤维素都属于天然高分子化合物
B.M可与新制的氢氧化铜悬浊液在加热条件下生成砖红色沉淀
C.所有的糖类都有甜味,都可以发生水解反应
D.用饱和碳酸钠溶液可以鉴别乙醇、乙酸和乙酸乙酯
(3)乙醇分子结构中的化学键如图所示:

①乙醇与乙酸反应时,断裂的化学键是
(4)乙醇和乙酸在一定条件下制备乙酸乙酯。
①乙酸中官能团的名称是
②生成乙酸乙酯的反应是可逆反应,下列能说明该反应已达到化学平衡状态的是
A.单位时间里,生成1mol乙酸乙酯,同时生成1mol水
B.单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
C.单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
D.正反应的速率与逆反应的速率相等
E.混合物中各物质的物质的量相等
(5)乙酸乙酯和丁酸互为同分异构体,丁酸有
您最近一年使用:0次
2020-05-11更新
|
1462次组卷
|
3卷引用:辽宁省沈阳铁路实验中学2019-2020学年高一下学期期中考试化学试题
3 . 二氧化碳的回收利用是环保领域研究的热点课题。
(1)以CO2与NH3为原料合成尿素[CO(NH2)2]的技术已十分成熟。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-159.47 kJ•mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l)△H=+28.49kJ•mol-1
③H2O(g)=H2O(l)△H=-88.0kJ•mol-1
则NH3和CO2合成尿素和气态水的热化学方程式为___ 。
(2)已知:工业上在120℃条件下利用NH3和CO2合成尿素。在恒温恒容条件下,下列能说明合成尿素反应达平衡的是___
A.NH3和CO2的比例保持不变
B.混合气体的压强不再发生变化
C.2v(NH3)(正)=v(CO2)(逆)
D.混合气体的密度不再改变
(3)氨碳比[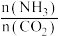 ]对合成尿素有重要影响。恒温恒容条件下,在一个2L的密闭容器中将总物质的量为nmol的NH3和CO2以不同的氨碳比进行反应,NH3的转化率变化如图所示;当[
]对合成尿素有重要影响。恒温恒容条件下,在一个2L的密闭容器中将总物质的量为nmol的NH3和CO2以不同的氨碳比进行反应,NH3的转化率变化如图所示;当[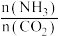 ]=2时,平衡时测得尿素的物质的量为1mol,则n=
]=2时,平衡时测得尿素的物质的量为1mol,则n=___ 。此温度下该反应的化学平衡常数K=___ 。

(4)研究人员设计出一种新型太阳能电池,能直接把CO2和H2O转化为CO、H2和O2,原理如图所示,该装置中能量转化方式为___ ,催化剂b表面的电极反应式为___ 。

(1)以CO2与NH3为原料合成尿素[CO(NH2)2]的技术已十分成熟。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-159.47 kJ•mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l)△H=+28.49kJ•mol-1
③H2O(g)=H2O(l)△H=-88.0kJ•mol-1
则NH3和CO2合成尿素和气态水的热化学方程式为
(2)已知:工业上在120℃条件下利用NH3和CO2合成尿素。在恒温恒容条件下,下列能说明合成尿素反应达平衡的是
A.NH3和CO2的比例保持不变
B.混合气体的压强不再发生变化
C.2v(NH3)(正)=v(CO2)(逆)
D.混合气体的密度不再改变
(3)氨碳比[
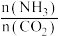 ]对合成尿素有重要影响。恒温恒容条件下,在一个2L的密闭容器中将总物质的量为nmol的NH3和CO2以不同的氨碳比进行反应,NH3的转化率变化如图所示;当[
]对合成尿素有重要影响。恒温恒容条件下,在一个2L的密闭容器中将总物质的量为nmol的NH3和CO2以不同的氨碳比进行反应,NH3的转化率变化如图所示;当[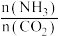 ]=2时,平衡时测得尿素的物质的量为1mol,则n=
]=2时,平衡时测得尿素的物质的量为1mol,则n=
(4)研究人员设计出一种新型太阳能电池,能直接把CO2和H2O转化为CO、H2和O2,原理如图所示,该装置中能量转化方式为

您最近一年使用:0次
4 . I:运用化学反应原理知识研究如何利用CO、SO2等污染物有非常重要的意义。
(1)用CO可以合成甲醇。
已知: CH3OH(g)+3/2 O2(g)=CO2(g)+2H2O(l) △H1
CO(g)+1/2O2(g)=CO2(g) △H2
H2(g)+1/2O2(g)=H2O(l) △H3
请写出由CO和H2形成CH3OH的热化学方程式___________________________________________
(2)—定压强下,在容积为2L的密闭容器中充入1mol CO与2mol H2,在催化剂作用下发生反应:
CO(g) +2H2(g) CH3OH(g) △H,CO转化率与温度、压强的关系如图所示:
CH3OH(g) △H,CO转化率与温度、压强的关系如图所示:

①下列说法正确的是__________
A.若容器内气体密度恒定,反应达到平衡状态
B.若容器内各气体平均相对分子质量恒定,反应达到平衡状态
C.若v(CO)=v(CH3OH)时,反应达到平衡状态
D.反应中,催化剂使平衡向正反应方向移动
②该反应的△H________ 0,p2_______________ p1(填“大于”“小于”或“等于”)。
③100℃时,该反应的化学平衡常数K=__________ .

II:甲醇是一种燃料,也可以作为燃料电池的原料
(3)甲醇直接燃烧会产生一定的污染,某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置,则电池正极的电极反应式:______ ,该电池工作时,溶液中的OH-向______ 极移动,该电池工作一段时间后,测得溶液的pH减小,则该电池总反应的离子方程式为_______________________________________ ;
(1)用CO可以合成甲醇。
已知: CH3OH(g)+3/2 O2(g)=CO2(g)+2H2O(l) △H1
CO(g)+1/2O2(g)=CO2(g) △H2
H2(g)+1/2O2(g)=H2O(l) △H3
请写出由CO和H2形成CH3OH的热化学方程式
(2)—定压强下,在容积为2L的密闭容器中充入1mol CO与2mol H2,在催化剂作用下发生反应:
CO(g) +2H2(g)
 CH3OH(g) △H,CO转化率与温度、压强的关系如图所示:
CH3OH(g) △H,CO转化率与温度、压强的关系如图所示:
①下列说法正确的是
A.若容器内气体密度恒定,反应达到平衡状态
B.若容器内各气体平均相对分子质量恒定,反应达到平衡状态
C.若v(CO)=v(CH3OH)时,反应达到平衡状态
D.反应中,催化剂使平衡向正反应方向移动
②该反应的△H
③100℃时,该反应的化学平衡常数K=

II:甲醇是一种燃料,也可以作为燃料电池的原料
(3)甲醇直接燃烧会产生一定的污染,某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置,则电池正极的电极反应式:
您最近一年使用:0次
名校
5 . (1)2017年中科院某研究团队通过设计一种新型Na-Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
已知:H2(g)+1/2O2(g)=H2O(l) ΔH1 = -aKJ/mol
C8H18(1 )+25/2O2(g)=8CO2(g)+9H2O(1) ΔH2= -bKJ/mol
)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH2= -bKJ/mol
试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式_________________________________ 。
(2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有:
甲:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
乙:CO2(g)+H2(g) CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
①CO(g)+2H2(g) CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=______ (用含K1、K2的表达式表示),该反应△H_____ 0(填“大于”或“小于”)。
②提高CO2转化为CH3OH平衡转化率的措施有___________ (填写两项)。
③催化剂和反应体系的关系就像锁和钥匙的关系一样,具有高度的选择性。下列四组实验,控制CO2和H2初始投料比均为1:2.2,经过相同反应时间(t1min)。
由表格中的数据可知,相同温度下不同的催化剂对CO2的转化为CH3OH的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为___________ (填字母符号)。
(3)以CO、H2为原料合成 甲醇的反应为:CO(g)+2H2(g)
甲醇的反应为:CO(g)+2H2(g) CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
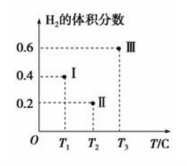
①0~5min时间内容器Ⅱ中用CH3OH表示的化学反应速率为_________________ 。
②三个容器中一定达到平衡状态的是容器________ (填写容器代号)。
已知:H2(g)+1/2O2(g)=H2O(l) ΔH1 = -aKJ/mol
C8H18(1
 )+25/2O2(g)=8CO2(g)+9H2O(1) ΔH2= -bKJ/mol
)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH2= -bKJ/mol试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式
(2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有:
甲:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1乙:CO2(g)+H2(g)
 CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2①CO(g)+2H2(g)
 CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=②提高CO2转化为CH3OH平衡转化率的措施有
③催化剂和反应体系的关系就像锁和钥匙的关系一样,具有高度的选择性。下列四组实验,控制CO2和H2初始投料比均为1:2.2,经过相同反应时间(t1min)。
| 温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) | 综合选项 |
| 543 | Cu/ZnO纳米棒材料 | 12.3 | 42.3 | A |
| 543 | Cu/ZnO纳米片材料 | 11.9 | 72.7 | B |
| 553 | Cu/ZnO纳米棒材料 | 15.3 | 39.1 | C |
| 553 | Cu/ZnO纳米片材料 | 12.0 | 70.6 | D |
由表格中的数据可知,相同温度下不同的催化剂对CO2的转化为CH3OH的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为
(3)以CO、H2为原料合成
 甲醇的反应为:CO(g)+2H2(g)
甲醇的反应为:CO(g)+2H2(g) CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
①0~5min时间内容器Ⅱ中用CH3OH表示的化学反应速率为
②三个容器中一定达到平衡状态的是容器
您最近一年使用:0次
2018-08-09更新
|
1196次组卷
|
8卷引用:【全国校级联考】山东省七校联合体2018届高三第二次联考理科综合化学试题
解题方法
6 . Ⅰ.砷(As)是第四周期VA族元素,可以形成As2O3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图______________ 。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________________________________ 。
(3)298K时,将20mL3×mol·L-1Na3AsO3、20mL3×mol·L-1I2和20ml NaOH溶液混合,发生反应: 。溶液中
。溶液中 与反应时间(t)的关系如图所示。
与反应时间(t)的关系如图所示。

①下列可判断反应达到平衡的是________ (填标号)。
a.溶液的pH不再变化
b.v(I-)=2v(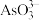 )
)
C. /
/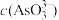 不再变化
不再变化
d.c(I-)=2ymol·L-1
②tm时,V正________ V逆(填“大于”“小于”或“等于”)。
③tm时V逆________ tm时V逆(填“大于”“小于”或“等于”),理由是____________________________ 。
Ⅱ.碳是重要的短周期元素,可以形成CO、CO2、CH3OH(甲醇)等化合物。
(4)以CO或CO2与H2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:(用化学反应方程式表示)________ 。
(5)如图所示是用于合成甲醇产品中甲醇含量的检测仪。
写出该仪器工作时的总反应式及正极反应式:
总反应式__________________________
正极反应式__________________________

(1)画出砷的原子结构示意图
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式
(3)298K时,将20mL3×mol·L-1Na3AsO3、20mL3×mol·L-1I2和20ml NaOH溶液混合,发生反应:
 。溶液中
。溶液中 与反应时间(t)的关系如图所示。
与反应时间(t)的关系如图所示。
①下列可判断反应达到平衡的是
a.溶液的pH不再变化
b.v(I-)=2v(
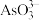 )
)C.
 /
/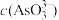 不再变化
不再变化d.c(I-)=2ymol·L-1
②tm时,V正
③tm时V逆
Ⅱ.碳是重要的短周期元素,可以形成CO、CO2、CH3OH(甲醇)等化合物。
(4)以CO或CO2与H2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:(用化学反应方程式表示)
(5)如图所示是用于合成甲醇产品中甲醇含量的检测仪。
写出该仪器工作时的总反应式及正极反应式:
总反应式
正极反应式

您最近一年使用:0次
7 . 甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,二氧化碳加氢合成甲醇是合理利用二氧化碳的有效途径。由二氧化碳制备甲醇过程中可能涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.58KJ/mol
CH3OH(g)+H2O(g) △H1=-49.58KJ/mol
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g) CH3OH(g) △H3=-90.77KJ/mol
CH3OH(g) △H3=-90.77KJ/mol
回答下列问题:
(1)反应Ⅱ的△H2=__________ ,反应Ⅲ自发进行条件是__________ (填“较低温”、“较高温”或“任意温度”)。
(2)在一定条件下3L恒容密闭容器中,充入一定量的H2和CO2仅发生反应Ⅰ,实验测得反应物在不同起始投入量下,体系中二氧化碳的平衡转化率与温度的关系曲线,如图1所示。

①氢气和二氧化碳的起始投入量以A和B两种方式投入:
A:n(H2)=3mol n(CO2)=1.5mol
B:n(H2)=3mol n(CO2)=2mol,
曲线Ⅰ代表哪种投入方式__________ (用A、B表示)
②在温度为500K的条件下,按照A方式充入3mol氢气和1.5mol二氧化碳,该反应10min后达到平衡:此温度下的平衡常数为__________ ;500K时,若在此容器中开始充入0.3mol氢气和0.9mol二氧化碳、0.6mol甲醇、xmol水蒸气,若使反应在开始时正向进行,则 x 应满足的条件是__________ 。
(3)在恒温恒压密闭容器中,充入一定量的H2和CO2(假定仅发生反应I),反应过程中,能判断反应I已达到平衡状态的标志是_________
A.断裂3molH-H键,同时有3molH-O键形成
B.容器内的压强保持不变
C.容器中气体的平均摩尔质量不变
D.容器中气体的密度保持不变
(4)以甲醇、氧气为原料,100mL 0.15mol/LNaOH溶液为电解质设计成燃料电池,若放电时参与反应的氧气体积为336mL(标况)产生的气体全部被NaOH溶液吸收,则所得溶液中溶质的成分及物质的量之比为__________ ,溶液中各离子浓度由大到小的顺序___________________________ 。
反应Ⅰ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49.58KJ/mol
CH3OH(g)+H2O(g) △H1=-49.58KJ/mol反应Ⅱ:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2反应Ⅲ:CO(g)+2H2(g)
 CH3OH(g) △H3=-90.77KJ/mol
CH3OH(g) △H3=-90.77KJ/mol回答下列问题:
(1)反应Ⅱ的△H2=
(2)在一定条件下3L恒容密闭容器中,充入一定量的H2和CO2仅发生反应Ⅰ,实验测得反应物在不同起始投入量下,体系中二氧化碳的平衡转化率与温度的关系曲线,如图1所示。

①氢气和二氧化碳的起始投入量以A和B两种方式投入:
A:n(H2)=3mol n(CO2)=1.5mol
B:n(H2)=3mol n(CO2)=2mol,
曲线Ⅰ代表哪种投入方式
②在温度为500K的条件下,按照A方式充入3mol氢气和1.5mol二氧化碳,该反应10min后达到平衡:此温度下的平衡常数为
(3)在恒温恒压密闭容器中,充入一定量的H2和CO2(假定仅发生反应I),反应过程中,能判断反应I已达到平衡状态的标志是
A.断裂3molH-H键,同时有3molH-O键形成
B.容器内的压强保持不变
C.容器中气体的平均摩尔质量不变
D.容器中气体的密度保持不变
(4)以甲醇、氧气为原料,100mL 0.15mol/LNaOH溶液为电解质设计成燃料电池,若放电时参与反应的氧气体积为336mL(标况)产生的气体全部被NaOH溶液吸收,则所得溶液中溶质的成分及物质的量之比为
您最近一年使用:0次
8 . 合成气(CO+H2)是制备合成油和烯烃等众多化工产品的枢纽原料,而催化甲烷部分氧化是生产合成气的主要工艺之一,涉及的反应为:
①2CH4(g)+O2(g) 2CO(g)+4H2(g) △H
2CO(g)+4H2(g) △H
已知如下反应:
②CH4(g)+2O2(g) CO2(g)+2H2O(g) △H1=-810kJ/mol
CO2(g)+2H2O(g) △H1=-810kJ/mol
③CH4(g)+H2O(g) CO(g)+3H2(g) △H2=+225kJ/mol
CO(g)+3H2(g) △H2=+225kJ/mol
④CO(g)+H2O(g) CO2(g)+H2(g) △H3=-35kJ/mol
CO2(g)+H2(g) △H3=-35kJ/mol
请回答下列问题:
(1)试计算反应①的△H=___ 。
(2)在某体积固定的绝热密闭容器中发生反应④,下列事实能证明反应已达平衡的是___ 。
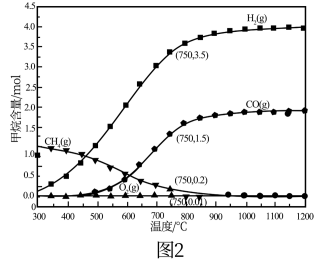
(3)在某恒容密闭容器中加入一定量的甲烷和氧气发生反应③,使其充分反应,测得不同温度和压强下甲烷的转化率如图1所示,由该图可得出的结论是___ 。

(4)现将2molCH4和1molO2加入某体积可变的密闭容器中,发生反应①。控制压强为1atm,测得不同温度下反应体系中各组分平衡含量如图2所示。实际生产中控制的温度为750℃,则此温度下CO的产率为___ ,若平衡时容器的体积为VL,则该反应的平衡常数K=___ 。(用含V代数式表示,不必化简)。
①2CH4(g)+O2(g)
 2CO(g)+4H2(g) △H
2CO(g)+4H2(g) △H已知如下反应:
②CH4(g)+2O2(g)
 CO2(g)+2H2O(g) △H1=-810kJ/mol
CO2(g)+2H2O(g) △H1=-810kJ/mol③CH4(g)+H2O(g)
 CO(g)+3H2(g) △H2=+225kJ/mol
CO(g)+3H2(g) △H2=+225kJ/mol④CO(g)+H2O(g)
 CO2(g)+H2(g) △H3=-35kJ/mol
CO2(g)+H2(g) △H3=-35kJ/mol请回答下列问题:
(1)试计算反应①的△H=
(2)在某体积固定的绝热密闭容器中发生反应④,下列事实能证明反应已达平衡的是
| A.容器内温度不再变化 | B.混合气体的平均分子量不再变化 |
| C.各组分的物质的量相等 | D.1molH—O键断裂同时有1molH—H键断裂 |

(4)现将2molCH4和1molO2加入某体积可变的密闭容器中,发生反应①。控制压强为1atm,测得不同温度下反应体系中各组分平衡含量如图2所示。实际生产中控制的温度为750℃,则此温度下CO的产率为

您最近一年使用:0次
解题方法
9 . 利用太阳能、风能、生物质能等可再生能源,转化利用二氧化碳设计出适合高效清洁的合成燃料分子结构,实现CO2+H2O→CxHy的分子转化,生产合成甲烷、醇醚燃料、烷烃柴油、航空燃油等可再生合成燃料。因此二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)一定条件下,在CO2与足量碳反应所得平衡体系中加入H2和适当催化剂,有下列反应发生:
CO(g)+3H2(g) CH4(g)+H2O(g) △H1=-206.2kJ/mol
CH4(g)+H2O(g) △H1=-206.2kJ/mol
CO(g)+H2O(g) CO2(g)+H2(g) ∆H2
CO2(g)+H2(g) ∆H2
若CO2氧化H2生成0.1molCH4(g)和一定量的H2O(g),整个过程中放出的热量为16.5kJ,则△H2=__ 。
(2)合成二甲醚的总反应为2CO2(g)+6H2(g)
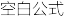 CH3OCH3(g)+3H2O(g) ∆H=-122.4kJ·mol-1。某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,则p1
CH3OCH3(g)+3H2O(g) ∆H=-122.4kJ·mol-1。某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,则p1__ (填“>”“<"或“=”,下同)p2。若T3、p3,T4、p4时平衡常数分别为K3、K4则K3__ K4,T1、p1时H2的平衡转化率为___ 。(结果保留三位有效数字)

(3)向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂作用下,下列反应能自发进行:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
①该反应△H__ (填“>”“<”或“=”)0。
②下列叙述能说明此反应达到平衡状态的是__ (填字母代号)。
a.混合气体的平均相对分子质量保持不变
b.1molCO2生成的同时有3molH-H键断裂
c.CO2的转化率和H2的转化率相等
d.混合气体的密度保持不变
③上述反应常用CuO和ZnO的混合物作催化剂。相同的温度和时间段内,催化剂中CuO的质量分数对CO2的转化率和CH3OH的产率影响的实验数据如下表所示:
由表可知,CuO的质量分数为__ 催化效果最佳。
(4)CO2可用于工业制备草酸锌,其原理如图所示(电解液不参加反应),Zn电极是__ 极。已知在Pb电极区得到ZnC2O4,则Pb电极上的电极反应式为__ 。

(1)一定条件下,在CO2与足量碳反应所得平衡体系中加入H2和适当催化剂,有下列反应发生:
CO(g)+3H2(g)
 CH4(g)+H2O(g) △H1=-206.2kJ/mol
CH4(g)+H2O(g) △H1=-206.2kJ/molCO(g)+H2O(g)
 CO2(g)+H2(g) ∆H2
CO2(g)+H2(g) ∆H2若CO2氧化H2生成0.1molCH4(g)和一定量的H2O(g),整个过程中放出的热量为16.5kJ,则△H2=
(2)合成二甲醚的总反应为2CO2(g)+6H2(g)

 CH3OCH3(g)+3H2O(g) ∆H=-122.4kJ·mol-1。某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,则p1
CH3OCH3(g)+3H2O(g) ∆H=-122.4kJ·mol-1。某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,则p1
(3)向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂作用下,下列反应能自发进行:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。①该反应△H
②下列叙述能说明此反应达到平衡状态的是
a.混合气体的平均相对分子质量保持不变
b.1molCO2生成的同时有3molH-H键断裂
c.CO2的转化率和H2的转化率相等
d.混合气体的密度保持不变
③上述反应常用CuO和ZnO的混合物作催化剂。相同的温度和时间段内,催化剂中CuO的质量分数对CO2的转化率和CH3OH的产率影响的实验数据如下表所示:
| ω(CuO)% | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
| CH3OH的产率 | 25% | 30% | 35% | 45% | 50% | 65% | 55% | 53% | 50% |
| CO2的转化率 | 10% | 13% | 15% | 20% | 35% | 45% | 40% | 35% | 30% |
(4)CO2可用于工业制备草酸锌,其原理如图所示(电解液不参加反应),Zn电极是

您最近一年使用:0次
名校
解题方法
10 . 甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样。一定条件下,在体积为 的密闭容器中,充入
的密闭容器中,充入 和
和 ,发生反应:
,发生反应: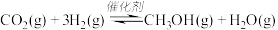 ,测得
,测得 的物质的量随时间变化如表所示,该反应的能量变化如图所示:
的物质的量随时间变化如表所示,该反应的能量变化如图所示:

(1)该反应为_____ (填放热或吸热)反应。
(2)从反应开始到5min末,用氢气浓度变化表示的平均反应速率v(H2)=___ ,容器内平衡时与起始时的压强之比为____ 。
(3)在相同温度容积不变的条件下,能说明该反应已达平衡状态的是____ (填写序号字母)。
a.容器内的平均相对分子质量保持不变 b.容器内压强保持不变
c. 的消耗速率与
的消耗速率与 的生成速率之比为3:1 d.
的生成速率之比为3:1 d.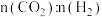 的比值保持不变
的比值保持不变
(4)将 设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。实验测得电池工作时OHˉ向B电极定向移动,则
设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。实验测得电池工作时OHˉ向B电极定向移动,则_____ (填“A”或“B”)处电极入口通甲醇,当电路中通过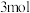 电子时,理论上消耗
电子时,理论上消耗 质量为
质量为_____ 克。
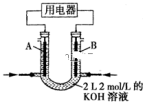
(5)下列化学电池不易造成环境污染的是____ (填字母)。
A.甲醇氧气燃料电池 B.锌锰电池 C.镍镉电池 D.铅蓄电池
铅蓄电池是最常见的二次电池,放电时的化学方程式为: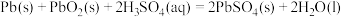 。该蓄电池放电时,正极电极反应方程式为
。该蓄电池放电时,正极电极反应方程式为__________ 。
 的密闭容器中,充入
的密闭容器中,充入 和
和 ,发生反应:
,发生反应: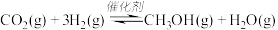 ,测得
,测得 的物质的量随时间变化如表所示,该反应的能量变化如图所示:
的物质的量随时间变化如表所示,该反应的能量变化如图所示:
 | 0 | 2 | 5 | 10 | 15 |
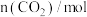 | 2 | 0.75 | 0.5 | 0.25 | 0.25 |
(1)该反应为
(2)从反应开始到5min末,用氢气浓度变化表示的平均反应速率v(H2)=
(3)在相同温度容积不变的条件下,能说明该反应已达平衡状态的是
a.容器内的平均相对分子质量保持不变 b.容器内压强保持不变
c.
 的消耗速率与
的消耗速率与 的生成速率之比为3:1 d.
的生成速率之比为3:1 d.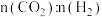 的比值保持不变
的比值保持不变(4)将
 设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。实验测得电池工作时OHˉ向B电极定向移动,则
设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。实验测得电池工作时OHˉ向B电极定向移动,则 电子时,理论上消耗
电子时,理论上消耗 质量为
质量为
(5)下列化学电池不易造成环境污染的是
A.甲醇氧气燃料电池 B.锌锰电池 C.镍镉电池 D.铅蓄电池
铅蓄电池是最常见的二次电池,放电时的化学方程式为:
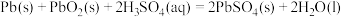 。该蓄电池放电时,正极电极反应方程式为
。该蓄电池放电时,正极电极反应方程式为
您最近一年使用:0次
2020-07-29更新
|
141次组卷
|
3卷引用:江西省萍乡市2019-2020学年高一下学期期末考试化学试题



