1 . [化学——选修2:化学与技术]
硫酸是工业生产中重要的产品之一,在很多领域都有重要用途。回答下列问题:
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为 1 ;该反应在 2 (填设备名称)中进行。
(2)为了有利于SO2转化为SO3,且能充分利用热能,可采用在有多层催化剂且有热交换器的 3 (填设备名称)中进行反应。在如图所示的装置中,C处流出的气体有 4 , 5 (填设备名称)中用 6 吸收,得到浓硫酸或发烟硫酸。
(3)实验测得:SO2生成SO3的转化率与温度、压强的关系如下表所示。已知400~600℃催化剂的催化效果较好,结合生产实际,选择最合适的生产条件是 7 。

(4)欲提高SO2的反应速率和转化率,下列措施可行的是 8 (填选项字母)。
(5)吸收塔排出的尾气中,若SO2的含量超过500 L·L-1,就要加以处理,处理方法之一是用氨水洗涤烟气脱硫,用足量氨水吸收尾气中SO2的化学方程式为
L·L-1,就要加以处理,处理方法之一是用氨水洗涤烟气脱硫,用足量氨水吸收尾气中SO2的化学方程式为 9 。
硫酸是工业生产中重要的产品之一,在很多领域都有重要用途。回答下列问题:
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为
(2)为了有利于SO2转化为SO3,且能充分利用热能,可采用在有多层催化剂且有热交换器的
(3)实验测得:SO2生成SO3的转化率与温度、压强的关系如下表所示。已知400~600℃催化剂的催化效果较好,结合生产实际,选择最合适的生产条件是
 | 1.0×105Pa | 5.0×105Pa | 1.0×106Pa | 1.5×106Pa |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.6975 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9267 | 0.9468 |

(4)欲提高SO2的反应速率和转化率,下列措施可行的是
| A.向装置中通入氮气且保持体积不变 | B.向装置中通入稍过量氧气且保持体积不变 |
| C.添加更多的催化剂 | D.降低温度,及时转移SO3 |
(5)吸收塔排出的尾气中,若SO2的含量超过500
 L·L-1,就要加以处理,处理方法之一是用氨水洗涤烟气脱硫,用足量氨水吸收尾气中SO2的化学方程式为
L·L-1,就要加以处理,处理方法之一是用氨水洗涤烟气脱硫,用足量氨水吸收尾气中SO2的化学方程式为
您最近一年使用:0次
2 . 甲烷的用途很广泛。
(1)已知:
2NO2(g ) N2O4(g) △H=" -56.9kJ·mol" -1
N2O4(g) △H=" -56.9kJ·mol" -1
H2 O(g)= H2O(l) △H=" -44.0kJ·mol" -1
CH4(g)+N2O4 (g)= N2(g)+2H2O(l)+CO2 (g) △H="-898.1kJ·mol" -1
则 CH4 (g)催化还原NO2 (g)生成 N2(g)和H2O(g)的热化学方程式为_____________________ 。
(2)一定条件下,发生2NO(g)+2CO(g) N2(g) +2CO2(g) △H<0。在不同时间c(NO)与c(CO)如下表所示:
N2(g) +2CO2(g) △H<0。在不同时间c(NO)与c(CO)如下表所示:
①该温度下,该反应的平衡常数表达式为K =_____________________ ;
②计算前4秒内氮气的平均反应速率为____________________ ;
③下列选项中,不能说明上述反应已达平衡的是( )
E. 容器中气体的总压强不随时间而变化
(3)CH4燃料电池原理如图所示

①该燃料电池的正极为_______________ (填“a”或“b”)。该电池负极的电极反应式为_____________ ;
②放电一段时间后,电解质溶液的pH___________ (填“增大”、“减小”或“不变”)。
(1)已知:
2NO2(g )
 N2O4(g) △H=" -56.9kJ·mol" -1
N2O4(g) △H=" -56.9kJ·mol" -1H2 O(g)= H2O(l) △H=" -44.0kJ·mol" -1
CH4(g)+N2O4 (g)= N2(g)+2H2O(l)+CO2 (g) △H="-898.1kJ·mol" -1
则 CH4 (g)催化还原NO2 (g)生成 N2(g)和H2O(g)的热化学方程式为
(2)一定条件下,发生2NO(g)+2CO(g)
 N2(g) +2CO2(g) △H<0。在不同时间c(NO)与c(CO)如下表所示:
N2(g) +2CO2(g) △H<0。在不同时间c(NO)与c(CO)如下表所示:时间/s | 0 | 2 | 4 | 6 | 8 | 10 |
 | 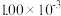 | 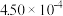 | 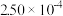 | 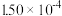 | 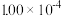 | 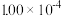 |
 | 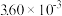 | 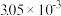 | 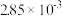 | 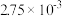 | 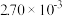 | 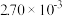 |
①该温度下,该反应的平衡常数表达式为K =
②计算前4秒内氮气的平均反应速率为
③下列选项中,不能说明上述反应已达平衡的是
| A.2v正(NO)= v逆(N2 ) |
| B.容器中气体的平均分子量不随时间而变化 |
| C.容器中气体的密度不随时间而变化 |
| D.容器中CO的质量不再发生变化 |
E. 容器中气体的总压强不随时间而变化
(3)CH4燃料电池原理如图所示

①该燃料电池的正极为
②放电一段时间后,电解质溶液的pH
您最近一年使用:0次
3 . 物质的类别和核心元素的化合价是研究物质性质的两个基本视角。根据下图,完成下列填空:

(1)上图中X的电子式为_________ ;其水溶液长期在空气中放置容易变浑浊,用化学方程式表示该变化__________ ;该变化体现出硫元素的非金属性比氧元素______ (填“强”或“弱”)。用原子结构解释原因____________ 。
(2)Na2S2O3是一种用途广泛的钠盐。下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是______ (填字母序号)。
a.Na2S+ S b.Z+ S c.Na2SO3 + Y d.NaHS + NaHSO3
(3)SO2是主要大气污染物之一。工业上烟气脱硫的方法之一是用碱液吸收,其流程如图: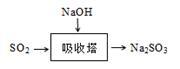 。
。
该法吸收快,效率高。若在操作中持续通入含SO2的烟气,则最终产物为________ 。室温下,0.1mol/L①亚硫酸钠 ②亚硫酸氢钠 ③硫化钠 ④硫氢化钠的四种溶液的pH由大到小的顺序是________ (用编号表示)。
已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15 H2SO3:Ki1=1.3×10-2 Ki2=6.2×10-8
(4)治理含CO、SO2的烟道气,也可以将其在催化剂作用下转化为单质S和无毒的气体:2CO(g) + SO2(g) S(s) + 2CO2(g)。一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是
S(s) + 2CO2(g)。一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是______ (填写字母序号)。
a.υ (CO) ∶υ(SO2) = 2∶1 b.平衡常数不变
c.气体密度不变 d.CO2和SO2的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为 ,则SO2的转化率为
,则SO2的转化率为________ 。

(1)上图中X的电子式为
(2)Na2S2O3是一种用途广泛的钠盐。下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是
a.Na2S+ S b.Z+ S c.Na2SO3 + Y d.NaHS + NaHSO3
(3)SO2是主要大气污染物之一。工业上烟气脱硫的方法之一是用碱液吸收,其流程如图:
 。
。该法吸收快,效率高。若在操作中持续通入含SO2的烟气,则最终产物为
已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15 H2SO3:Ki1=1.3×10-2 Ki2=6.2×10-8
(4)治理含CO、SO2的烟道气,也可以将其在催化剂作用下转化为单质S和无毒的气体:2CO(g) + SO2(g)
 S(s) + 2CO2(g)。一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是
S(s) + 2CO2(g)。一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是a.υ (CO) ∶υ(SO2) = 2∶1 b.平衡常数不变
c.气体密度不变 d.CO2和SO2的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为
 ,则SO2的转化率为
,则SO2的转化率为
您最近一年使用:0次
2016-12-09更新
|
453次组卷
|
2卷引用:2015届上海市闸北区高三下学期期中练习(二模)化学试卷
4 . I.还原剂还原法、光催化氧化法、电化学吸收法是减少氮氧化物排放的有效措施。
(1)利用炭粉可以将氮氧化物还原。
已知:N2(g)+O2(g)=2NO(g) ΔH=+180.6 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
反应:C(s)+2NO(g)=CO2(g)+N2(g) ΔH=_____ kJ·mol-1。
(2)TiO2在紫外线照射下会使空气中的某些分子产生活性基团OH,OH能将NO、NO2氧化,如下图所示,OH与NO2的反应为NO2+OH=HNO3。
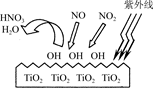
写出OH与NO反应的化学方程式:_____________ 。
Ⅱ.甲醇、乙醇是重要的有机化工原料,有着重要的用途和应用前景。
(3)若在恒温恒容的容器内进行反应CO(g)+2H2(g) CH3OH(g),则可用来判断该反应达到平衡状态的标志有
CH3OH(g),则可用来判断该反应达到平衡状态的标志有___ (填字母)。
A.H2百分含量保持不变
B.容器中气体的压强保持不变
C.容器中混合气体的密度保持不变
D.2v(H2)正= v(CH3OH )逆
(4)CO(g)+2H2(g) CH3OH(g) 其平衡常数表达式为K=
CH3OH(g) 其平衡常数表达式为K=___________ 。该反应的平衡常数K 随温度T 的变化如图所示,

则该反应的 △H___ 0。(填“>”、“<”或“=”)。已知该反应在300℃时的化学平衡常数为0.27,该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将___ (填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
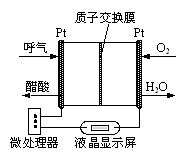
(5)下图所示是一种酸性燃料电池乙醇检测仪,具有自动吹气流量侦测与控制的功能,适合进行现场乙醇检测。负极反应式为_________ 。
(1)利用炭粉可以将氮氧化物还原。
已知:N2(g)+O2(g)=2NO(g) ΔH=+180.6 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
反应:C(s)+2NO(g)=CO2(g)+N2(g) ΔH=
(2)TiO2在紫外线照射下会使空气中的某些分子产生活性基团OH,OH能将NO、NO2氧化,如下图所示,OH与NO2的反应为NO2+OH=HNO3。

写出OH与NO反应的化学方程式:
Ⅱ.甲醇、乙醇是重要的有机化工原料,有着重要的用途和应用前景。
(3)若在恒温恒容的容器内进行反应CO(g)+2H2(g)
 CH3OH(g),则可用来判断该反应达到平衡状态的标志有
CH3OH(g),则可用来判断该反应达到平衡状态的标志有A.H2百分含量保持不变
B.容器中气体的压强保持不变
C.容器中混合气体的密度保持不变
D.2v(H2)正= v(CH3OH )逆
(4)CO(g)+2H2(g)
 CH3OH(g) 其平衡常数表达式为K=
CH3OH(g) 其平衡常数表达式为K=
则该反应的 △H
(5)下图所示是一种酸性燃料电池乙醇检测仪,具有自动吹气流量侦测与控制的功能,适合进行现场乙醇检测。负极反应式为

您最近一年使用:0次
5 . 氨在生活、生产、科研中有广泛用途。
(1)已知反应Ⅰ:2NH3(g) +CO2(g) =NH2CO2NH4(s) △H=−159.5 kJ/mol
反应Ⅱ:NH2CO2NH4(s) =CO(NH2)2 (s)+ H2O(g) △H=+116.5 kJ/mol
反应Ⅲ:H2O(l) = H2O(g) △H=+44.0 kJ/mol
则工业上以CO2、NH3为原料合成尿素和液态水的热化学方程式为___________________ ,该反应在____________ 条件下可以自发进行(填“高温”、“低温”或“任何温度下”);
(2)用NH3催化还原NxOy可以消除氮氧化物的污染。如有反应4NH3(g)+6NO(g) 5N2(g)+6H2O(l) △H<0,相同条件下在2 L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。
5N2(g)+6H2O(l) △H<0,相同条件下在2 L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。
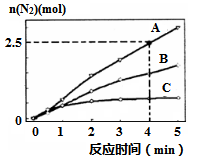
①0~4分钟在A催化剂作用下,反应速率υ(N2)=______ ;
②下列说法正确的是____________ ;
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea (C)
B.使用催化剂A达平衡时,N2最终产率更大
C.单位时间内氢氧键与氮氢键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当平衡常数不变时,说明反应已经达到平衡
(3)查阅资料可知:常温下,K稳[Ag(NH3)2+]=1.00×107,Ksp[AgCl]=2.50×10-10。
①银氨溶液中存在平衡:Ag+(aq)+2NH3(aq) Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=
Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=______________________ ;
②计算得到可逆反应AgCl (s)+2NH3(aq) Ag(NH3)2+ (aq)+Cl-(aq)的化学平衡常数K=
Ag(NH3)2+ (aq)+Cl-(aq)的化学平衡常数K=_________ ,1 L 1 mol/L氨水中最多可以溶解AgCl________ mol(保留2位有效数字);
(4)工业上以氨、丙烯和空气为原料,一定条件下合成丙烯腈(CH2=CH—CN),该反应的化学方程式为____________________________________ 。
(1)已知反应Ⅰ:2NH3(g) +CO2(g) =NH2CO2NH4(s) △H=−159.5 kJ/mol
反应Ⅱ:NH2CO2NH4(s) =CO(NH2)2 (s)+ H2O(g) △H=+116.5 kJ/mol
反应Ⅲ:H2O(l) = H2O(g) △H=+44.0 kJ/mol
则工业上以CO2、NH3为原料合成尿素和液态水的热化学方程式为
(2)用NH3催化还原NxOy可以消除氮氧化物的污染。如有反应4NH3(g)+6NO(g)
 5N2(g)+6H2O(l) △H<0,相同条件下在2 L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。
5N2(g)+6H2O(l) △H<0,相同条件下在2 L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。
①0~4分钟在A催化剂作用下,反应速率υ(N2)=
②下列说法正确的是
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea (C)
B.使用催化剂A达平衡时,N2最终产率更大
C.单位时间内氢氧键与氮氢键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当平衡常数不变时,说明反应已经达到平衡
(3)查阅资料可知:常温下,K稳[Ag(NH3)2+]=1.00×107,Ksp[AgCl]=2.50×10-10。
①银氨溶液中存在平衡:Ag+(aq)+2NH3(aq)
 Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=
Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=②计算得到可逆反应AgCl (s)+2NH3(aq)
 Ag(NH3)2+ (aq)+Cl-(aq)的化学平衡常数K=
Ag(NH3)2+ (aq)+Cl-(aq)的化学平衡常数K=(4)工业上以氨、丙烯和空气为原料,一定条件下合成丙烯腈(CH2=CH—CN),该反应的化学方程式为
您最近一年使用:0次
6 . 锌及其化合物用途广泛。火法炼锌以闪锌矿(主要成分是ZnS)为主要原料,涉及的主要反应有: 2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g) 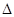 H1=-930 kJ·mol-1
H1=-930 kJ·mol-1
2C(s) + O2(g) = 2CO(g)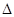 H2=-221 kJ·mol-1
H2=-221 kJ·mol-1
ZnO(s) + CO(g) = Zn(g) + CO2(g)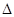 H3= +198 kJ·mol-1
H3= +198 kJ·mol-1
(1)反应ZnS(s) + C(s) + 2O2(g) =Zn(g) + CO2(g) + SO2(g)的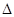 H4=
H4=________ kJ·mol-1。
反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:
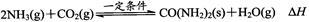
若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是________ 。
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正 = v(H2O)逆 d.容器中混合气体的密度不再改变
(2)硫酸锌可广泛用作印染媒染剂和木材防腐剂。ZnSO4受热分解过程中各物质物质的量随温度变化关系如图所示。
① 写出700℃~980℃时发生反应的化学方程式:_______ ,物质B的化学式是______ 。
② 硫酸锌分解生成的SO2经下图中的两个循环可分别得到S和H2SO4。写出循环I中反应2的化学方程式:______ ;循环II中电解过程阳极反应式是________ 。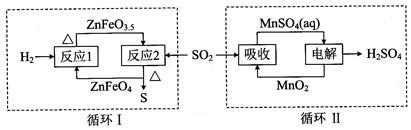
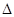 H1=-930 kJ·mol-1
H1=-930 kJ·mol-12C(s) + O2(g) = 2CO(g)
 H2=-221 kJ·mol-1
H2=-221 kJ·mol-1ZnO(s) + CO(g) = Zn(g) + CO2(g)
 H3= +198 kJ·mol-1
H3= +198 kJ·mol-1(1)反应ZnS(s) + C(s) + 2O2(g) =Zn(g) + CO2(g) + SO2(g)的
 H4=
H4=反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:
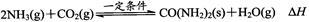
若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正 = v(H2O)逆 d.容器中混合气体的密度不再改变
(2)硫酸锌可广泛用作印染媒染剂和木材防腐剂。ZnSO4受热分解过程中各物质物质的量随温度变化关系如图所示。
① 写出700℃~980℃时发生反应的化学方程式:
② 硫酸锌分解生成的SO2经下图中的两个循环可分别得到S和H2SO4。写出循环I中反应2的化学方程式:


您最近一年使用:0次
2016-12-09更新
|
597次组卷
|
2卷引用:2015-2016学年江苏省扬州中学高二下期中化学试卷
14-15高三上·河北石家庄·阶段练习
解题方法
7 . 按要求完成下列填空
Ⅰ.已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l) ΔH=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ/mol
(1)反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)的ΔH=___________ ;
(2)C3H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+ H2O(g) CO2(g)+ H2(g) ΔH>0
CO2(g)+ H2(g) ΔH>0
①下列事实能说明该反应达到平衡的是___________ ;
a.体系中的压强不发生变化
b.υ正(H2)=υ逆(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO2的浓度不再发生变化
②在某温度下,反应物的起始浓度分别为:c(CO)=1mol·L-1, c(H2O)=2.4 mol·L-1; 达到平衡后,CO的转化率为60%,该反应在此温度下的平衡常数是___________ ;
(3)熔融碳酸盐燃料电池的电解质为Li2CO3和 Na2CO3的混合物,燃料为CO,在工作过程中,电解质熔融液的组成、浓度都不变,写出负极发生的电极反应式___________ 。
Ⅱ.氮化硅(Si3N4)是一种新型陶瓷材料,它可用石英与焦炭在高温的氮气流中反应制得:
SiO2 + _____C + _______N2 ____Si3N4 + _____CO 根据题意完成下列各题:
____Si3N4 + _____CO 根据题意完成下列各题:
(4)配平上述化学反应方程式___________ 。______SiO2 + ______C + ______N2 _____Si3N4 + ____CO
_____Si3N4 + ____CO
(5)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了30mol氮气,反应生成了5mol一氧化碳,则此时混合气体的平均摩尔质量是___________ 。
(6)氮化硅陶瓷的机械强度高,硬度接近于刚玉(A12O3),热稳定性好,化学性质稳定。以下用途正确的是___________ 。
Ⅰ.已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l) ΔH=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ/mol
(1)反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)的ΔH=
(2)C3H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+ H2O(g)
 CO2(g)+ H2(g) ΔH>0
CO2(g)+ H2(g) ΔH>0①下列事实能说明该反应达到平衡的是
a.体系中的压强不发生变化
b.υ正(H2)=υ逆(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO2的浓度不再发生变化
②在某温度下,反应物的起始浓度分别为:c(CO)=1mol·L-1, c(H2O)=2.4 mol·L-1; 达到平衡后,CO的转化率为60%,该反应在此温度下的平衡常数是
(3)熔融碳酸盐燃料电池的电解质为Li2CO3和 Na2CO3的混合物,燃料为CO,在工作过程中,电解质熔融液的组成、浓度都不变,写出负极发生的电极反应式
Ⅱ.氮化硅(Si3N4)是一种新型陶瓷材料,它可用石英与焦炭在高温的氮气流中反应制得:
SiO2 + _____C + _______N2
 ____Si3N4 + _____CO 根据题意完成下列各题:
____Si3N4 + _____CO 根据题意完成下列各题:(4)配平上述化学反应方程式
 _____Si3N4 + ____CO
_____Si3N4 + ____CO(5)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了30mol氮气,反应生成了5mol一氧化碳,则此时混合气体的平均摩尔质量是
(6)氮化硅陶瓷的机械强度高,硬度接近于刚玉(A12O3),热稳定性好,化学性质稳定。以下用途正确的是
| A.可以在冶金工业上制成坩埚、铝电解槽衬里等设备 |
| B.在电子工业上制成耐高温的电的良导体 |
| C.研发氮化硅的全陶发动机替代同类型金属发动机 |
| D.氮化硅陶瓷的开发受到资源的限制,没有发展前途 |
您最近一年使用:0次
解题方法
8 . “C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH、
HCOOH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义。
(1)一定温度下,在两个容积均为2 L的密闭容器中,分别发生反应:
CO2(g) + 3H2(g) CH3OH(g) + H2O(g) △H =﹣49.0 kJ/mol。相关数据如下:
CH3OH(g) + H2O(g) △H =﹣49.0 kJ/mol。相关数据如下:
请回答:①a = _________________________ 。
②若甲中反应10 s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是____________ 。
(2)甲烷的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g) 2CO(g)+2H2(g)在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示,则压强P1
2CO(g)+2H2(g)在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示,则压强P1____ P2,(填“大于”或“小于”);压强为P2时,在y点:v(正)_____ v(逆)(填“大于”、“小于”或“等于”)。

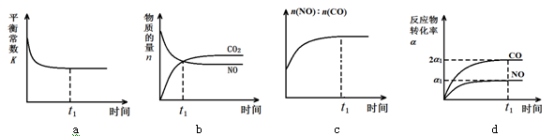
(3)一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g) 2CO2(g)+N2(g) △H<0。在恒温恒容的密闭容器中通入n(NO):n(CO)=2:1的混合气体,发生上述反应。下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是
2CO2(g)+N2(g) △H<0。在恒温恒容的密闭容器中通入n(NO):n(CO)=2:1的混合气体,发生上述反应。下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是_____ (选填字母)。
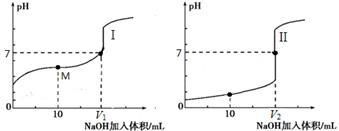
(4)甲酸(HCOOH)是一种弱酸,现用0.1 mol·L-1 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和甲酸溶液,滴定曲线如下:滴定开始前,三种溶液中由水电离出的c(H+)最大的是____ ;V1和V2的关系V1___ V2(填 “>”、“=”或“<”);M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是______ 。
HCOOH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义。
(1)一定温度下,在两个容积均为2 L的密闭容器中,分别发生反应:
CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g) △H =﹣49.0 kJ/mol。相关数据如下:
CH3OH(g) + H2O(g) △H =﹣49.0 kJ/mol。相关数据如下:| 容器 | 甲 | 乙 |
| 反应物投入量 | 1 mol CO2(g)和3 mol H2(g) | 1 mol CH3OH(g)和1 mol H2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4 kJ | 吸收a kJ |
②若甲中反应10 s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是
(2)甲烷的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)
 2CO(g)+2H2(g)在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示,则压强P1
2CO(g)+2H2(g)在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示,则压强P1
(3)一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g)
 2CO2(g)+N2(g) △H<0。在恒温恒容的密闭容器中通入n(NO):n(CO)=2:1的混合气体,发生上述反应。下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是
2CO2(g)+N2(g) △H<0。在恒温恒容的密闭容器中通入n(NO):n(CO)=2:1的混合气体,发生上述反应。下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是
(4)甲酸(HCOOH)是一种弱酸,现用0.1 mol·L-1 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和甲酸溶液,滴定曲线如下:滴定开始前,三种溶液中由水电离出的c(H+)最大的是

您最近一年使用:0次
解题方法
9 . 氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5 kJ,则该反应的热化学方程式为_________ 。
(2)298 K时,在2 L固定体积的密闭容器中,发生可逆反应:
2NO2(g) N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4(g) ΔH=-a kJ·mol-1(a>0)
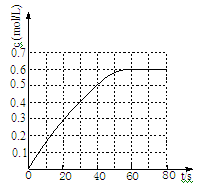
N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:

① 298k时,该反应的平衡常数为_____ L·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是______ :
A.混合气体的密度保持不变;
B.混合气体的颜色不再变化;
C.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol,n(N2O4)="1.2" mol,则此时V(正)___ V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。
现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,

①b点时,溶液中发生水解反应的离子是______ ;
②在c点,溶液中各离子浓度由大到小的排列顺序___________ 。
③d、e点对应溶液中,水电离程度大小关系是d______ e(填“>”、“<”或“=”)。
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5 kJ,则该反应的热化学方程式为
(2)298 K时,在2 L固定体积的密闭容器中,发生可逆反应:
2NO2(g)
 N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4(g) ΔH=-a kJ·mol-1(a>0)N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:

① 298k时,该反应的平衡常数为
②下列情况不是处于平衡状态的是
A.混合气体的密度保持不变;
B.混合气体的颜色不再变化;
C.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol,n(N2O4)="1.2" mol,则此时V(正)
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。
现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,

①b点时,溶液中发生水解反应的离子是
②在c点,溶液中各离子浓度由大到小的排列顺序
③d、e点对应溶液中,水电离程度大小关系是d
您最近一年使用:0次
2016-12-09更新
|
498次组卷
|
4卷引用:2015届辽宁省沈阳铁路实验中学高三下学期初考理综化学试卷
2014·广东肇庆·一模
解题方法
10 . 氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,则该反应的热化学方程式为_______ 。
(2)298 K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g)⇌N2O4(g)ΔH=-a kJ·mol-1 (a>0) N2O4的物质的量浓度随时间变化如图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题:
①298k时,该反应的平衡常数为_______ L ·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是_______ :
a.混合气体的密度保持不变;
b.混合气体的颜色不再变化;
c.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)=0.6mol n(N2O4)=1.2mol,则此时V(正)_______ V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
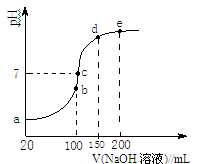
试分析图中a、b、c、d、e五个点,
①b点时,溶液中发生水解反应的离子是_______ ;
②在c点,溶液中各离子浓度由大到小的排列顺序是_______ 。
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,则该反应的热化学方程式为
(2)298 K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g)⇌N2O4(g)ΔH=-a kJ·mol-1 (a>0) N2O4的物质的量浓度随时间变化如图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题:

①298k时,该反应的平衡常数为
②下列情况不是处于平衡状态的是
a.混合气体的密度保持不变;
b.混合气体的颜色不再变化;
c.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)=0.6mol n(N2O4)=1.2mol,则此时V(正)
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。

试分析图中a、b、c、d、e五个点,
①b点时,溶液中发生水解反应的离子是
②在c点,溶液中各离子浓度由大到小的排列顺序是
您最近一年使用:0次
2016-12-09更新
|
809次组卷
|
4卷引用:2015届广东省肇庆市高三一模理综化学试卷



