1 . 含氮化合物在生产生活中有重要的应用。请回答:
(1)NOx与含硫化合物的热化学方程式如下:
反应I:CaS(s)+3NO2(g)=CaO(s)+SO2(g)+3NO(g) △H=-279.12kJ·mol-1 K1
反应II:CaS(s)+4NO2(g)=CaSO4(s)+4NO(g) △H=-714.52kJ·mol-1 K2
反应III:CaSO4(s)+NO(g)=CaO(s)+SO2(g)+NO2(g) △H K3
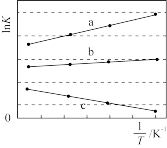
①三个反应的平衡常数的lnK随温度变化关系如图所示,则表示lnK2的曲线是____ 。
②在恒温条件下,加入反应物,一段时间后达到平衡时c(SO2)如图所示,t1时减小容器体积,t2时达到新平衡,请画出t1至t2时c(SO2)变化趋势图____ 。
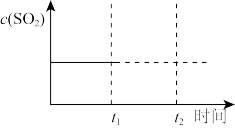
(2)合成氨工厂以“水煤气”和N2为原料,采用两段间接换热式绝热反应器,由进气口充入一定量含CO、H2、H2O、N2的混合气体,在反应器A进行合成氨,其催化剂III铁触媒,在500℃活性最大,反应器B中主要发生的反应为:CO(g)+H2O(g) CO2(g)+H2(g) △H<0,装置如图。
CO2(g)+H2(g) △H<0,装置如图。
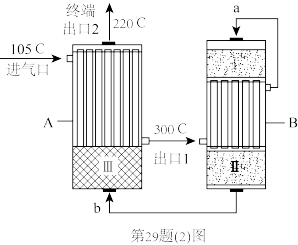
①温度比较:气流a____ 气流b(填“>”“<”或“=”)。
②气体流速一定,经由催化剂I到催化剂II,原料转化率有提升,其可能原因是:____ 。
③下列说法正确的是____ 。
A.利用焦炭与水蒸气高温制备水煤气时,适当加快通入水蒸气的流速,有利于水煤气的生成
B.N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ·mol-1反应器温度越低,终端出口2收率越高
2NH3(g) △H=-92.4kJ·mol-1反应器温度越低,终端出口2收率越高
C.终端出口2得到的气体,通过水吸收,再加热水溶液,可分离出NH3
D.反应原料气从进气口105℃到300℃出口1,已完成氨的合成
(3)已知-33℃液氨中存在:2NH3(l) NH
NH +NH
+NH K=10-29,在100mL液氨中加入0.0001mol NH4Cl固体溶解,并完全电离(忽略体积变化),则c(NH
K=10-29,在100mL液氨中加入0.0001mol NH4Cl固体溶解,并完全电离(忽略体积变化),则c(NH )=
)=____ mol·L-1。金属钾能溶解于液氨中形成蓝色的液氨溶液,反应的化学方程式为K+NH3=K++e(NH3) (电子的氨合物,显蓝色),加入NH4Cl固体,即发生共价键断裂和形成的反应,请写出离子方程式
(电子的氨合物,显蓝色),加入NH4Cl固体,即发生共价键断裂和形成的反应,请写出离子方程式____ 。
(1)NOx与含硫化合物的热化学方程式如下:
反应I:CaS(s)+3NO2(g)=CaO(s)+SO2(g)+3NO(g) △H=-279.12kJ·mol-1 K1
反应II:CaS(s)+4NO2(g)=CaSO4(s)+4NO(g) △H=-714.52kJ·mol-1 K2
反应III:CaSO4(s)+NO(g)=CaO(s)+SO2(g)+NO2(g) △H K3
①三个反应的平衡常数的lnK随温度变化关系如图所示,则表示lnK2的曲线是

②在恒温条件下,加入反应物,一段时间后达到平衡时c(SO2)如图所示,t1时减小容器体积,t2时达到新平衡,请画出t1至t2时c(SO2)变化趋势图
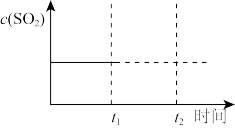
(2)合成氨工厂以“水煤气”和N2为原料,采用两段间接换热式绝热反应器,由进气口充入一定量含CO、H2、H2O、N2的混合气体,在反应器A进行合成氨,其催化剂III铁触媒,在500℃活性最大,反应器B中主要发生的反应为:CO(g)+H2O(g)
 CO2(g)+H2(g) △H<0,装置如图。
CO2(g)+H2(g) △H<0,装置如图。
①温度比较:气流a
②气体流速一定,经由催化剂I到催化剂II,原料转化率有提升,其可能原因是:
③下列说法正确的是
A.利用焦炭与水蒸气高温制备水煤气时,适当加快通入水蒸气的流速,有利于水煤气的生成
B.N2(g)+3H2(g)
 2NH3(g) △H=-92.4kJ·mol-1反应器温度越低,终端出口2收率越高
2NH3(g) △H=-92.4kJ·mol-1反应器温度越低,终端出口2收率越高C.终端出口2得到的气体,通过水吸收,再加热水溶液,可分离出NH3
D.反应原料气从进气口105℃到300℃出口1,已完成氨的合成
(3)已知-33℃液氨中存在:2NH3(l)
 NH
NH +NH
+NH K=10-29,在100mL液氨中加入0.0001mol NH4Cl固体溶解,并完全电离(忽略体积变化),则c(NH
K=10-29,在100mL液氨中加入0.0001mol NH4Cl固体溶解,并完全电离(忽略体积变化),则c(NH )=
)= (电子的氨合物,显蓝色),加入NH4Cl固体,即发生共价键断裂和形成的反应,请写出离子方程式
(电子的氨合物,显蓝色),加入NH4Cl固体,即发生共价键断裂和形成的反应,请写出离子方程式
您最近一年使用:0次
2022-05-11更新
|
940次组卷
|
2卷引用:浙江省温州市普通高中2022届高三适应性测试三模考试化学试题
2 . 乙酸乙酯是一种用途广泛的精细化工产品,一般通过乙酸和乙醇酯化合生成。
(1)在实验室利用上述方法制得乙酸乙酯含有杂质(不计副反应),简述如何提纯产品_______ 。
(2)若用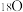 标记乙醇,该反应的化学方程式
标记乙醇,该反应的化学方程式_______ 。
(3)一定温度下该反应的平衡常数 。若按化学方程式中乙酸和乙醇的化学计量数比例投料,则乙酸乙酯的平衡产率
。若按化学方程式中乙酸和乙醇的化学计量数比例投料,则乙酸乙酯的平衡产率
_______ (计算时不计副反应);若乙酸和乙醇的物质的量之比为 ,相应平衡体系中乙酸乙酯的物质的量分数为x,请绘制x随n变化的示意图
,相应平衡体系中乙酸乙酯的物质的量分数为x,请绘制x随n变化的示意图_______ 。
(4)近年来,用乙烯和乙酸为原料、杂多酸作催化剂合成乙酸乙酯的新工艺,具有明显的经济优势,其合成的基本反应为 (
( )。在恒温恒容容器中投入一定量的乙烯和足量的乙酸,下列分析正确的是
)。在恒温恒容容器中投入一定量的乙烯和足量的乙酸,下列分析正确的是_______ 。
a.当乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol,反应已达到化学平衡
b.当乙烯的百分含量保持不变时,反应已达到化学平衡
c.在反应过程中任意时刻移除部分产品,都可以使平衡正向移动,但该反应的平衡常数不变
d.达到平衡后再通入少量乙烯,再次达到平衡时,乙烯的浓度大于原平衡
(5)在乙烯与乙酸等物质的量投料条件下,某研究小组在不同压强、相同时间点进行了乙酸乙酯的产率随温度变化的测定实验,实验结果如图所示。回答下列问题:
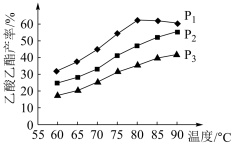
①温度在60~80℃范围内,乙烯与乙酸反应速率由大到小的顺序是_______ [用 、
、 、
、 分别表示在不同压强下的反应速率]。
分别表示在不同压强下的反应速率]。
②在压强为 、温度超过80℃时,乙酸乙酯产率下降的原因可能是
、温度超过80℃时,乙酸乙酯产率下降的原因可能是_______ 。
③为提高乙酸乙酯的合成速率和产率,可以采取的措施_______ (任写两条)。
(1)在实验室利用上述方法制得乙酸乙酯含有杂质(不计副反应),简述如何提纯产品
(2)若用
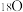 标记乙醇,该反应的化学方程式
标记乙醇,该反应的化学方程式(3)一定温度下该反应的平衡常数
 。若按化学方程式中乙酸和乙醇的化学计量数比例投料,则乙酸乙酯的平衡产率
。若按化学方程式中乙酸和乙醇的化学计量数比例投料,则乙酸乙酯的平衡产率
 ,相应平衡体系中乙酸乙酯的物质的量分数为x,请绘制x随n变化的示意图
,相应平衡体系中乙酸乙酯的物质的量分数为x,请绘制x随n变化的示意图(4)近年来,用乙烯和乙酸为原料、杂多酸作催化剂合成乙酸乙酯的新工艺,具有明显的经济优势,其合成的基本反应为
 (
( )。在恒温恒容容器中投入一定量的乙烯和足量的乙酸,下列分析正确的是
)。在恒温恒容容器中投入一定量的乙烯和足量的乙酸,下列分析正确的是a.当乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol,反应已达到化学平衡
b.当乙烯的百分含量保持不变时,反应已达到化学平衡
c.在反应过程中任意时刻移除部分产品,都可以使平衡正向移动,但该反应的平衡常数不变
d.达到平衡后再通入少量乙烯,再次达到平衡时,乙烯的浓度大于原平衡
(5)在乙烯与乙酸等物质的量投料条件下,某研究小组在不同压强、相同时间点进行了乙酸乙酯的产率随温度变化的测定实验,实验结果如图所示。回答下列问题:

①温度在60~80℃范围内,乙烯与乙酸反应速率由大到小的顺序是
 、
、 、
、 分别表示在不同压强下的反应速率]。
分别表示在不同压强下的反应速率]。②在压强为
 、温度超过80℃时,乙酸乙酯产率下降的原因可能是
、温度超过80℃时,乙酸乙酯产率下降的原因可能是③为提高乙酸乙酯的合成速率和产率,可以采取的措施
您最近一年使用:0次
2021-04-09更新
|
737次组卷
|
2卷引用:上海市黄埔区2021届高三第二次模拟考试化学试题
解题方法
3 . 含氮化合物的研发与绿色反展、经济可持续发展有着密切关联。
(1)氨是一种重要化工原料。合成氨原料气H2,可用天然气为原料制得,有关反应能量变化如下图所示。
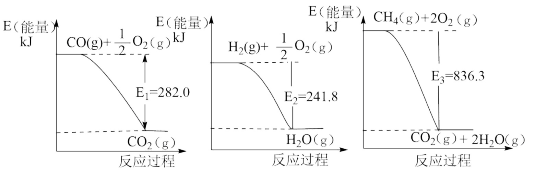
则用CH4(g)和H2O(g)反应制得H2(g)和CO(g)的热化学方程式为:_______ 。
(2)氮的氧化物有着广泛用途,又是环境的污染物。
(i)在150℃时,将0.4mol NO2气体充入体积为2L的真空密闭容器中,发生反应:2NO2(g) N2O4(g)。
N2O4(g)。
每隔一定时间测定容器内各物质的物质的量,数据如下表:
①当反应在1500C达到平衡时,该反应平衡常数K=________ 。(填数值)
②若最初通入N2O4,在相同条件下达到平衡时,各物质浓度仍然相同,则N2O4的起始浓度应为_______ 。
(ii)氨氧化制HNO3的尾气中含有NO和NO2,且n(NO):n(NO2) =1:1,可用尿素溶液除去,其作用原理是:NO2和NO与水反应生成亚硝酸,亚硝酸再与尿素反应生成对环境无污染的物质。若用1mol尿素吸收该尾气,则能吸收氮氧化物_______ g。
(3)氨气,CO2在一定条件下可合成尿素,其反应为:2NH3(g)+CO2(g)==CO( NH2)2(s)+H2O(g)
右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为[n(NH3)/n(CO2)],b为水碳比[n(H2O)/n(CO2)]。则:①b应控制在________ ;
A.1.5. 1.6 B.1~1.1 C.0.6~0.7
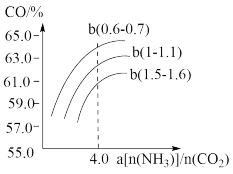
②a应控制在4.0的理由是_______ 。
(1)氨是一种重要化工原料。合成氨原料气H2,可用天然气为原料制得,有关反应能量变化如下图所示。

则用CH4(g)和H2O(g)反应制得H2(g)和CO(g)的热化学方程式为:
(2)氮的氧化物有着广泛用途,又是环境的污染物。
(i)在150℃时,将0.4mol NO2气体充入体积为2L的真空密闭容器中,发生反应:2NO2(g)
 N2O4(g)。
N2O4(g)。每隔一定时间测定容器内各物质的物质的量,数据如下表:
| 时间 | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
①当反应在1500C达到平衡时,该反应平衡常数K=
②若最初通入N2O4,在相同条件下达到平衡时,各物质浓度仍然相同,则N2O4的起始浓度应为
(ii)氨氧化制HNO3的尾气中含有NO和NO2,且n(NO):n(NO2) =1:1,可用尿素溶液除去,其作用原理是:NO2和NO与水反应生成亚硝酸,亚硝酸再与尿素反应生成对环境无污染的物质。若用1mol尿素吸收该尾气,则能吸收氮氧化物
(3)氨气,CO2在一定条件下可合成尿素,其反应为:2NH3(g)+CO2(g)==CO( NH2)2(s)+H2O(g)
右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为[n(NH3)/n(CO2)],b为水碳比[n(H2O)/n(CO2)]。则:①b应控制在
A.1.5. 1.6 B.1~1.1 C.0.6~0.7

②a应控制在4.0的理由是
您最近一年使用:0次



