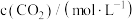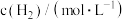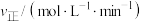解题方法
1 . 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
CH3CH=CH2+CO+H2 CH3CH2CH2CHO
CH3CH2CH2CHO CH3CH2CH2CH2OH
CH3CH2CH2CH2OH
CO的制备原理:HCOOH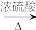 CO↑+H2O,并设计出原料气的制备装置(如下图所示)。
CO↑+H2O,并设计出原料气的制备装置(如下图所示)。
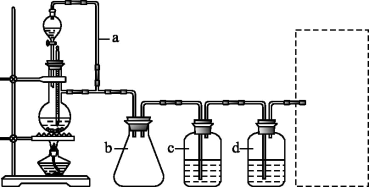
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式:_______ ,_______ 。
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是_______ ,_______ ;c和d中盛装的试剂分别是_______ ,_______ 。若用以上装置制备H2,气体发生装置中必需的玻璃仪器名称是_______ ;在虚线框内画出收集干燥H2的装置图_______ 。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这4种气体,混合气体通过试剂的顺序是_______ (填序号)。
①饱和Na2SO3溶液 ②KMnO4酸性溶液 ③澄清石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是_______ (填字母序号)。
a.低温、高压、催化剂 b.适当的温度、高压、催化剂 c.常温、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品。为纯化1-丁醇,该小组查阅文献得知:
①R—CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;
②沸点:乙醚34 ℃,1-丁醇118 ℃,并设计出如下提纯路线:
粗品 滤液
滤液
 有机层
有机层 1-丁醇
1-丁醇
乙醚 纯品
纯品
试剂1为_______ ,操作1为_______ ,操作2为_______ ,操作3为_______ 。
CH3CH=CH2+CO+H2
 CH3CH2CH2CHO
CH3CH2CH2CHO CH3CH2CH2CH2OH
CH3CH2CH2CH2OHCO的制备原理:HCOOH
 CO↑+H2O,并设计出原料气的制备装置(如下图所示)。
CO↑+H2O,并设计出原料气的制备装置(如下图所示)。
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式:
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这4种气体,混合气体通过试剂的顺序是
①饱和Na2SO3溶液 ②KMnO4酸性溶液 ③澄清石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是
a.低温、高压、催化剂 b.适当的温度、高压、催化剂 c.常温、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品。为纯化1-丁醇,该小组查阅文献得知:
①R—CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;
②沸点:乙醚34 ℃,1-丁醇118 ℃,并设计出如下提纯路线:
粗品
 滤液
滤液
 有机层
有机层 1-丁醇
1-丁醇乙醚
 纯品
纯品试剂1为
您最近一年使用:0次
名校
解题方法
2 . 某研究性学习小组为合成1丁醇,查阅资料得知一条合成路线:CH3CH===CH2+CO+H2→CH3CH2CH2CHO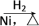 CH3CH2CH2CH2OH,CO的制备原理:HCOOH
CH3CH2CH2CH2OH,CO的制备原理:HCOOH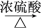 CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2丙醇,从中选择合适的试剂制备氢气、丙烯。写出化学方程式:______________________________________________ 。
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是________ 、________ ;c和d中盛装的试剂分别是________ 、________ 。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是________ (填序号)。
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是________ 。
a.低温、高压、催化剂 b.适当的温度、高压、催化剂
c.常温、常压、催化剂 d.适当的温度、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1丁醇粗品,为纯化1丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和)―→RCH(OH)SO3Na↓;②沸点:乙醚 34 ℃,1丁醇 118 ℃,并设计出如下提纯路线:
粗品 滤液
滤液 有机层
有机层 1丁醇、乙醚
1丁醇、乙醚 纯品
纯品
试剂1为________ ,操作1为________ ,操作2为________ ,操作3为________ 。
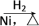 CH3CH2CH2CH2OH,CO的制备原理:HCOOH
CH3CH2CH2CH2OH,CO的制备原理:HCOOH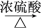 CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。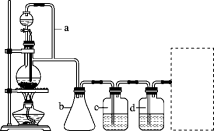
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2丙醇,从中选择合适的试剂制备氢气、丙烯。写出化学方程式:
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是
a.低温、高压、催化剂 b.适当的温度、高压、催化剂
c.常温、常压、催化剂 d.适当的温度、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1丁醇粗品,为纯化1丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和)―→RCH(OH)SO3Na↓;②沸点:乙醚 34 ℃,1丁醇 118 ℃,并设计出如下提纯路线:
粗品
 滤液
滤液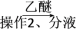 有机层
有机层 1丁醇、乙醚
1丁醇、乙醚 纯品
纯品试剂1为
您最近一年使用:0次
2016-12-09更新
|
295次组卷
|
3卷引用:2016届河北省邯郸一中高三下学期二模理综化学试卷
解题方法
3 . 以煤为原料,经由甲醇可制取甲醚,也可以制取烯烃并可以此取代传统的以石油为原料制取烯烃的路线。
(1)已知:在25℃和101kPa条件下,甲醇的燃烧热为-726.5 ,乙烯的燃烧热为-1411
,乙烯的燃烧热为-1411  ,
,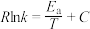 (
( 为活化能,R、C为常数,k为平衡常数)。则:
为活化能,R、C为常数,k为平衡常数)。则:
① 脱水生成
脱水生成 的热化学方程式是
的热化学方程式是___________ ,该反应自发进行的条件是___________ (填“较低”、“较高”或“任意”)温度。
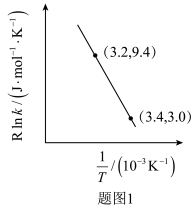
②甲醇脱水生成乙烯的温度与平衡常数的实验数据图如图1所示,该反应的正反应的活化能为___________  。
。
(2)以煤为原料气化产生的原料气可以用来合成 和
和 ,合成气平衡转化率随氢碳比 (
,合成气平衡转化率随氢碳比 (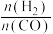 )的变化如图2所示:甲醇制取烃的过程中,会发生多种反应,可以生成
)的变化如图2所示:甲醇制取烃的过程中,会发生多种反应,可以生成 、
、 、
、 等,一定条件下,测得各烃的质量分数、
等,一定条件下,测得各烃的质量分数、 转化率随温度变化情况如图3所示。
转化率随温度变化情况如图3所示。
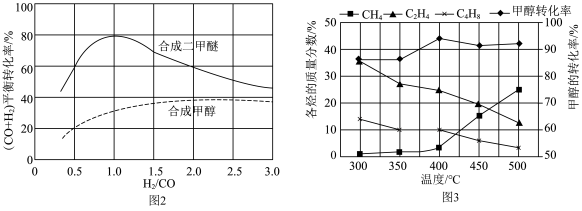
①下列叙述不正确 的是___________ 。
A.合成 的最佳氢碳比为1.0
的最佳氢碳比为1.0
B.甲醇制取烃的过程中,相同条件下,温度越高越有利于 的生成
的生成
C.甲醇制取乙烯的过程中,一般控制在350℃~400℃比较合适
D.甲醇制取烃的过程中, 的平衡转化率随温度升高先增大后减少
的平衡转化率随温度升高先增大后减少
②原料气合成 、
、 过程有如下反应发生:
过程有如下反应发生:
反应Ⅰ
反应Ⅱ

反应Ⅲ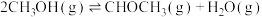

图2中原料气合成 的转化率高于
的转化率高于 的原因
的原因___________ 。
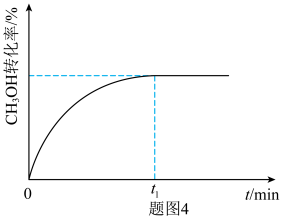
③在350℃,1MPa下,甲醇制取乙烯的转化率随时间的变化曲线如图4所示( 为该条件下的平衡时刻)。画出在相同条件下,向容器中添加氮气作稀释剂时甲醇的转化率随时间的变化曲线。
为该条件下的平衡时刻)。画出在相同条件下,向容器中添加氮气作稀释剂时甲醇的转化率随时间的变化曲线。_________
(1)已知:在25℃和101kPa条件下,甲醇的燃烧热为-726.5
 ,乙烯的燃烧热为-1411
,乙烯的燃烧热为-1411  ,
,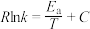 (
( 为活化能,R、C为常数,k为平衡常数)。则:
为活化能,R、C为常数,k为平衡常数)。则:①
 脱水生成
脱水生成 的热化学方程式是
的热化学方程式是②甲醇脱水生成乙烯的温度与平衡常数的实验数据图如图1所示,该反应的正反应的活化能为
 。
。
(2)以煤为原料气化产生的原料气可以用来合成
 和
和 ,合成气平衡转化率随氢碳比 (
,合成气平衡转化率随氢碳比 (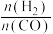 )的变化如图2所示:甲醇制取烃的过程中,会发生多种反应,可以生成
)的变化如图2所示:甲醇制取烃的过程中,会发生多种反应,可以生成 、
、 、
、 等,一定条件下,测得各烃的质量分数、
等,一定条件下,测得各烃的质量分数、 转化率随温度变化情况如图3所示。
转化率随温度变化情况如图3所示。
①下列叙述
A.合成
 的最佳氢碳比为1.0
的最佳氢碳比为1.0B.甲醇制取烃的过程中,相同条件下,温度越高越有利于
 的生成
的生成C.甲醇制取乙烯的过程中,一般控制在350℃~400℃比较合适
D.甲醇制取烃的过程中,
 的平衡转化率随温度升高先增大后减少
的平衡转化率随温度升高先增大后减少②原料气合成
 、
、 过程有如下反应发生:
过程有如下反应发生:反应Ⅰ

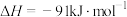
反应Ⅱ


反应Ⅲ
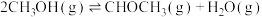

图2中原料气合成
 的转化率高于
的转化率高于 的原因
的原因③在350℃,1MPa下,甲醇制取乙烯的转化率随时间的变化曲线如图4所示(
 为该条件下的平衡时刻)。画出在相同条件下,向容器中添加氮气作稀释剂时甲醇的转化率随时间的变化曲线。
为该条件下的平衡时刻)。画出在相同条件下,向容器中添加氮气作稀释剂时甲醇的转化率随时间的变化曲线。
您最近一年使用:0次
名校
解题方法
4 . 碳达峰是指我国承诺2030年前,二氧化碳的排放不再增长。因此,诸多科学家都在大力研合理利用 和CO以减少碳的排放。
和CO以减少碳的排放。
(1) 可通过以下4种方式转化成有机物,从而有效实现碳循环。
可通过以下4种方式转化成有机物,从而有效实现碳循环。
a.
b.
c.
已知:
以上反应中,最环保节能的是_______ ,原子利用率最高的是_______ 。(填编号)
(2)我国科学家设计出一条仅11步的工业合成路线,实现了 到淀粉的合成。其第一步是把
到淀粉的合成。其第一步是把 还原为甲醇(CH3OH),该方法的化学方程式是:
还原为甲醇(CH3OH),该方法的化学方程式是: 。
。
回答下列问题:
①能说明该反应已达平衡状态的是_______ (填字母)。
A.单位时间内生成 的同时消耗了
的同时消耗了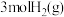
B.在恒温恒容的容器中,混合气体的平均摩尔质量保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,混合气体的密度不再变化
②该反应正逆反应的活化能大小为: (正)
(正)_______  (逆),且该反应在
(逆),且该反应在_______ 自发进行(填“高温”、“低温”“任何温度”或“任何温度都不”)
(3)利用CO高温时与磷石膏(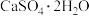 )反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
)反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
①在700℃时,主要的还原产物是一种硫的最低价盐,该物质为_______ 。
②在1150℃时,向盛有足量 的真空恒容密闭容器中充入一定量CO,反应体系起始压强为
的真空恒容密闭容器中充入一定量CO,反应体系起始压强为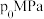 ,主要发生反应:
,主要发生反应: 。该反应达到平衡时,
。该反应达到平衡时,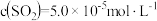 ,CO的转化率为50%,则初始时
,CO的转化率为50%,则初始时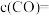
_______ mol/L,该反应的压强平衡常数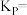
_______ MPa(忽略副反应;气体分压=总压×气体物质的量分数)。
(4)工业上也可用炭粉还原磷石膏,该反应的产物与C/S值(炭粉与 的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、
的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、 和
和 ;当C/S值大于0.7时,反应所得气体中
;当C/S值大于0.7时,反应所得气体中 的体积分数下降,可能的原因是
的体积分数下降,可能的原因是_______ 。

 和CO以减少碳的排放。
和CO以减少碳的排放。(1)
 可通过以下4种方式转化成有机物,从而有效实现碳循环。
可通过以下4种方式转化成有机物,从而有效实现碳循环。a.

b.

c.

已知:

以上反应中,最环保节能的是
(2)我国科学家设计出一条仅11步的工业合成路线,实现了
 到淀粉的合成。其第一步是把
到淀粉的合成。其第一步是把 还原为甲醇(CH3OH),该方法的化学方程式是:
还原为甲醇(CH3OH),该方法的化学方程式是: 。
。回答下列问题:
①能说明该反应已达平衡状态的是
A.单位时间内生成
 的同时消耗了
的同时消耗了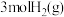
B.在恒温恒容的容器中,混合气体的平均摩尔质量保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,混合气体的密度不再变化
②该反应正逆反应的活化能大小为:
 (正)
(正) (逆),且该反应在
(逆),且该反应在(3)利用CO高温时与磷石膏(
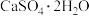 )反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
)反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。①在700℃时,主要的还原产物是一种硫的最低价盐,该物质为
②在1150℃时,向盛有足量
 的真空恒容密闭容器中充入一定量CO,反应体系起始压强为
的真空恒容密闭容器中充入一定量CO,反应体系起始压强为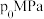 ,主要发生反应:
,主要发生反应: 。该反应达到平衡时,
。该反应达到平衡时,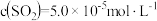 ,CO的转化率为50%,则初始时
,CO的转化率为50%,则初始时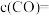
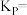
(4)工业上也可用炭粉还原磷石膏,该反应的产物与C/S值(炭粉与
 的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、
的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、 和
和 ;当C/S值大于0.7时,反应所得气体中
;当C/S值大于0.7时,反应所得气体中 的体积分数下降,可能的原因是
的体积分数下降,可能的原因是
您最近一年使用:0次
解题方法
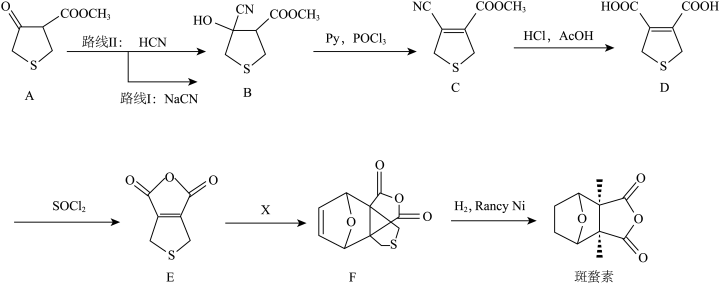
5 . 斑蝥素具有良好的抗肿瘤活性。下列是斑蝥素的一种合成路线:__ 。
(2)A转化为B时,路线Ⅰ和路线Ⅱ均在水溶液中进行。实验发现:路线Ⅰ比路线Ⅱ所需时间短,试解释原因__ 。
(3)写出B→C的化学方程式__ 。
(4)D与乙二醇发生缩聚反应的化学方程式为__ 。
(5)①X的结构简式是__ 。
②下表研究了__ 对合成F的影响,合成F的较优条件为__ (填编号)。
(6 )请写出以为原料制备
)请写出以为原料制备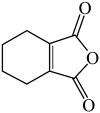 的合成路线流程图
的合成路线流程图__ (无机试剂任选,合成路线流程图示见本题题干)。
ⅱ.狄尔斯阿尔德反应:
(2)A转化为B时,路线Ⅰ和路线Ⅱ均在水溶液中进行。实验发现:路线Ⅰ比路线Ⅱ所需时间短,试解释原因
(3)写出B→C的化学方程式
(4)D与乙二醇发生缩聚反应的化学方程式为
(5)①X的结构简式是
②下表研究了
| 编号 | 离子液体X | 反应温度/℃ | 反应时间/h | E含量/% | F含量/% | |
| 1 | [BPy]•BF4 | 45 | 20 | 90 | 9 | |
| 2 | [HMIM]•PF6 | 35 | 20 | 5 | 93 | |
| 3 | [BMIM]•BF4 | 25 | 30 | 0 | 90 | |
| 4 | [HMIM]•BF4 | 35 | 20 | 38 | 57 | |
| 5 | [BMIM]•BF4 | 25 | 20 | 0 | 86 |
 )请写出以为原料制备
)请写出以为原料制备 的合成路线流程图
的合成路线流程图
您最近一年使用:0次
18-19高三·浙江·期中
6 . 以硫酸工业的 尾气氨、石灰石、焦炭、碳酸氢铵和氯化钾等为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质,合成路线如下,下列有关说法不正确的是( )
尾气氨、石灰石、焦炭、碳酸氢铵和氯化钾等为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质,合成路线如下,下列有关说法不正确的是( )
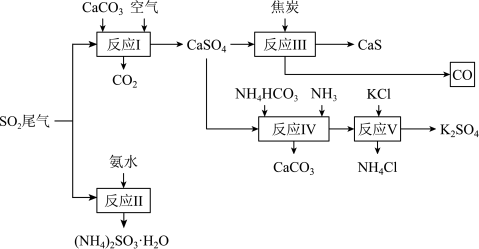
 尾气氨、石灰石、焦炭、碳酸氢铵和氯化钾等为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质,合成路线如下,下列有关说法不正确的是( )
尾气氨、石灰石、焦炭、碳酸氢铵和氯化钾等为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质,合成路线如下,下列有关说法不正确的是( )
| A.反应Ⅰ中需鼓入足量空气以保证二氧化硫充分氧化生成硫酸钙 |
B.反应Ⅲ中发生反应的化学方程式 |
| C.反应Ⅳ需控制温度在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应Ⅴ中的副产物氯化铵可用作氮肥,可与钾肥(如碳酸钾)合用,更有利于植物的生长。 |
您最近一年使用:0次
7 . 碳达峰、碳中和是现在需要继续完成的环保任务, 的综合利用成为热点研究对象,
的综合利用成为热点研究对象, 作为碳源加氢是再生能源的有效方法,
作为碳源加氢是再生能源的有效方法, 加氢可以合成甲醇,
加氢可以合成甲醇, 提出“甲醇经济”概念,认为甲醇会在不久的将来扮演不可或缺的角色,通过
提出“甲醇经济”概念,认为甲醇会在不久的将来扮演不可或缺的角色,通过 加氢生产甲醇是有希望的可再生路线之一,该过程主要发生如下反应:
加氢生产甲醇是有希望的可再生路线之一,该过程主要发生如下反应:
反应I: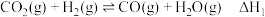
反应Ⅱ:
(1)①相关键能如下表,则
_______ ,该反应的活化能 (正)
(正)_______  (逆)(填“大于”“小于”或“等于”)。
(逆)(填“大于”“小于”或“等于”)。
②已知 的正反应速率
的正反应速率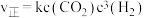 (k为正反应的速率常数),某温度时测得数据如下:
(k为正反应的速率常数),某温度时测得数据如下:
则此温度下,表中
______ 。
(2)据文献报道, 基纳米材料作为高性能催化剂可将
基纳米材料作为高性能催化剂可将 电还原为高能量密度的
电还原为高能量密度的 ,不同催化剂对生成
,不同催化剂对生成 的法拉第效率与电极电势的变化如图所示(已知法拉第效率是指实际生成物和理论生成物的百分比),为了保证生成甲醇的法拉第效率,最合适的电势及最佳催化剂是
的法拉第效率与电极电势的变化如图所示(已知法拉第效率是指实际生成物和理论生成物的百分比),为了保证生成甲醇的法拉第效率,最合适的电势及最佳催化剂是_______ 。 的转化率随温度和压强的变化如图,判断
的转化率随温度和压强的变化如图,判断 的大小关系:
的大小关系:__________ ;解释压强一定时, 的平衡转化率呈现如图变化的原因:
的平衡转化率呈现如图变化的原因:_________________ 。 ,向容积为
,向容积为 的恒容密闭容器中充入
的恒容密闭容器中充入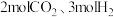 发生反应I、Ⅱ,平衡时
发生反应I、Ⅱ,平衡时 的转化率是
的转化率是 ,体系内剩余
,体系内剩余 ,则反应Ⅱ的平衡常数
,则反应Ⅱ的平衡常数
_______  ,体系内甲醇的平衡分压
,体系内甲醇的平衡分压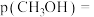
_____  (用含
(用含 的式子表示)。
的式子表示)。
 的综合利用成为热点研究对象,
的综合利用成为热点研究对象, 作为碳源加氢是再生能源的有效方法,
作为碳源加氢是再生能源的有效方法, 加氢可以合成甲醇,
加氢可以合成甲醇, 提出“甲醇经济”概念,认为甲醇会在不久的将来扮演不可或缺的角色,通过
提出“甲醇经济”概念,认为甲醇会在不久的将来扮演不可或缺的角色,通过 加氢生产甲醇是有希望的可再生路线之一,该过程主要发生如下反应:
加氢生产甲醇是有希望的可再生路线之一,该过程主要发生如下反应:反应I:
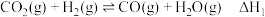
反应Ⅱ:

(1)①相关键能如下表,则

 (正)
(正) (逆)(填“大于”“小于”或“等于”)。
(逆)(填“大于”“小于”或“等于”)。化学键 |
|
|
|
|
键能 | 436 | 1071 | 464 | 803 |
 的正反应速率
的正反应速率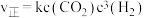 (k为正反应的速率常数),某温度时测得数据如下:
(k为正反应的速率常数),某温度时测得数据如下:
|
|
| |
1 | 0.02 | 0.01 |
|
2 | 0.02 | 0.02 | a |

(2)据文献报道,
 基纳米材料作为高性能催化剂可将
基纳米材料作为高性能催化剂可将 电还原为高能量密度的
电还原为高能量密度的 ,不同催化剂对生成
,不同催化剂对生成 的法拉第效率与电极电势的变化如图所示(已知法拉第效率是指实际生成物和理论生成物的百分比),为了保证生成甲醇的法拉第效率,最合适的电势及最佳催化剂是
的法拉第效率与电极电势的变化如图所示(已知法拉第效率是指实际生成物和理论生成物的百分比),为了保证生成甲醇的法拉第效率,最合适的电势及最佳催化剂是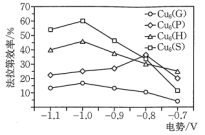
 的转化率随温度和压强的变化如图,判断
的转化率随温度和压强的变化如图,判断 的大小关系:
的大小关系: 的平衡转化率呈现如图变化的原因:
的平衡转化率呈现如图变化的原因:
 ,向容积为
,向容积为 的恒容密闭容器中充入
的恒容密闭容器中充入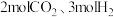 发生反应I、Ⅱ,平衡时
发生反应I、Ⅱ,平衡时 的转化率是
的转化率是 ,体系内剩余
,体系内剩余 ,则反应Ⅱ的平衡常数
,则反应Ⅱ的平衡常数
 ,体系内甲醇的平衡分压
,体系内甲醇的平衡分压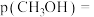
 (用含
(用含 的式子表示)。
的式子表示)。
您最近一年使用:0次
名校
解题方法
8 . 钌( )为稀有元素,广泛应用于电子、航空航天、化工等领域。某含钌的废渣主要成分为
)为稀有元素,广泛应用于电子、航空航天、化工等领域。某含钌的废渣主要成分为 、
、 、
、 、
、 ,一种从中回收
,一种从中回收 制
制 的工艺流程如下:
的工艺流程如下:
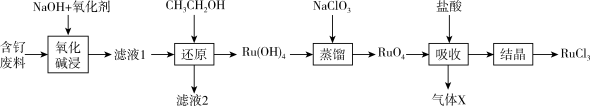
(1)“氧化碱浸”时,两种氧化剂在不同温度对钌浸出率和渣率分别如图1、图2所示,则适宜选择的氧化剂为_______ ;最佳反应温度为_______ 。
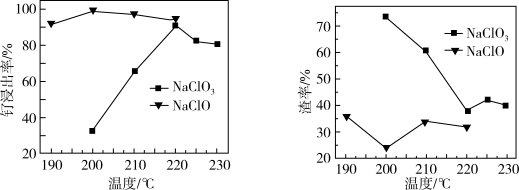
图1 图2
(2)滤液1中溶质主要成分为 、
、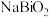 、
、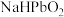 和
和_______ ;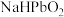 中
中 的化合价为
的化合价为_______ ; 转化为
转化为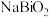 的化学方程式为
的化学方程式为_______ 。
(3)“还原”过程生成 和乙醛,且
和乙醛,且 明显增大,则该过程的离子反应方程式为
明显增大,则该过程的离子反应方程式为_______ 。
(4)“吸收”过程产生的气体X经Y溶液吸收后,经进一步处理可以循环利用,则X和Y的化学式分别为_______ 、_______ 。
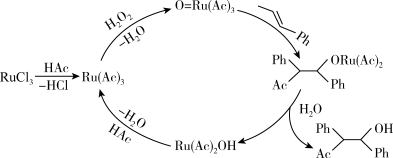
(5) 在有机合成中有重要应用,其参与某有机物合成的路线如下图3所示(
在有机合成中有重要应用,其参与某有机物合成的路线如下图3所示( 代表乙酸,
代表乙酸, 代表苯基),则下列说法正确的是_______。
代表苯基),则下列说法正确的是_______。
 )为稀有元素,广泛应用于电子、航空航天、化工等领域。某含钌的废渣主要成分为
)为稀有元素,广泛应用于电子、航空航天、化工等领域。某含钌的废渣主要成分为 、
、 、
、 、
、 ,一种从中回收
,一种从中回收 制
制 的工艺流程如下:
的工艺流程如下:
(1)“氧化碱浸”时,两种氧化剂在不同温度对钌浸出率和渣率分别如图1、图2所示,则适宜选择的氧化剂为

图1 图2
(2)滤液1中溶质主要成分为
 、
、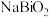 、
、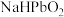 和
和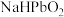 中
中 的化合价为
的化合价为 转化为
转化为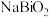 的化学方程式为
的化学方程式为(3)“还原”过程生成
 和乙醛,且
和乙醛,且 明显增大,则该过程的离子反应方程式为
明显增大,则该过程的离子反应方程式为(4)“吸收”过程产生的气体X经Y溶液吸收后,经进一步处理可以循环利用,则X和Y的化学式分别为
(5)
 在有机合成中有重要应用,其参与某有机物合成的路线如下图3所示(
在有机合成中有重要应用,其参与某有机物合成的路线如下图3所示( 代表乙酸,
代表乙酸, 代表苯基),则下列说法正确的是_______。
代表苯基),则下列说法正确的是_______。
A. 为催化剂 为催化剂 | B. 作还原剂 作还原剂 | C. 为中间产物 为中间产物 | D.主要生成物为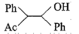 |
您最近一年使用:0次
2022-01-22更新
|
952次组卷
|
3卷引用:广东省茂名市2022届高三第一次综合测试(一模)化学试题
广东省茂名市2022届高三第一次综合测试(一模)化学试题(已下线)押广东卷化学第18题 化学工艺流程题-备战2022年高考化学临考题号押题(广东卷)福建省厦门第一中学2021-2022学年高一下学期5月月考化学试题
名校
解题方法
9 . 生产工艺的实现,涉及能源消耗、环境保护、综合经济效益等等。
Ⅰ.(1)下列单元操作中采用了热交换工艺设备,以利用化学反应中放出的热量,达到节能减排效果的有_______ (填序号)。
A. 电解食盐水制烧碱 B. 合成氨中的催化合成
C. 硫酸生产中的催化氧化 D. 煅烧石灰石制取生石灰
Ⅱ.以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
以下是一种废钒催化剂回收工艺路线:
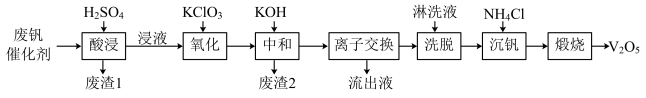
回答下列问题:
(2)“酸浸”时V2O4转化为VO2+,反应的离子方程式为_________ ,同时V2O5转化为VO2+。“废渣1”的主要成分是________ 。
(3)“氧化”中使VO2+变为VO2+,则“氧化”环节中氧化剂与还原剂的物质的量之比为_____ 。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+V4O124- R4V4O12+4OH−(以ROH为强碱性阴离子交换树脂)。为了提高化洗脱效率,淋洗液应该呈
R4V4O12+4OH−(以ROH为强碱性阴离子交换树脂)。为了提高化洗脱效率,淋洗液应该呈_______ 性(填“酸”“碱”“中”)。
(5)检验“流出液”中含量最多的阳离子,其实验操作步骤是____ 。
(6)“煅烧”中发生反应的化学方程式2NH4VO3 V2O5+H2O+2NH3↑,写出“沉钒”过程的离子方程式
V2O5+H2O+2NH3↑,写出“沉钒”过程的离子方程式__________ 。
(7)若有100 kg该废钒催化剂,若转化中钒元素利用率为80%,则最多可回收到V2O5__ kg(保留小数点后一位)。
Ⅰ.(1)下列单元操作中采用了热交换工艺设备,以利用化学反应中放出的热量,达到节能减排效果的有
A. 电解食盐水制烧碱 B. 合成氨中的催化合成
C. 硫酸生产中的催化氧化 D. 煅烧石灰石制取生石灰
Ⅱ.以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
| 物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
| 质量分数/% | 2.20~2.90 | 2.8~3.32 | 22~28 | 60~65 | 1~2 | <1 |

回答下列问题:
(2)“酸浸”时V2O4转化为VO2+,反应的离子方程式为
(3)“氧化”中使VO2+变为VO2+,则“氧化”环节中氧化剂与还原剂的物质的量之比为
(4)“离子交换”和“洗脱”可简单表示为:4ROH+V4O124-
 R4V4O12+4OH−(以ROH为强碱性阴离子交换树脂)。为了提高化洗脱效率,淋洗液应该呈
R4V4O12+4OH−(以ROH为强碱性阴离子交换树脂)。为了提高化洗脱效率,淋洗液应该呈(5)检验“流出液”中含量最多的阳离子,其实验操作步骤是
(6)“煅烧”中发生反应的化学方程式2NH4VO3
 V2O5+H2O+2NH3↑,写出“沉钒”过程的离子方程式
V2O5+H2O+2NH3↑,写出“沉钒”过程的离子方程式(7)若有100 kg该废钒催化剂,若转化中钒元素利用率为80%,则最多可回收到V2O5
您最近一年使用:0次
名校
解题方法
10 . 三甲胺N(CH3)3是重要的化工原料。最近我国科学家实现了使用铜催化剂将N,N—二甲基甲酰胺【N(CH3)2NCHO,简称DMF】转化为三甲胺的合成路线。回答下列问题:
(1)结合实验与计算机模拟结果,研究单一DMF分子在铜催化剂表面的反应历程,如图所示:
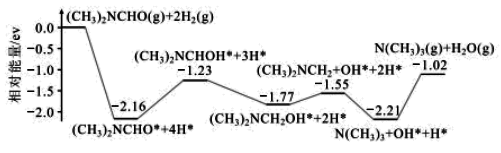
该历程中最大能垒(活化能)=__ eV,该步骤的化学方程式为__ 。
(2)该反应变化的ΔH__ 0(填“<”、“>”或“=”),制备三甲胺的热化学方程式为__ 。
(3)160℃时,将DMF(g)和H2(g)以物质的量之比为1:2充入盛有催化剂的刚性容器中,容器内起始压强为p0,达到平衡时DMF的转化率为25%,则该反应的平衡常数Kp=__ (Kp为以分压表示的平衡常数);能够增大DMF平衡转化率同时加快反应速率的操作是__ 。
(4)三甲胺是鱼腥臭的主要来源,是判断海水鱼类鲜度的化学指标之一。通过传感器产生的电流强度可以监测水产品中三甲胺的含量,一种燃料电池型三甲胺气体传感器的原理如图所示。外电路的电流方向为__ (填“a→b”或“b→a”),负极的电极反应式为__ 。
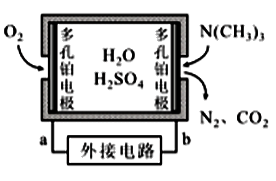
(1)结合实验与计算机模拟结果,研究单一DMF分子在铜催化剂表面的反应历程,如图所示:

该历程中最大能垒(活化能)=
(2)该反应变化的ΔH
(3)160℃时,将DMF(g)和H2(g)以物质的量之比为1:2充入盛有催化剂的刚性容器中,容器内起始压强为p0,达到平衡时DMF的转化率为25%,则该反应的平衡常数Kp=
(4)三甲胺是鱼腥臭的主要来源,是判断海水鱼类鲜度的化学指标之一。通过传感器产生的电流强度可以监测水产品中三甲胺的含量,一种燃料电池型三甲胺气体传感器的原理如图所示。外电路的电流方向为

您最近一年使用:0次
2020-03-14更新
|
723次组卷
|
3卷引用:武汉市2020届高中毕业生学生质量检测化学试题
武汉市2020届高中毕业生学生质量检测化学试题吉林省实验中学2022届高三下学期第二次模拟理综化学试题(已下线)01 化学反应原理综合题型集训之催化剂、活化能与反应历程(解析)-备战2023年高考化学大题逐空突破系列(全国通用)