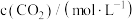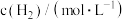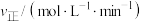1 . 碳达峰、碳中和是现在需要继续完成的环保任务, 的综合利用成为热点研究对象,
的综合利用成为热点研究对象, 作为碳源加氢是再生能源的有效方法,
作为碳源加氢是再生能源的有效方法, 加氢可以合成甲醇,
加氢可以合成甲醇, 提出“甲醇经济”概念,认为甲醇会在不久的将来扮演不可或缺的角色,通过
提出“甲醇经济”概念,认为甲醇会在不久的将来扮演不可或缺的角色,通过 加氢生产甲醇是有希望的可再生路线之一,该过程主要发生如下反应:
加氢生产甲醇是有希望的可再生路线之一,该过程主要发生如下反应:
反应I: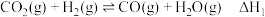
反应Ⅱ:
(1)①相关键能如下表,则
_______ ,该反应的活化能 (正)
(正)_______  (逆)(填“大于”“小于”或“等于”)。
(逆)(填“大于”“小于”或“等于”)。
②已知 的正反应速率
的正反应速率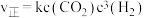 (k为正反应的速率常数),某温度时测得数据如下:
(k为正反应的速率常数),某温度时测得数据如下:
则此温度下,表中
______ 。
(2)据文献报道, 基纳米材料作为高性能催化剂可将
基纳米材料作为高性能催化剂可将 电还原为高能量密度的
电还原为高能量密度的 ,不同催化剂对生成
,不同催化剂对生成 的法拉第效率与电极电势的变化如图所示(已知法拉第效率是指实际生成物和理论生成物的百分比),为了保证生成甲醇的法拉第效率,最合适的电势及最佳催化剂是
的法拉第效率与电极电势的变化如图所示(已知法拉第效率是指实际生成物和理论生成物的百分比),为了保证生成甲醇的法拉第效率,最合适的电势及最佳催化剂是_______ 。 的转化率随温度和压强的变化如图,判断
的转化率随温度和压强的变化如图,判断 的大小关系:
的大小关系:__________ ;解释压强一定时, 的平衡转化率呈现如图变化的原因:
的平衡转化率呈现如图变化的原因:_________________ 。 ,向容积为
,向容积为 的恒容密闭容器中充入
的恒容密闭容器中充入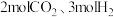 发生反应I、Ⅱ,平衡时
发生反应I、Ⅱ,平衡时 的转化率是
的转化率是 ,体系内剩余
,体系内剩余 ,则反应Ⅱ的平衡常数
,则反应Ⅱ的平衡常数
_______  ,体系内甲醇的平衡分压
,体系内甲醇的平衡分压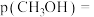
_____  (用含
(用含 的式子表示)。
的式子表示)。
 的综合利用成为热点研究对象,
的综合利用成为热点研究对象, 作为碳源加氢是再生能源的有效方法,
作为碳源加氢是再生能源的有效方法, 加氢可以合成甲醇,
加氢可以合成甲醇,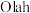 提出“甲醇经济”概念,认为甲醇会在不久的将来扮演不可或缺的角色,通过
提出“甲醇经济”概念,认为甲醇会在不久的将来扮演不可或缺的角色,通过 加氢生产甲醇是有希望的可再生路线之一,该过程主要发生如下反应:
加氢生产甲醇是有希望的可再生路线之一,该过程主要发生如下反应:反应I:
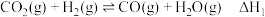
反应Ⅱ:

(1)①相关键能如下表,则

 (正)
(正) (逆)(填“大于”“小于”或“等于”)。
(逆)(填“大于”“小于”或“等于”)。化学键 |
|
|
|
|
键能 | 436 | 1071 | 464 | 803 |
 的正反应速率
的正反应速率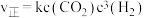 (k为正反应的速率常数),某温度时测得数据如下:
(k为正反应的速率常数),某温度时测得数据如下:
|
|
| |
1 | 0.02 | 0.01 |
|
2 | 0.02 | 0.02 | a |

(2)据文献报道,
 基纳米材料作为高性能催化剂可将
基纳米材料作为高性能催化剂可将 电还原为高能量密度的
电还原为高能量密度的 ,不同催化剂对生成
,不同催化剂对生成 的法拉第效率与电极电势的变化如图所示(已知法拉第效率是指实际生成物和理论生成物的百分比),为了保证生成甲醇的法拉第效率,最合适的电势及最佳催化剂是
的法拉第效率与电极电势的变化如图所示(已知法拉第效率是指实际生成物和理论生成物的百分比),为了保证生成甲醇的法拉第效率,最合适的电势及最佳催化剂是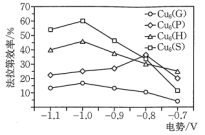
 的转化率随温度和压强的变化如图,判断
的转化率随温度和压强的变化如图,判断 的大小关系:
的大小关系: 的平衡转化率呈现如图变化的原因:
的平衡转化率呈现如图变化的原因:
 ,向容积为
,向容积为 的恒容密闭容器中充入
的恒容密闭容器中充入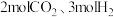 发生反应I、Ⅱ,平衡时
发生反应I、Ⅱ,平衡时 的转化率是
的转化率是 ,体系内剩余
,体系内剩余 ,则反应Ⅱ的平衡常数
,则反应Ⅱ的平衡常数
 ,体系内甲醇的平衡分压
,体系内甲醇的平衡分压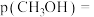
 (用含
(用含 的式子表示)。
的式子表示)。
您最近一年使用:0次
名校
2 . 甲醇是一种可再生能源,CO和CO2催化加氢制甲醇,是极具前景的温室气体资源化研究领域。
(1)已知在25℃,101kPa下:甲醇(l)的燃烧热为akJ·mol-1,CO(g)的燃烧热为bkJ·mol-1,H2O(g)=H2O(l) ΔH=+ckJ·mol-1。则甲醇(l)不完全燃烧生成一氧化碳和水蒸气的热化学方程式为___________ 。
(2)恒温恒压下,在容积可变的密闭容器中加入一定量的CO和H2发生反应
i.CO(g)+2H2(g) CH3OH(g) ΔH=-90.2 kJ·mol-1制备甲醇,测得平衡时CO的转化率(α)随温度、压强的变化如图所示:
CH3OH(g) ΔH=-90.2 kJ·mol-1制备甲醇,测得平衡时CO的转化率(α)随温度、压强的变化如图所示:
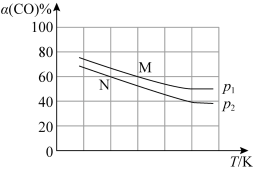
则P1___________ P2,M点的正反应速率___________ N点的逆反应速率。(填“>”、“<”或“=”)
(3)在某催化剂作用下,CO2和H2发生反应
ii: CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H2=-49.0 kJ·mol-1
iii:CO2(g)+H2(g) CO(g)+H2O(g) △H3=41.2 kJ·mol-1
CO(g)+H2O(g) △H3=41.2 kJ·mol-1
①维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得实验数据:
注:甲醇的选择性是指发生反应的CO2中转化为甲醇的百分比。
表中数据说明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是:___________ 。为减少副反应的发生,同时不降低CO2生成CH3OH的反应速率和平衡转化率,可采取的措施是___________ 。
(4)恒温恒压密闭容器中,加入2molCO2和4molH2,只发生反应ⅱ和反应ⅲ,初始压强为P0,在300℃发生反应,反应达平衡时,CO2的转化率为50%,容器体积减小25%,反应ⅱ的平衡常数Kp=___________ (kPa)-2(Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
(5)以甲醇为原料,通过电化学法可以合成碳酸二甲酯[(CH3O)2CO],工作原理如图所示。

①阳极的电极反应式为___________ 。
②若以铅蓄电池为电源,B应与铅蓄电池的___________ (填“Pb”或“PbO2” )相连。
(1)已知在25℃,101kPa下:甲醇(l)的燃烧热为akJ·mol-1,CO(g)的燃烧热为bkJ·mol-1,H2O(g)=H2O(l) ΔH=+ckJ·mol-1。则甲醇(l)不完全燃烧生成一氧化碳和水蒸气的热化学方程式为
(2)恒温恒压下,在容积可变的密闭容器中加入一定量的CO和H2发生反应
i.CO(g)+2H2(g)
 CH3OH(g) ΔH=-90.2 kJ·mol-1制备甲醇,测得平衡时CO的转化率(α)随温度、压强的变化如图所示:
CH3OH(g) ΔH=-90.2 kJ·mol-1制备甲醇,测得平衡时CO的转化率(α)随温度、压强的变化如图所示:
则P1
(3)在某催化剂作用下,CO2和H2发生反应
ii: CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H2=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H2=-49.0 kJ·mol-1iii:CO2(g)+H2(g)
 CO(g)+H2O(g) △H3=41.2 kJ·mol-1
CO(g)+H2O(g) △H3=41.2 kJ·mol-1①维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得实验数据:
| T(℃) | CO2实际转化率(%) | 甲醇选择性(%) |
| 243 | 12.3 | 42.3 |
| 253 | 15.3 | 39.1 |
表中数据说明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是:
(4)恒温恒压密闭容器中,加入2molCO2和4molH2,只发生反应ⅱ和反应ⅲ,初始压强为P0,在300℃发生反应,反应达平衡时,CO2的转化率为50%,容器体积减小25%,反应ⅱ的平衡常数Kp=
(5)以甲醇为原料,通过电化学法可以合成碳酸二甲酯[(CH3O)2CO],工作原理如图所示。

①阳极的电极反应式为
②若以铅蓄电池为电源,B应与铅蓄电池的
您最近一年使用:0次
2021-06-04更新
|
1188次组卷
|
8卷引用:陕西省西安工业大学附属中学2021-2022学年高三下学期第七次适应性训练理综化学试题
陕西省西安工业大学附属中学2021-2022学年高三下学期第七次适应性训练理综化学试题安徽省安庆市第一中学2021届高三第三次模拟考试理综化学试题(已下线)2021年秋季高三化学开学摸底考试卷03(广东专用)河北省实验中学2022届高三年级上学期开学考试化学试题河北省石家庄市第二中学2022届高三补偿诊断性考试新疆克拉玛依克拉玛依市独山子第二中学2021-2022学年高三上学期12月月考化学试题(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-讲义新疆维吾尔自治区阿克苏地区第二中学2022-2023学年高三上学期第一次月考化学试题
解题方法
3 . 以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。电解铝时阳极产生的CO2,可通过二氧化碳甲醇化再利用。请回答:
(1)已知:2Al2O3(s)=4Al(g)+3O2(g)△H1=+3 351kJ•mol﹣1
2C(s)+O2(g)=2CO(g)△H2=﹣221kJ•mol﹣1
2Al(g)+N2(g)=2AlN(s)△H3=﹣318kJ•mol﹣1
则碳热还原Al2O3合成氮化铝的总热化学方程式为_____ 。
(2)在常压,Ru/TiO2催化下,CO2和H2混合气体(体积比1:4,总物质的量a mol)进行反应,测得CO2的转化率、CH4和CO的选择性随温度的变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4和CO的百分比)。
反应Ⅰ:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)△H1
反应Ⅱ:CO2(g)+H2(g)⇌CO(g)+H2O(g)△H2

①下列说法不正确的是_____ (填序号)。
A.△H1小于零
B.温度可影响产物的选择性
C.CO2的平衡转化率随温度升高先增大后减少
D.其他条件不变将CO2和H2的初始体积比改变为1:3,可提高CO2的平衡转化率
②350℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器的体积为VL.则该温度下反应Ⅰ的平衡常数为____ (用a、V表示)。
③350℃时,CH4的物质的量随时间的变化曲线如图所示。画出400℃时,0~t1时间段内,CH4的物质的量随时间的变化曲线。____

(3)CO2和H2在一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),平衡常数K= .在容积为2L的密闭容器中,充入2 mol CO2和6 mol H2,恒温恒容时达到平衡。相同条件下,在另一个2 L的密闭容器中充入a mol CO2、b mol H2、c mol CH3OH、d mol H2O(g),要使两容器达到相同的平衡状态,且起始时反应逆向进行,则d的取值范围为
.在容积为2L的密闭容器中,充入2 mol CO2和6 mol H2,恒温恒容时达到平衡。相同条件下,在另一个2 L的密闭容器中充入a mol CO2、b mol H2、c mol CH3OH、d mol H2O(g),要使两容器达到相同的平衡状态,且起始时反应逆向进行,则d的取值范围为_____ 。
(4)研究表明,CO2可以在硫酸溶液中用情性电极电解生成甲醇,则生成甲醇的电极反应式为_____ 。
(1)已知:2Al2O3(s)=4Al(g)+3O2(g)△H1=+3 351kJ•mol﹣1
2C(s)+O2(g)=2CO(g)△H2=﹣221kJ•mol﹣1
2Al(g)+N2(g)=2AlN(s)△H3=﹣318kJ•mol﹣1
则碳热还原Al2O3合成氮化铝的总热化学方程式为
(2)在常压,Ru/TiO2催化下,CO2和H2混合气体(体积比1:4,总物质的量a mol)进行反应,测得CO2的转化率、CH4和CO的选择性随温度的变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4和CO的百分比)。
反应Ⅰ:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)△H1
反应Ⅱ:CO2(g)+H2(g)⇌CO(g)+H2O(g)△H2

①下列说法不正确的是
A.△H1小于零
B.温度可影响产物的选择性
C.CO2的平衡转化率随温度升高先增大后减少
D.其他条件不变将CO2和H2的初始体积比改变为1:3,可提高CO2的平衡转化率
②350℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器的体积为VL.则该温度下反应Ⅰ的平衡常数为
③350℃时,CH4的物质的量随时间的变化曲线如图所示。画出400℃时,0~t1时间段内,CH4的物质的量随时间的变化曲线。

(3)CO2和H2在一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),平衡常数K=
 .在容积为2L的密闭容器中,充入2 mol CO2和6 mol H2,恒温恒容时达到平衡。相同条件下,在另一个2 L的密闭容器中充入a mol CO2、b mol H2、c mol CH3OH、d mol H2O(g),要使两容器达到相同的平衡状态,且起始时反应逆向进行,则d的取值范围为
.在容积为2L的密闭容器中,充入2 mol CO2和6 mol H2,恒温恒容时达到平衡。相同条件下,在另一个2 L的密闭容器中充入a mol CO2、b mol H2、c mol CH3OH、d mol H2O(g),要使两容器达到相同的平衡状态,且起始时反应逆向进行,则d的取值范围为(4)研究表明,CO2可以在硫酸溶液中用情性电极电解生成甲醇,则生成甲醇的电极反应式为
您最近一年使用:0次
名校
解题方法
4 . 二氧化碳和氨是重要的化工产品,是纯碱工业、制造硝酸、铵盐和氮肥等的原料。
(1)CO2的电子式是________________ 。
(2)以NH3与CO2为原料合成尿素[化学式为CO(NH2)2]的主要反应如下:
① 2NH3(g)+CO2(g) = NH2CO2NH4(s) △H=-l59.5 kJ·mol-1
② NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) △H="+116.5" kJ·mol-1
CO(NH2)2(s)+H2O(g) △H="+116.5" kJ·mol-1
③ H2O(1) =H2O(g) △H=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式_______________ ;
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905kJ·mol-1
4NO(g)+6H2O(g) △H=-905kJ·mol-1
不同温度下NO产率如下图1所示,由此图可知温度对NO产率的影响规律为______________ ,请用化学反应速率和化学平衡理论解释其原因:____________________ 。
(4)以NO2、O2、熔融NaNO3组成的燃料电池装置如图2所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关石墨I电极反应可表示为_______________ 。
(1)CO2的电子式是
(2)以NH3与CO2为原料合成尿素[化学式为CO(NH2)2]的主要反应如下:
① 2NH3(g)+CO2(g) = NH2CO2NH4(s) △H=-l59.5 kJ·mol-1
② NH2CO2NH4(s)
 CO(NH2)2(s)+H2O(g) △H="+116.5" kJ·mol-1
CO(NH2)2(s)+H2O(g) △H="+116.5" kJ·mol-1③ H2O(1) =H2O(g) △H=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) △H=-905kJ·mol-1
4NO(g)+6H2O(g) △H=-905kJ·mol-1不同温度下NO产率如下图1所示,由此图可知温度对NO产率的影响规律为
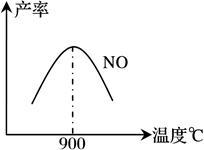
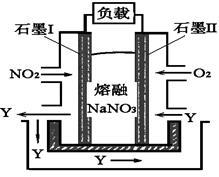
(4)以NO2、O2、熔融NaNO3组成的燃料电池装置如图2所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关石墨I电极反应可表示为
(5)已知常温下NH3·H2O的电离平衡常数K=1.75×10-5,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11。 常温下,用氨水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液显 NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=
您最近一年使用:0次
2016-12-09更新
|
537次组卷
|
3卷引用:2017届陕西省西藏民族学院附属中学高三下学期周练(四)理科综合化学试卷