名校
1 . 中国科学家首次实现了二氧化碳到淀粉的从头合成,CO2的捕集、利用与封存成为科学家研究的重要课题。
以CO2、C2H6为原料合成C2H4涉及的主要反应如下:
I.CO2(g)+C2H6(g) C2H4(g)+H2O(g)+CO(g) ΔH=+177kJ·mol-1 (主反应)
C2H4(g)+H2O(g)+CO(g) ΔH=+177kJ·mol-1 (主反应)
II.C2H6(g) CH4(g)+H2(g)+C(s) ΔH=+9kJ·mol-1 (副反应)
CH4(g)+H2(g)+C(s) ΔH=+9kJ·mol-1 (副反应)
(1)反应I的反应历程可分为如下两步:
i. C2H6(g) C2H4(g)+H2(g) ΔH1 (反应速率较快)
C2H4(g)+H2(g) ΔH1 (反应速率较快)
ii. H2(g)+CO2(g) H2O(g)+CO(g) ΔH2=+44kJ·mol-1 (反应速率较慢)
H2O(g)+CO(g) ΔH2=+44kJ·mol-1 (反应速率较慢)
①∆H1=_______
②相比于提高c(C2H6),提高c(CO2)对反应I速率影响更大,原因是_______ 。
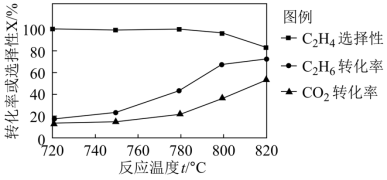
(2)向恒压密闭容器中充入CO2和C2H6合成C2H4,发生主反应,温度对催化剂K-Fe-Mn/Si-2性能的影响如图所示,工业生产综合各方面的因素,反应选择800℃的原因是_______ 。 C2H4(g)+2H2(g) ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
C2H4(g)+2H2(g) ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示: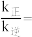
____ (用含有x的代数式表示);当温度升高时,k正增大m倍,k逆增大n倍,则m_____ n(填“>”、“<”或“=”)。
以CO2、C2H6为原料合成C2H4涉及的主要反应如下:
I.CO2(g)+C2H6(g)
 C2H4(g)+H2O(g)+CO(g) ΔH=+177kJ·mol-1 (主反应)
C2H4(g)+H2O(g)+CO(g) ΔH=+177kJ·mol-1 (主反应)II.C2H6(g)
 CH4(g)+H2(g)+C(s) ΔH=+9kJ·mol-1 (副反应)
CH4(g)+H2(g)+C(s) ΔH=+9kJ·mol-1 (副反应)(1)反应I的反应历程可分为如下两步:
i. C2H6(g)
 C2H4(g)+H2(g) ΔH1 (反应速率较快)
C2H4(g)+H2(g) ΔH1 (反应速率较快)ii. H2(g)+CO2(g)
 H2O(g)+CO(g) ΔH2=+44kJ·mol-1 (反应速率较慢)
H2O(g)+CO(g) ΔH2=+44kJ·mol-1 (反应速率较慢)①∆H1=
②相比于提高c(C2H6),提高c(CO2)对反应I速率影响更大,原因是
(2)向恒压密闭容器中充入CO2和C2H6合成C2H4,发生主反应,温度对催化剂K-Fe-Mn/Si-2性能的影响如图所示,工业生产综合各方面的因素,反应选择800℃的原因是
 C2H4(g)+2H2(g) ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
C2H4(g)+2H2(g) ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示: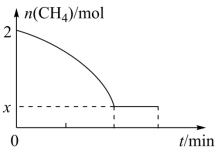
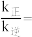
您最近一年使用:0次
2 . 以 为原料合成甲醇可以减少
为原料合成甲醇可以减少 的排放,实现碳的循环利用。一种
的排放,实现碳的循环利用。一种 催化剂对该反应有良好的催化效果。
催化剂对该反应有良好的催化效果。
Ⅰ.催化剂的合成
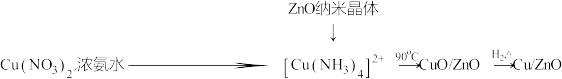
(1)氨水与 的反应
的反应___________ (填“属于”或“不属于”)氧化还原反应。
(2)补全上述过程中生成 的离子方程式:
的离子方程式:
Ⅱ.催化剂的性能测试
一定条件下使 、
、 混合气体通过反应器,检测反应器出口气体的成分及其含量,计算
混合气体通过反应器,检测反应器出口气体的成分及其含量,计算 的转化率和
的转化率和 的选择性以评价催化剂的性能。
的选择性以评价催化剂的性能。
已知:ⅰ。反应器内发生的反应有:
a.
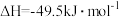
b.
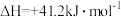
ⅱ. 选择性
选择性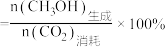
(3)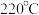 时,测得反应器出口气体中全部含碳物质的物质的量之比
时,测得反应器出口气体中全部含碳物质的物质的量之比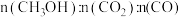
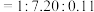 ,则该温度下
,则该温度下 转化率=
转化率=___________ 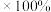 (列出计算式)。
(列出计算式)。
(4)其他条件相同时,反应温度对 的转化率和
的转化率和 的选择性的影响如下图所示:
的选择性的影响如下图所示:

①由图1可知实验中反应均未达到化学平衡状态的依据是___________ 。
②温度高于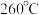 时,
时, 平衡转化率变化的原因是
平衡转化率变化的原因是___________ 。
③温度相同时, 选择性的实验值略高于平衡值(见图2),从化学反应速率的角度解释原因:
选择性的实验值略高于平衡值(见图2),从化学反应速率的角度解释原因:___________ 。
 为原料合成甲醇可以减少
为原料合成甲醇可以减少 的排放,实现碳的循环利用。一种
的排放,实现碳的循环利用。一种 催化剂对该反应有良好的催化效果。
催化剂对该反应有良好的催化效果。Ⅰ.催化剂的合成
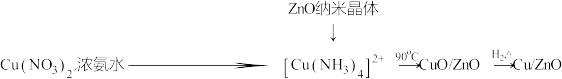
(1)氨水与
 的反应
的反应(2)补全上述过程中生成
 的离子方程式:
的离子方程式:

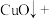
Ⅱ.催化剂的性能测试
一定条件下使
 、
、 混合气体通过反应器,检测反应器出口气体的成分及其含量,计算
混合气体通过反应器,检测反应器出口气体的成分及其含量,计算 的转化率和
的转化率和 的选择性以评价催化剂的性能。
的选择性以评价催化剂的性能。已知:ⅰ。反应器内发生的反应有:
a.

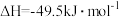
b.

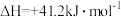
ⅱ.
 选择性
选择性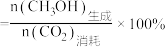
(3)
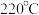 时,测得反应器出口气体中全部含碳物质的物质的量之比
时,测得反应器出口气体中全部含碳物质的物质的量之比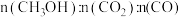
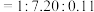 ,则该温度下
,则该温度下 转化率=
转化率=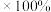 (列出计算式)。
(列出计算式)。(4)其他条件相同时,反应温度对
 的转化率和
的转化率和 的选择性的影响如下图所示:
的选择性的影响如下图所示:
①由图1可知实验中反应均未达到化学平衡状态的依据是
②温度高于
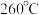 时,
时, 平衡转化率变化的原因是
平衡转化率变化的原因是③温度相同时,
 选择性的实验值略高于平衡值(见图2),从化学反应速率的角度解释原因:
选择性的实验值略高于平衡值(见图2),从化学反应速率的角度解释原因:
您最近一年使用:0次
名校
解题方法
3 . 工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖。工业合成氨生产示意图如图所示。
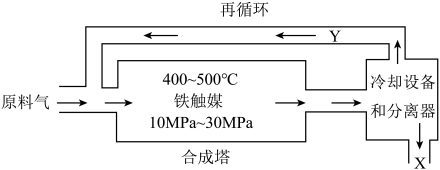
(1)下列有关合成氨工业的说法正确的是___________
(2)循环利用的Y是氮气和氢气,目的是___________ 。
(3)在合成氨工业中,要使氨的产率增大,同时又能提高反应速率,可采取的措施有___________ (填编号)。
①使用催化剂 ②恒温恒容,增大原料气 和
和 充入量 ③及时分离产生的
充入量 ③及时分离产生的
④升高温度 ⑤恒温恒容,充入惰性气体 使压强增大
使压强增大
(4)氮的固定和氮的循环是几百年来科学家一直研究的课题。下表列举了不同温度下大气固氮和工业固氮的部分 值。
值。
分析数据可知:
①在 下模拟工业固氮,某时刻
下模拟工业固氮,某时刻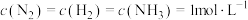 ,此时v正
,此时v正___________ v逆(填“>”“<”或“=”)。
②人类不适合大规模模拟大气固氮的原因是___________ 。
(5)哈伯1908年发表的文献中写到,在高温下,铁和铂都能作为使气态氨分解成为氢气、氮气的催化剂,下面是他做过的实验中的两组(条件都为901℃和3039.75 kPa)。
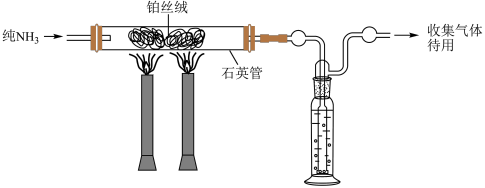
①使纯氨气通过白炽的铂丝,剩余的氨用浓硫酸洗涤除去。然后使气态混合物在相同条件下通过铁催化剂,出来的气体再缓缓通过20mL盐酸除去氨气。用气量计测得标准状况下剩余干燥气体的体积为2.02L。盐酸溶液用KOH溶液滴定,最终计算得到通入盐酸前氨气为1.86×10-4mol。
计算回答:在901℃下,N2 (g)+ 3H2 (g)
(g) 2NH3(g)的Kp=
2NH3(g)的Kp=___________ kPa-2。(保留一位有效数字)
②使纯氨气直接通过同一铁催化剂,出来的气体同样缓缓通入20mL盐酸,用气量计测得标准状况下剩余干燥气体的体积为1.82L。同理可以滴定后计算出通入盐酸前氨气的量,进而计算出Kp。在操作、计算误差合理的范围内,①、②得到的Kp基本相等。这对你有何启发?___________ 。

(1)下列有关合成氨工业的说法正确的是___________
| A.工业合成氨的反应是熵减小的放热反应,在低温时可自发进行 |
| B.合成氨反应中,反应物的总键能小于产物的总键能 |
C.合成氨厂一般采用的压强为 ,因为该压强下铁触媒的活性最高 ,因为该压强下铁触媒的活性最高 |
D. 的量越多, 的量越多, 的转化率越大,因此,充入的 的转化率越大,因此,充入的 越多越有利于 越多越有利于 的合成 的合成 |
(2)循环利用的Y是氮气和氢气,目的是
(3)在合成氨工业中,要使氨的产率增大,同时又能提高反应速率,可采取的措施有
①使用催化剂 ②恒温恒容,增大原料气
 和
和 充入量 ③及时分离产生的
充入量 ③及时分离产生的
④升高温度 ⑤恒温恒容,充入惰性气体
 使压强增大
使压强增大(4)氮的固定和氮的循环是几百年来科学家一直研究的课题。下表列举了不同温度下大气固氮和工业固氮的部分
 值。
值。| 反应 | 大气固氮 | 工业固氮 | |||
温度 | 27 | 2000 | 25 | 400 | 450 |
 |  | 0.1 | 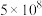 | 0.507 | 0.152 |
①在
 下模拟工业固氮,某时刻
下模拟工业固氮,某时刻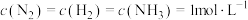 ,此时v正
,此时v正②人类不适合大规模模拟大气固氮的原因是
(5)哈伯1908年发表的文献中写到,在高温下,铁和铂都能作为使气态氨分解成为氢气、氮气的催化剂,下面是他做过的实验中的两组(条件都为901℃和3039.75 kPa)。

①使纯氨气通过白炽的铂丝,剩余的氨用浓硫酸洗涤除去。然后使气态混合物在相同条件下通过铁催化剂,出来的气体再缓缓通过20mL盐酸除去氨气。用气量计测得标准状况下剩余干燥气体的体积为2.02L。盐酸溶液用KOH溶液滴定,最终计算得到通入盐酸前氨气为1.86×10-4mol。
计算回答:在901℃下,N2 (g)+ 3H2
 (g)
(g) 2NH3(g)的Kp=
2NH3(g)的Kp=②使纯氨气直接通过同一铁催化剂,出来的气体同样缓缓通入20mL盐酸,用气量计测得标准状况下剩余干燥气体的体积为1.82L。同理可以滴定后计算出通入盐酸前氨气的量,进而计算出Kp。在操作、计算误差合理的范围内,①、②得到的Kp基本相等。这对你有何启发?
您最近一年使用:0次
2023-10-26更新
|
25次组卷
|
2卷引用:四川省蓬溪中学校2023-2024学年高二上学期10月月考化学试题
4 . 硫及其化合物的综合利用是化学研究的热点领域。回答下列问题:
(1)已知:H2S的燃烧热△H1=-586kJ/mol;硫的燃烧热△H2=-297kJ/mol。25℃、101kPa时,1molH2S不完全燃烧生成固态S和液态H2O的反应热△H3=___ kJ/mol
(2)SO2催化氧化制SO3,是重要化工反应。该反应用V2O5,作为催化剂,催化反应过程如下图所示。该反应加入催化剂后正反应的活化能为___ 。加入催化剂能提高该反应的化学反应速率的原因是___ 。

(3)工业上在接触室中用SO2与空气中O2反应制取SO3.原料气中各成分的体积分数为:SO2~7%,O2~11%,氮气~82%时,温度及压强对SO2平衡转化率的影响如下表所示。

从表中数据分析,工业上采取400℃~500℃、1MPa条件下合成SO3的原因是____ 。在T℃、1MPa条件下,SO2的平衡转化率为x,压强平衡常数Kp=___ (写出计算式即可)。(以分压代替物质的量浓度,分压=总压×物质的量分数)。
(4)锂—硫电池是重要的新型储能可逆电池,其构造如图所示。

电池充电时,与电源负极所连电极发生的电极反应为___ ,在电池放电时,电池右边电极依次发生Li2S8→Li2S6→Li2S4→Li2S2→Li2S系列转化。若放电前,图右边电极中Li2Sx只有Li2S8,放电后生成产物Li2S、Li2S2物质的量之比为6:1,则1mol Li2S8反应得到的电子数为____ 。
(1)已知:H2S的燃烧热△H1=-586kJ/mol;硫的燃烧热△H2=-297kJ/mol。25℃、101kPa时,1molH2S不完全燃烧生成固态S和液态H2O的反应热△H3=
(2)SO2催化氧化制SO3,是重要化工反应。该反应用V2O5,作为催化剂,催化反应过程如下图所示。该反应加入催化剂后正反应的活化能为

(3)工业上在接触室中用SO2与空气中O2反应制取SO3.原料气中各成分的体积分数为:SO2~7%,O2~11%,氮气~82%时,温度及压强对SO2平衡转化率的影响如下表所示。

从表中数据分析,工业上采取400℃~500℃、1MPa条件下合成SO3的原因是
(4)锂—硫电池是重要的新型储能可逆电池,其构造如图所示。

电池充电时,与电源负极所连电极发生的电极反应为
您最近一年使用:0次
5 . 以 、
、 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:
反应Ⅰ:
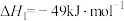
反应Ⅱ:
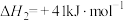
反应Ⅲ:
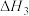
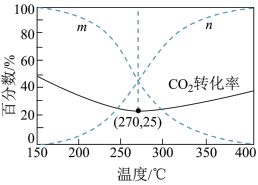
在5MPa下,按照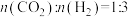 投料,平衡时,CO和
投料,平衡时,CO和 在含碳产物中物质的量分数及
在含碳产物中物质的量分数及 的转化率随温度的变化如图。下列说法正确的是
的转化率随温度的变化如图。下列说法正确的是
 、
、 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:反应Ⅰ:

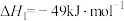
反应Ⅱ:

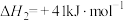
反应Ⅲ:

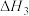
在5MPa下,按照
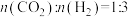 投料,平衡时,CO和
投料,平衡时,CO和 在含碳产物中物质的量分数及
在含碳产物中物质的量分数及 的转化率随温度的变化如图。下列说法正确的是
的转化率随温度的变化如图。下列说法正确的是
| A.反应Ⅲ中反应物的总键能大于生成物的总键能 |
B.曲线 代表CO在含碳产物中物质的量分数 代表CO在含碳产物中物质的量分数 |
C.该条件下温度越低,越有利于工业生产 |
D.图示270℃时,平衡体系中 的体积分数约为66.6% 的体积分数约为66.6% |
您最近一年使用:0次
2023-04-25更新
|
265次组卷
|
2卷引用:江苏省常州市金坛区2022-2023学年高二下学期期中质量调研化学试题
解题方法
6 . 固体燃料是目前我国合成氨生产的主要原料,随着煤气化技术的进步,多煤种均可作为合成氨的原料。以煤为原料的合成氨生产流程由三个基本部分组成:
(1)原料气的制备过程中主要发生反应:
I.
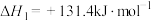
Ⅱ.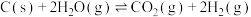
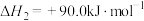
图1为碳与水蒸气反应的平衡常数与温度的关系图,图2表示了氧煤比对气化过程的影响,氧煤比的大小是影响气化炉温度、碳转化率、煤中有效气体(CO+H2)含量高低的重要因素。
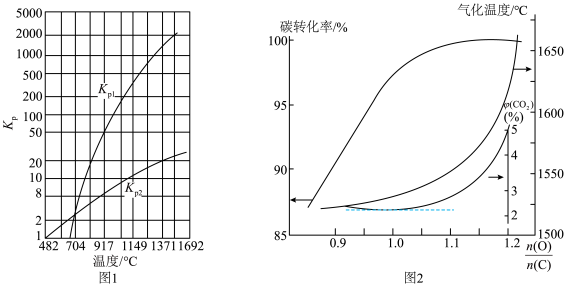
①由图1可知,高温有利于提高___________ 和___________ 的含量。
②试分析原料气制备过程中通入O2的原因:___________ ;由图可知,合适的氧煤比 应保证在
应保证在___________ 左右。
(2)原料气的净化过程中,脱碳工序须将CO2去除。N-甲基二乙醇胺(简称MDEA,分子式可简写为R2CH3N)水溶液因其选择性高、溶剂消耗少、对设备腐蚀小、可再生等优点被广泛使用。MDEA吸收CO2的反应可表示为: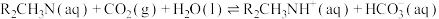
①脱碳工序可防止CO2在低温下固化变为干冰,堵塞设备和管道,还可防止___________ 。
②从结构角度分析MDEA具有碱性的原因:___________ 。
③标准平衡常数 可以表示平衡时各物质的浓度关系:如反应
可以表示平衡时各物质的浓度关系:如反应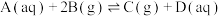 的
的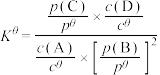 ,其中
,其中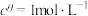 ,
,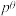 为标准大气压,
为标准大气压, 、
、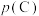 分别为气体的分压,分压=气体物质的量分数×总压。在T℃时的刚性密闭容器中,用20L2.3mol/L的MDEA溶液吸收总压为
分别为气体的分压,分压=气体物质的量分数×总压。在T℃时的刚性密闭容器中,用20L2.3mol/L的MDEA溶液吸收总压为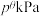 的合成氨原料气(含体积分数分别为30%的N2、55%的H2、15%的CO2),充分吸收后,MDEA浓度降低为2.0mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数
的合成氨原料气(含体积分数分别为30%的N2、55%的H2、15%的CO2),充分吸收后,MDEA浓度降低为2.0mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数
___________ (保留2位有效数字)。
(3)影响合成氨工艺条件的主要因素是空间速度(单位时间内通过单位体积催化剂的气量,简称空速)、反应温度、合成压力和气体组成等。目前30MPa的中压法合成塔,空速一般为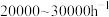 ,原因是
,原因是___________ 。
| 原料气的制备 | → | 原料气的净化 | → | 气体的压缩与氨的合成 |
(1)原料气的制备过程中主要发生反应:
I.

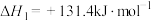
Ⅱ.
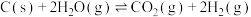
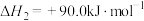
图1为碳与水蒸气反应的平衡常数与温度的关系图,图2表示了氧煤比对气化过程的影响,氧煤比的大小是影响气化炉温度、碳转化率、煤中有效气体(CO+H2)含量高低的重要因素。

①由图1可知,高温有利于提高
②试分析原料气制备过程中通入O2的原因:
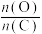 应保证在
应保证在(2)原料气的净化过程中,脱碳工序须将CO2去除。N-甲基二乙醇胺(简称MDEA,分子式可简写为R2CH3N)水溶液因其选择性高、溶剂消耗少、对设备腐蚀小、可再生等优点被广泛使用。MDEA吸收CO2的反应可表示为:
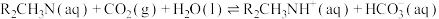
①脱碳工序可防止CO2在低温下固化变为干冰,堵塞设备和管道,还可防止
②从结构角度分析MDEA具有碱性的原因:
③标准平衡常数
 可以表示平衡时各物质的浓度关系:如反应
可以表示平衡时各物质的浓度关系:如反应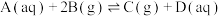 的
的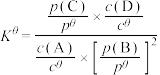 ,其中
,其中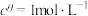 ,
,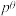 为标准大气压,
为标准大气压, 、
、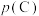 分别为气体的分压,分压=气体物质的量分数×总压。在T℃时的刚性密闭容器中,用20L2.3mol/L的MDEA溶液吸收总压为
分别为气体的分压,分压=气体物质的量分数×总压。在T℃时的刚性密闭容器中,用20L2.3mol/L的MDEA溶液吸收总压为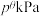 的合成氨原料气(含体积分数分别为30%的N2、55%的H2、15%的CO2),充分吸收后,MDEA浓度降低为2.0mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数
的合成氨原料气(含体积分数分别为30%的N2、55%的H2、15%的CO2),充分吸收后,MDEA浓度降低为2.0mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数
(3)影响合成氨工艺条件的主要因素是空间速度(单位时间内通过单位体积催化剂的气量,简称空速)、反应温度、合成压力和气体组成等。目前30MPa的中压法合成塔,空速一般为
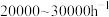 ,原因是
,原因是
您最近一年使用:0次
7 . 合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)化学家Gerhard Ertl证实了氢气与氮气在固体催化剂表面合成氨的过程,其示意图如图:
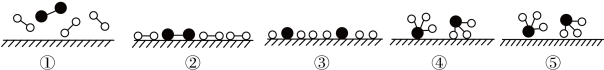
下列说法不正确的是_______(填字母)。
(2)研究表明金属催化剂可加速氨气的分解。下表为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率( )。
)。
不同催化剂存在下,氨气分解反应活化能最大的是_______ (填催化剂的化学式)。
(3)下列关于合成氨工艺的理解,正确的是_______(填字母)。
(4)如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1∶3时,平衡混合物中氨的体积分数 。
。
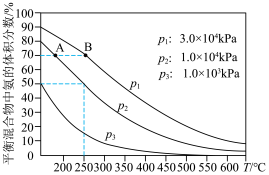
①若分别用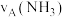 和
和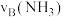 表示从反应开始至达平衡状态
表示从反应开始至达平衡状态 时的化学反应速率,则
时的化学反应速率,则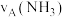
_______ (填“>”“<”或“=”)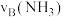 。
。
②在 、
、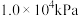 ,
, 的转化率为
的转化率为_______  (计算结果保留小数点后1位)。
(计算结果保留小数点后1位)。
(5) 和
和 在铁做催化剂作用下从
在铁做催化剂作用下从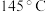 就开始反应,随着温度上升,单位时间内
就开始反应,随着温度上升,单位时间内 产率增大,但温度高于
产率增大,但温度高于 后,单位时间内
后,单位时间内 产率逐渐下降的原因是
产率逐渐下降的原因是_______ 。
(1)化学家Gerhard Ertl证实了氢气与氮气在固体催化剂表面合成氨的过程,其示意图如图:

下列说法不正确的是_______(填字母)。
A.①表示 分子中均是单键 分子中均是单键 |
| B.②→③需要吸收能量 |
C.若 在催化剂表面的吸附和分解速率慢,是决速步骤,可以适当增大 在催化剂表面的吸附和分解速率慢,是决速步骤,可以适当增大 浓度,提高整体反应的速率 浓度,提高整体反应的速率 |
| D.当温度和体积一定时,在原料气中添加少量惰性气体,有利于提高平衡转化率 |
(2)研究表明金属催化剂可加速氨气的分解。下表为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率(
 )。
)。| 催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
| 初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
(3)下列关于合成氨工艺的理解,正确的是_______(填字母)。
| A.合成氨工业常采用的反应温度为700K左右,可用勒·夏特列原理解释 |
B.使用初始反应速率更快的催化剂Ru,能提高平衡时 的产量 的产量 |
C.合成氨工业采用10~30MPa,是因常压下 和 和 的转化率不高 的转化率不高 |
D.采用冷水降温的方法可将合成后混合气体中的氨液化(提示:101kPa时, 的沸点是-33.5℃) 的沸点是-33.5℃) |
(4)如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1∶3时,平衡混合物中氨的体积分数
 。
。
①若分别用
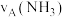 和
和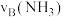 表示从反应开始至达平衡状态
表示从反应开始至达平衡状态 时的化学反应速率,则
时的化学反应速率,则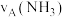
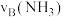 。
。②在
 、
、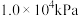 ,
, 的转化率为
的转化率为 (计算结果保留小数点后1位)。
(计算结果保留小数点后1位)。(5)
 和
和 在铁做催化剂作用下从
在铁做催化剂作用下从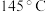 就开始反应,随着温度上升,单位时间内
就开始反应,随着温度上升,单位时间内 产率增大,但温度高于
产率增大,但温度高于 后,单位时间内
后,单位时间内 产率逐渐下降的原因是
产率逐渐下降的原因是
您最近一年使用:0次
解题方法
8 . 以天然气为主要原料合成氨工艺流程大致分为三步:
第一步:原料气的制备。在Ni的催化作用下,天然气主要成分CH4发生如下反应:
①CH4(g)+H2O(g)⇌CO(g)+3H2(g)+Q1 (Q1<0);② CO(g)+H2O(g)⇌ CO2(g)+H2(g)+Q2
完成下列填空:
(1)天然气中的含硫化合物(如H2S、COS等)在反应前需除去的主要原因是___________ 。在恒温恒容条件下,欲提高反应①中CH4的反应速率和平衡转化率,可进一步采取的措施是(任写一个)___________ 。
(2)反应②平衡常数随温度变化如表:
a>b,则Q2___________ 0(选填“>”、“<”或“=”);若等物质的量的CO和H2O(g)发生该反应,进行到某一时刻,反应温度400℃,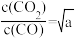 ,此时v正
,此时v正___________ v逆 (选填“>”、“<”或“=”)。
第二步:原料气的净化。在将氢氮原料气送入合成塔前必须净化,工业上用热K2CO3溶液吸收CO2。
(3)产物KHCO3溶液显___________ 性,理由是___________ 。用平衡移动原理解释吸收CO2的反应在加压下进行的原因。___________
第三步:原料气的压缩和氨的合成。将氢氮混合气压缩后在高温高压催化剂条件下合成氨气。
(4)若合成1 mol NH3(g)放热46.2kJ,画出合成氨反应的能量变化示意图________ 。

第一步:原料气的制备。在Ni的催化作用下,天然气主要成分CH4发生如下反应:
①CH4(g)+H2O(g)⇌CO(g)+3H2(g)+Q1 (Q1<0);② CO(g)+H2O(g)⇌ CO2(g)+H2(g)+Q2
完成下列填空:
(1)天然气中的含硫化合物(如H2S、COS等)在反应前需除去的主要原因是
(2)反应②平衡常数随温度变化如表:
| 温度/℃ | 500 | 800 |
| K | a | b |
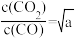 ,此时v正
,此时v正第二步:原料气的净化。在将氢氮原料气送入合成塔前必须净化,工业上用热K2CO3溶液吸收CO2。
(3)产物KHCO3溶液显
第三步:原料气的压缩和氨的合成。将氢氮混合气压缩后在高温高压催化剂条件下合成氨气。
(4)若合成1 mol NH3(g)放热46.2kJ,画出合成氨反应的能量变化示意图

您最近一年使用:0次
2020-12-29更新
|
156次组卷
|
2卷引用:上海市金山区2021届高三一模化学试题
9 . 研究氨的合成和分解对工业生产和防治污染有重要意义,回答下列问题:
(1)化学键键能数据如下:
氨分解反应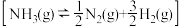 的活化能
的活化能 ,由此计算合成氨反应
,由此计算合成氨反应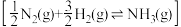 的活化能
的活化能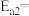
_______  。
。
(2)在Fe催化剂作用下由氮气和氢气直接合成氨的反应历程为(*表示吸附态):化学吸附: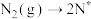 ;
;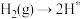 ;表面反应:
;表面反应: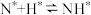 ;
; ;
; ;脱附:
;脱附: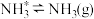 ;其中,
;其中, 的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。实际生产中,原料气中
的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。实际生产中,原料气中 和
和 物质的量之比为
物质的量之比为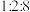 。从速率和转化率角度说明原料气中
。从速率和转化率角度说明原料气中 适度过量的理由:
适度过量的理由:
①速率角度:_______ ;
②转化率角度:_______ 。
(3)已知反应: 标准平衡常数
标准平衡常数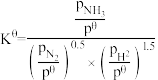 ,其中
,其中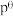 为标准压强(
为标准压强(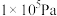 ),
),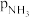 、
、 和
和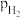 为各组分的平衡分压,如:
为各组分的平衡分压,如: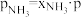 ,p为平衡总压,
,p为平衡总压,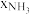 为平衡系统中
为平衡系统中 的物质的量分数。若
的物质的量分数。若 和
和 起始物质的量之比为
起始物质的量之比为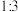 ,反应在恒定温度和标准压强下进行,
,反应在恒定温度和标准压强下进行, 的平衡转化率为
的平衡转化率为 ,则
,则
_______ (用含 的最简式表示)
的最简式表示)
(4)氨催化分解既可防治氨气污染,又能得到氢能源。在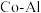 催化剂体系中,压强
催化剂体系中,压强 下氨气以一定流速通过反应器得到不同催化剂下相同时间内
下氨气以一定流速通过反应器得到不同催化剂下相同时间内 转化率随温度变化的关系如图所示。
转化率随温度变化的关系如图所示。

使活化能最小的催化剂为_______ ;温度一定时,如果增大气体流速,则b点对应的点可能是____ (填“a”“c”“d”“e”或“f”)。
(1)化学键键能数据如下:
| 化学键 | H—H | N≡N | N—H |
 | 436 | 946 | 391 |
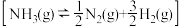 的活化能
的活化能 ,由此计算合成氨反应
,由此计算合成氨反应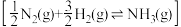 的活化能
的活化能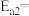
 。
。(2)在Fe催化剂作用下由氮气和氢气直接合成氨的反应历程为(*表示吸附态):化学吸附:
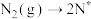 ;
;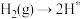 ;表面反应:
;表面反应: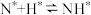 ;
; ;
; ;脱附:
;脱附: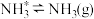 ;其中,
;其中, 的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。实际生产中,原料气中
的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。实际生产中,原料气中 和
和 物质的量之比为
物质的量之比为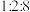 。从速率和转化率角度说明原料气中
。从速率和转化率角度说明原料气中 适度过量的理由:
适度过量的理由:①速率角度:
②转化率角度:
(3)已知反应:
 标准平衡常数
标准平衡常数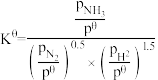 ,其中
,其中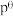 为标准压强(
为标准压强(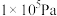 ),
),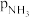 、
、 和
和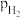 为各组分的平衡分压,如:
为各组分的平衡分压,如: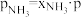 ,p为平衡总压,
,p为平衡总压,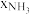 为平衡系统中
为平衡系统中 的物质的量分数。若
的物质的量分数。若 和
和 起始物质的量之比为
起始物质的量之比为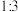 ,反应在恒定温度和标准压强下进行,
,反应在恒定温度和标准压强下进行, 的平衡转化率为
的平衡转化率为 ,则
,则
 的最简式表示)
的最简式表示)(4)氨催化分解既可防治氨气污染,又能得到氢能源。在
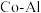 催化剂体系中,压强
催化剂体系中,压强 下氨气以一定流速通过反应器得到不同催化剂下相同时间内
下氨气以一定流速通过反应器得到不同催化剂下相同时间内 转化率随温度变化的关系如图所示。
转化率随温度变化的关系如图所示。
使活化能最小的催化剂为
您最近一年使用:0次
2020-12-20更新
|
339次组卷
|
2卷引用:湖南省长沙市长郡中学、师大附中、长沙市一中联考联合体2021届高三12月联考化学试题
名校
10 . 氨是一种重要的基础化工产品。
(1)合成氨的原料气( 及少量
及少量 的混合气)在进入合成塔前需除去
的混合气)在进入合成塔前需除去 ,原因是
,原因是___________ 。
原料气中的 常用甲烷水蒸气重整反应制备,涉及的主要反应如下:
常用甲烷水蒸气重整反应制备,涉及的主要反应如下:
反应Ⅰ:
反应Ⅱ: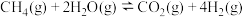
反应Ⅲ:
一定条件下,向体积为V的恒容容器中充入 甲烷和
甲烷和 水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则
水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则 的物质的量为
的物质的量为________  ,写出反应Ⅲ的平衡常数
,写出反应Ⅲ的平衡常数
___________ 。
(2) 与
与 作用分别生成
作用分别生成 的反应均为放热反应。工业尾气中的
的反应均为放热反应。工业尾气中的 可通过催化氧化为
可通过催化氧化为 除去。将一定比例的
除去。将一定比例的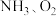 和
和 的混合气体以一定流速经过装有催化剂的反应管,
的混合气体以一定流速经过装有催化剂的反应管, 的转化率、
的转化率、 的选择性[
的选择性[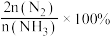 ]与温度的关系如图。
]与温度的关系如图。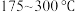 范围内升高温度,出口处氮氧化物的量
范围内升高温度,出口处氮氧化物的量________ (填“增大”或“减小), 的平衡转化率
的平衡转化率________ (填“增大”或“减小”)。
②为能更有效除去尾气中的 ,保护环境,应选择的最佳温度为
,保护环境,应选择的最佳温度为________ (填序号)。
A. B.
B. C.
C.
(3)氨气也可与氨的氧化物反应生成氮气,该反应可用于处理氮的氧化物。例如: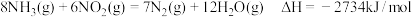 ,将
,将 和
和 以一定的流速,分别通过甲、乙两种催化剂发生上述反应,相同时间内测量逸出气体中
以一定的流速,分别通过甲、乙两种催化剂发生上述反应,相同时间内测量逸出气体中 含量,从而确定
含量,从而确定 的转化率,结果如图所示:
的转化率,结果如图所示:___________ (填“是”或“不是”)平衡状态,原因是___________ 。
(1)合成氨的原料气(
 及少量
及少量 的混合气)在进入合成塔前需除去
的混合气)在进入合成塔前需除去 ,原因是
,原因是原料气中的
 常用甲烷水蒸气重整反应制备,涉及的主要反应如下:
常用甲烷水蒸气重整反应制备,涉及的主要反应如下:反应Ⅰ:

反应Ⅱ:
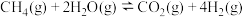
反应Ⅲ:

一定条件下,向体积为V的恒容容器中充入
 甲烷和
甲烷和 水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则
水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则 的物质的量为
的物质的量为 ,写出反应Ⅲ的平衡常数
,写出反应Ⅲ的平衡常数
(2)
 与
与 作用分别生成
作用分别生成 的反应均为放热反应。工业尾气中的
的反应均为放热反应。工业尾气中的 可通过催化氧化为
可通过催化氧化为 除去。将一定比例的
除去。将一定比例的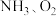 和
和 的混合气体以一定流速经过装有催化剂的反应管,
的混合气体以一定流速经过装有催化剂的反应管, 的转化率、
的转化率、 的选择性[
的选择性[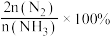 ]与温度的关系如图。
]与温度的关系如图。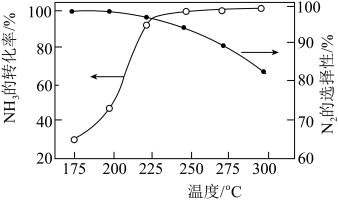
 范围内升高温度,出口处氮氧化物的量
范围内升高温度,出口处氮氧化物的量 的平衡转化率
的平衡转化率②为能更有效除去尾气中的
 ,保护环境,应选择的最佳温度为
,保护环境,应选择的最佳温度为A.
 B.
B. C.
C.
(3)氨气也可与氨的氧化物反应生成氮气,该反应可用于处理氮的氧化物。例如:
 ,将
,将 和
和 以一定的流速,分别通过甲、乙两种催化剂发生上述反应,相同时间内测量逸出气体中
以一定的流速,分别通过甲、乙两种催化剂发生上述反应,相同时间内测量逸出气体中 含量,从而确定
含量,从而确定 的转化率,结果如图所示:
的转化率,结果如图所示: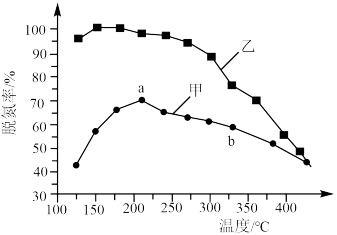
您最近一年使用:0次
2023-10-06更新
|
152次组卷
|
2卷引用:湖北省宜荆荆随2024届高三上学期10月联考化学试题



