湖南省长沙市长郡中学、师大附中、长沙市一中联考联合体2021届高三12月联考化学试题
湖南
高三
阶段练习
2020-12-27
628次
整体难度:
适中
考查范围:
常见无机物及其应用、化学反应原理、化学与STSE、认识化学科学、物质结构与性质、有机化学基础、化学实验基础
湖南省长沙市长郡中学、师大附中、长沙市一中联考联合体2021届高三12月联考化学试题
湖南
高三
阶段练习
2020-12-27
628次
整体难度:
适中
考查范围:
常见无机物及其应用、化学反应原理、化学与STSE、认识化学科学、物质结构与性质、有机化学基础、化学实验基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
名校
解题方法
1. 化学与生活密切相关。下列叙述正确的是
| A.电影银幕用水玻璃浸泡的主要目的是为了防火 |
| B.用加酶洗衣粉除去羊绒衫上的血渍 |
| C.活性炭具有除异味和杀菌作用 |
| D.用工业盐作融雪剂不会加快桥梁的腐蚀 |
您最近一年使用:0次
2020-12-20更新
|
275次组卷
|
3卷引用:湖南省长沙市长郡中学、师大附中、长沙市一中联考联合体2021届高三12月联考化学试题
单选题
|
适中(0.65)
2. 对于下列实验,能正确描述其反应的离子方程式是
A.电解 水溶液: 水溶液: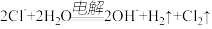 |
B.向 溶液中滴加少量苛性钾溶液: 溶液中滴加少量苛性钾溶液: |
C.向 溶液中通入少量 溶液中通入少量 : : |
D.向 溶液中通入少量 溶液中通入少量 : : |
您最近一年使用:0次
2020-12-20更新
|
155次组卷
|
2卷引用:湖南省长沙市长郡中学、师大附中、长沙市一中联考联合体2021届高三12月联考化学试题
单选题
|
适中(0.65)
解题方法
3. 短周期元素A、B、C、D、E、F的原子序数依次增大,其中A与E最外层电子数相同,B与F同主族,E与F电子层数相同。已知常温下单质A与E的状态不同,D的核电荷数是B的最外层电子数的2倍,化合物FB是第三代半导体材料的典型代表。则下列推断中正确的是推断中正确的是
| A.由A、C、D三种元素组成的化合物一定是共价化合物 |
| B.F与D形成的化合物性质很不活泼,不与任何酸反应 |
| C.原子半径由大到小的顺序是:E>F>C>D |
| D.元素的非金属性由强到弱的顺序是:D>C>F>B |
您最近一年使用:0次
2020-12-20更新
|
304次组卷
|
3卷引用:湖南省长沙市长郡中学、师大附中、长沙市一中联考联合体2021届高三12月联考化学试题
单选题
|
适中(0.65)
4. 用NCl3和NaClO2溶液制备绿色消毒剂ClO2气体的离子方程式为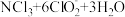
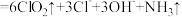 。已知NCl3易发生非氧化还原的水解反应:
。已知NCl3易发生非氧化还原的水解反应: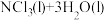
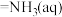
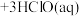 。下列有关说法错误的是
。下列有关说法错误的是
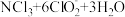
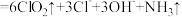 。已知NCl3易发生非氧化还原的水解反应:
。已知NCl3易发生非氧化还原的水解反应: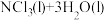
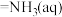
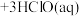 。下列有关说法错误的是
。下列有关说法错误的是A.NCl3的电子式为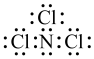 |
| B.制备 ClO2的离子反应中NCl3被还原为NH3 |
| C.氧化产物与还原产物的物质的量之比为2:1 |
| D.ClO2可用于自来水的杀菌消毒和面粉的漂白 |
【知识点】 氧化还原反应的几组概念解读 氧化还原反应的应用 氧化还原反应有关计算
您最近一年使用:0次
单选题
|
较易(0.85)
名校
解题方法
5. 下列叙述正确的是
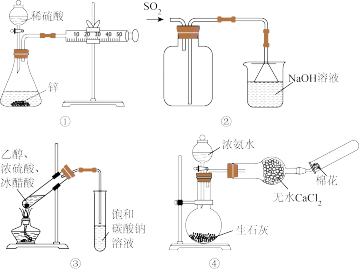

| A.用图①所示装置测定生成氢气的速率 | B.用图②所示装置收集SO2气体 |
| C.用图③所示装置制备乙酸乙酯 | D.用图④所示装置制取收集氨气 |
您最近一年使用:0次
2020-12-20更新
|
583次组卷
|
3卷引用:湖南省长沙市长郡中学、师大附中、长沙市一中联考联合体2021届高三12月联考化学试题
单选题
|
适中(0.65)
解题方法
6. 2019年,化学家第一次合成了具有特别光电特性的最长、最扭曲的十二苯取代并四苯,它是一个并四苯分子中的所有氢原子全部被苯环取代。下列叙述正确的是
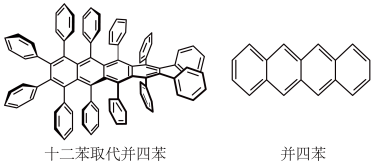

| A.并四苯是苯的同系物 | B.一溴并四苯有4种 |
| C.官能团均为碳碳双键 | D.十二苯取代并四苯的分子式为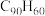 |
【知识点】 同系物的判断解读 有机化合物中碳的成键特征 苯分子结构的特点解读
您最近一年使用:0次
2020-12-20更新
|
488次组卷
|
4卷引用:湖南省长沙市长郡中学、师大附中、长沙市一中联考联合体2021届高三12月联考化学试题
湖南省长沙市长郡中学、师大附中、长沙市一中联考联合体2021届高三12月联考化学试题湖南省长沙市炎德英才2021届高三第三次月考联考化学试题(已下线)第1章 认识有机化合物(培优提升卷)-2020-2021学年高二化学选修5章末集训必刷卷(人教版)河南省洛阳市豫西名校2020-2021学年高二下学期第一次联考化学试题
单选题
|
适中(0.65)
名校
解题方法
7. 设NA为阿伏加德罗常数的值。下列有关说法错误的是
| A.11g硫化钾和过氧化钾的混合物中含有的离子数目为0.3NA |
| B.常温常压时,4g甲烷和8g甲醇含有的氢原子数均为NA |
| C.一定条件下,32g SO2与足量O2反应,转移电子数小于NA |
| D.标准状况下,1LpH=10的纯碱溶液中,水电离产生的OH-数目为10-4NA |
【知识点】 阿伏加德罗常数的应用解读 气体物质与NA相关的推算解读
您最近一年使用:0次
2020-12-20更新
|
245次组卷
|
3卷引用:湖南省长沙市长郡中学、师大附中、长沙市一中联考联合体2021届高三12月联考化学试题
8. 某矿石的成分为Cos、 ,某化学兴趣小组查阅资料后设计的回收钴和铜的工艺流程如图:
,某化学兴趣小组查阅资料后设计的回收钴和铜的工艺流程如图:
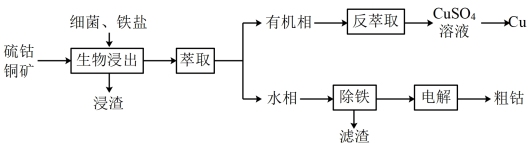
已知钴的金属性强于Cu弱于Fe,下列说法正确的是
 ,某化学兴趣小组查阅资料后设计的回收钴和铜的工艺流程如图:
,某化学兴趣小组查阅资料后设计的回收钴和铜的工艺流程如图:
已知钴的金属性强于Cu弱于Fe,下列说法正确的是
| A.“生物浸出”在较高温度下进行可以提高浸出率 |
| B.分液时,应将上层液体由分液漏斗下口放至另一烧杯中 |
| C.萃取振荡时,分液漏斗上口应倾斜向下 |
D.用KSCN溶液和新制氯水可以检验“水相”中的 |
您最近一年使用:0次
2022-05-09更新
|
268次组卷
|
8卷引用:湖南省长沙市长郡中学、师大附中、长沙市一中联考联合体2021届高三12月联考化学试题
湖南省长沙市长郡中学、师大附中、长沙市一中联考联合体2021届高三12月联考化学试题湖南省长沙市炎德英才2021届高三第三次月考联考化学试题湖北省孝感市孝感高级中学2021届高三2月调研考试化学试题湖南省怀化市第三中学2022届高三下学期第三次模拟预测化学试题(已下线)专题13 物质的反应和转化-2022年高考真题模拟题分项汇编湖南省蓝山县第二中学2021-2022学年高三下学期4月月考化学试题(已下线)素养卷08 微型化学工艺流程分析-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)安徽省合肥市肥东县综合高中2022-2023学年高三上学期期末考试化学试题
单选题
|
适中(0.65)
名校
解题方法
9. 蛇纹石主要成分为Mg6Si4O10(OH)8 (含少量NiO、Fe3O4等杂质),利用蛇纹石制备阻燃剂氢氧化镁的工艺流程如图所示:

下列说法错误的是

下列说法错误的是
| A.滤渣1的主要成分是H2SiO3 |
| B.反应Ⅰ中有置换反应和化合反应 |
| C.滤渣3溶于足量稀盐酸得到澄清溶液 |
| D.Mg(OH)2分解吸热生成高熔点MgO和水蒸气是其阻燃的主要原因 |
【知识点】 硅酸盐 物质分离、提纯综合应用解读 常见无机物的制备解读
您最近一年使用:0次
2020-12-20更新
|
250次组卷
|
4卷引用:湖南省长沙市长郡中学、师大附中、长沙市一中联考联合体2021届高三12月联考化学试题
湖南省长沙市长郡中学、师大附中、长沙市一中联考联合体2021届高三12月联考化学试题湖南省长沙市炎德英才2021届高三第三次月考联考化学试题(已下线)热点8 无机化工流程分析(选择题)-2021年高考化学【热点·重点·难点】专练(山东专用)湖南省邵东市第一中学2022-2023学年高三上学期第二次月考化学试题
单选题
|
适中(0.65)
名校
10. 镓的化学性质与铝相似,电解精炼法提纯镓(Ga)的原理如图所示。已知:金属活动顺序Zn>Ga>Fe。下列说法错误的是
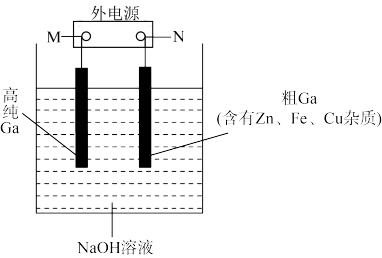

| A.阳极泥的主要成分是铁和铜 |
B.阴极反应为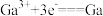 |
| C.若电压过高,阴极可能会产生H2导致电解效率下降 |
D.电流流向为:N极→粗 高纯 高纯 极 极 |
您最近一年使用:0次
2020-12-20更新
|
1042次组卷
|
5卷引用:湖南省长沙市长郡中学、师大附中、长沙市一中联考联合体2021届高三12月联考化学试题
二、多选题 添加题型下试题
多选题
|
较易(0.85)
解题方法
11. 下列实验步骤、现象、结论均正确且有因果关系的是
| 选项 | 实验步骤 | 实验现象 | 结论 |
| A | 用玻璃棒蘸取 溶液点在干燥pH试纸上 溶液点在干燥pH试纸上 | 试纸变蓝 | HClO为弱酸 |
| B | 光照一盛装甲烷和氯气混合气体的试管,并在试管口放置湿润的蓝色石蕊试纸 | 黄绿色褪去,试管内壁出现油状液体,瓶口有白雾,试纸变红 | 生成的一氯甲烷为气体 |
| C | 向稀硝酸与过量铜反应后的溶液 中滴加稀硫酸 | 铜溶解,有无色气体生成,遇空气变红棕色 | 铜与稀硝酸反应生成NO |
| D | 将乙醇和浓硫酸混合溶液加热到 ,并将产生的气体经过氢氧化钠溶液洗气,再通入溴水中 ,并将产生的气体经过氢氧化钠溶液洗气,再通入溴水中 | 溴水褪色 | 有乙烯生成 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-12-20更新
|
229次组卷
|
2卷引用:湖南省长沙市长郡中学、师大附中、长沙市一中联考联合体2021届高三12月联考化学试题
多选题
|
较易(0.85)
解题方法
12. 一种Pt单原子负载型 光催化剂可以最有效地对丙酮直接协同生产高附加值的HDN和氢气,示意图如下所示。下列说法正确的是
光催化剂可以最有效地对丙酮直接协同生产高附加值的HDN和氢气,示意图如下所示。下列说法正确的是

 光催化剂可以最有效地对丙酮直接协同生产高附加值的HDN和氢气,示意图如下所示。下列说法正确的是
光催化剂可以最有效地对丙酮直接协同生产高附加值的HDN和氢气,示意图如下所示。下列说法正确的是
| A.丙酮与氢气可发生加成反应生成2−丙醇 | B.HDN的化学名称是2,5−已二酮 |
| C.丙酮分子中最多有8个原子共平面 | D.丙酮的同分异构体不能使溴水褪色 |
您最近一年使用:0次
2020-12-20更新
|
187次组卷
|
2卷引用:湖南省长沙市长郡中学、师大附中、长沙市一中联考联合体2021届高三12月联考化学试题
多选题
|
适中(0.65)
名校
解题方法
13. 我国科学家构造了一种在纳米多孔聚丙烯膜上负载纳米多层级孔Ag的一体化薄膜电极(npm-Ag)和镍铁基电极,与商业化的太阳能电池相匹配,首次创造性地开发出了全程平均能量转换效率超过20%的二氧化碳(CO2)还原人工光合作用系统,示意图如下所示。下列说法错误的是
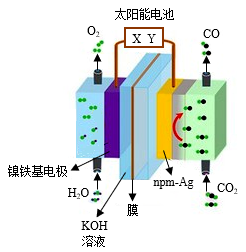

A.能量转化方式:太阳能 电能 电能 化学能 化学能 |
| B.Y是太阳能电池的正极 |
| C.工作一段时间后c(KOH)减小 |
D.总反应为:2CO2 O2+2CO O2+2CO |
您最近一年使用:0次
2020-12-20更新
|
176次组卷
|
3卷引用:湖南省长沙市长郡中学、师大附中、长沙市一中联考联合体2021届高三12月联考化学试题
三、单选题 添加题型下试题
单选题
|
适中(0.65)
14. “一锅法”用三氯化钌( )催化硝基苯(
)催化硝基苯( ,
,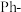 表示苯基)与醇(
表示苯基)与醇(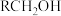 )反应为仲胺(
)反应为仲胺( ),反应过程如图所示,
),反应过程如图所示, 表示催化剂。
表示催化剂。

下列叙述错误的是
 )催化硝基苯(
)催化硝基苯( ,
,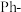 表示苯基)与醇(
表示苯基)与醇(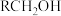 )反应为仲胺(
)反应为仲胺( ),反应过程如图所示,
),反应过程如图所示, 表示催化剂。
表示催化剂。
下列叙述错误的是
| A.RCHO既是反应中间体又是反应产物 |
B.存在反应 |
| C.反应过程中Ru的成键数目保持不变 |
D.还原反应的氢均来自于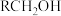 |
【知识点】 催化剂对化学反应速率的影响解读 化学键基本概念
您最近一年使用:0次
2020-12-20更新
|
205次组卷
|
2卷引用:湖南省长沙市长郡中学、师大附中、长沙市一中联考联合体2021届高三12月联考化学试题
单选题
|
较难(0.4)
15. 向Na2CO3和NaHCO3的混合溶液中加入少量Ca(NO3)2,测得溶液中离子浓度的关系如图所示,下列说法错误的是


| A.a、b、c三点对应的溶液中pH由小到大的顺序是c<b<a |
B.b点对应的溶液中存在:2c(Ca2+)+c(Na+)+c(H+)=3c(CO )+c(OH-)+c(NO )+c(OH-)+c(NO ) ) |
| C.向b点溶液中通入CO2可使b点溶液向c点溶液转化 |
D.该溶液中存在: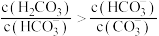 |
您最近一年使用:0次
2022-11-26更新
|
296次组卷
|
5卷引用:湖南省长沙市长郡中学、师大附中、长沙市一中联考联合体2021届高三12月联考化学试题
四、解答题 添加题型下试题
解答题-原理综合题
|
较难(0.4)
16. 研究氨的合成和分解对工业生产和防治污染有重要意义,回答下列问题:
(1)化学键键能数据如下:
氨分解反应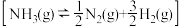 的活化能
的活化能 ,由此计算合成氨反应
,由此计算合成氨反应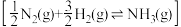 的活化能
的活化能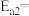
_______  。
。
(2)在Fe催化剂作用下由氮气和氢气直接合成氨的反应历程为(*表示吸附态):化学吸附: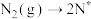 ;
;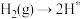 ;表面反应:
;表面反应: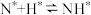 ;
; ;
; ;脱附:
;脱附: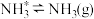 ;其中,
;其中, 的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。实际生产中,原料气中
的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。实际生产中,原料气中 和
和 物质的量之比为
物质的量之比为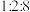 。从速率和转化率角度说明原料气中
。从速率和转化率角度说明原料气中 适度过量的理由:
适度过量的理由:
①速率角度:_______ ;
②转化率角度:_______ 。
(3)已知反应: 标准平衡常数
标准平衡常数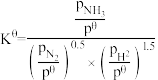 ,其中
,其中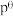 为标准压强(
为标准压强(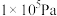 ),
),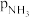 、
、 和
和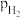 为各组分的平衡分压,如:
为各组分的平衡分压,如: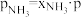 ,p为平衡总压,
,p为平衡总压,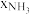 为平衡系统中
为平衡系统中 的物质的量分数。若
的物质的量分数。若 和
和 起始物质的量之比为
起始物质的量之比为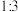 ,反应在恒定温度和标准压强下进行,
,反应在恒定温度和标准压强下进行, 的平衡转化率为
的平衡转化率为 ,则
,则
_______ (用含 的最简式表示)
的最简式表示)
(4)氨催化分解既可防治氨气污染,又能得到氢能源。在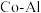 催化剂体系中,压强
催化剂体系中,压强 下氨气以一定流速通过反应器得到不同催化剂下相同时间内
下氨气以一定流速通过反应器得到不同催化剂下相同时间内 转化率随温度变化的关系如图所示。
转化率随温度变化的关系如图所示。

使活化能最小的催化剂为_______ ;温度一定时,如果增大气体流速,则b点对应的点可能是____ (填“a”“c”“d”“e”或“f”)。
(1)化学键键能数据如下:
| 化学键 | H—H | N≡N | N—H |
 | 436 | 946 | 391 |
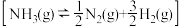 的活化能
的活化能 ,由此计算合成氨反应
,由此计算合成氨反应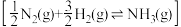 的活化能
的活化能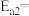
 。
。(2)在Fe催化剂作用下由氮气和氢气直接合成氨的反应历程为(*表示吸附态):化学吸附:
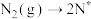 ;
;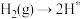 ;表面反应:
;表面反应: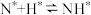 ;
; ;
; ;脱附:
;脱附: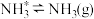 ;其中,
;其中, 的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。实际生产中,原料气中
的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。实际生产中,原料气中 和
和 物质的量之比为
物质的量之比为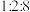 。从速率和转化率角度说明原料气中
。从速率和转化率角度说明原料气中 适度过量的理由:
适度过量的理由:①速率角度:
②转化率角度:
(3)已知反应:
 标准平衡常数
标准平衡常数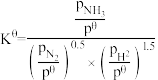 ,其中
,其中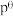 为标准压强(
为标准压强(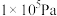 ),
),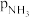 、
、 和
和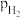 为各组分的平衡分压,如:
为各组分的平衡分压,如: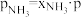 ,p为平衡总压,
,p为平衡总压,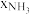 为平衡系统中
为平衡系统中 的物质的量分数。若
的物质的量分数。若 和
和 起始物质的量之比为
起始物质的量之比为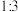 ,反应在恒定温度和标准压强下进行,
,反应在恒定温度和标准压强下进行, 的平衡转化率为
的平衡转化率为 ,则
,则
 的最简式表示)
的最简式表示)(4)氨催化分解既可防治氨气污染,又能得到氢能源。在
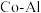 催化剂体系中,压强
催化剂体系中,压强 下氨气以一定流速通过反应器得到不同催化剂下相同时间内
下氨气以一定流速通过反应器得到不同催化剂下相同时间内 转化率随温度变化的关系如图所示。
转化率随温度变化的关系如图所示。
使活化能最小的催化剂为
您最近一年使用:0次
2020-12-20更新
|
339次组卷
|
2卷引用:湖南省长沙市长郡中学、师大附中、长沙市一中联考联合体2021届高三12月联考化学试题
解答题-工业流程题
|
较难(0.4)
解题方法
17. 利用软锰矿和方铅矿(主要成分为PbS,含有 等杂质)制备
等杂质)制备 的工艺流程如图:
的工艺流程如图:
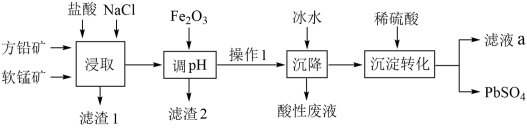
已知: ;
;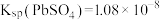 ,
,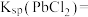
 ;
; 易溶于热水。
易溶于热水。
(1)“滤渣1”的成分是S(硫),“浸取”时被氧化的元素是_______ ,“浸取”反应的条件是_______ 。
(2)“滤渣2”的成分是_______ 。
(3)加入冰水“沉降”的离子方程式为_______ ,“酸性溶液”中的主要金属阳离子是_______ 。
(4)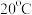 时,
时,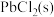 在不同浓度的盐酸中的最大溶解量(
在不同浓度的盐酸中的最大溶解量(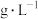 )如图所示。下列叙述正确的是
)如图所示。下列叙述正确的是_______ (填字母代号)
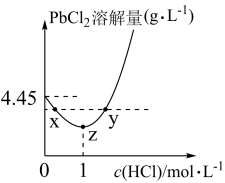
A.z→y,发生了沉淀溶解反应
B.x、y两点对应的溶液中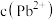 相等
相等
C.x→z, 增大使
增大使 溶解平衡逆向移动
溶解平衡逆向移动
D.盐酸浓度越小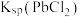 )越小
)越小
(5)“滤液a”经过处理后可以返回到_______ 工序循环使用; 经“沉淀转化”后得到
经“沉淀转化”后得到 ,当
,当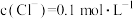 时,
时,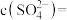
_______  。
。
 等杂质)制备
等杂质)制备 的工艺流程如图:
的工艺流程如图:
已知:
 ;
;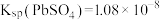 ,
,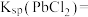
 ;
; 易溶于热水。
易溶于热水。(1)“滤渣1”的成分是S(硫),“浸取”时被氧化的元素是
(2)“滤渣2”的成分是
(3)加入冰水“沉降”的离子方程式为
(4)
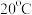 时,
时,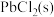 在不同浓度的盐酸中的最大溶解量(
在不同浓度的盐酸中的最大溶解量(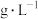 )如图所示。下列叙述正确的是
)如图所示。下列叙述正确的是
A.z→y,发生了沉淀溶解反应
B.x、y两点对应的溶液中
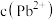 相等
相等C.x→z,
 增大使
增大使 溶解平衡逆向移动
溶解平衡逆向移动D.盐酸浓度越小
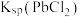 )越小
)越小(5)“滤液a”经过处理后可以返回到
 经“沉淀转化”后得到
经“沉淀转化”后得到 ,当
,当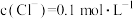 时,
时,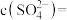
 。
。
您最近一年使用:0次
2020-12-20更新
|
679次组卷
|
4卷引用:湖南省长沙市长郡中学、师大附中、长沙市一中联考联合体2021届高三12月联考化学试题
湖南省长沙市长郡中学、师大附中、长沙市一中联考联合体2021届高三12月联考化学试题湖南省长沙市炎德英才2021届高三第三次月考联考化学试题(已下线)培优08 制备类工业流程(提高练)-2021年高考化学大题培优练(新高考地区专用)(已下线)大题02 化学工艺流程题(二)-【考前抓大题】备战2021年高考化学(全国通用)
解答题-实验探究题
|
适中(0.65)
18.  (过碳酸钠)可用于食品保鲜消毒,具有碳酸钠和过氧化氢的双重性质。以工业纯碱和双氧水为原料,采用湿法制备过碳酸钠的实验装置及实验操作如下:
(过碳酸钠)可用于食品保鲜消毒,具有碳酸钠和过氧化氢的双重性质。以工业纯碱和双氧水为原料,采用湿法制备过碳酸钠的实验装置及实验操作如下:
请回答以下问题
(1)仪器甲的名称是_______ ,支管的作用是_______ 。
(2)控制反应温度在5℃以下的原因是_______ 。
(3)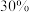 的
的 溶液中必须加入稳定剂,目的是与工业纯碱中含有的
溶液中必须加入稳定剂,目的是与工业纯碱中含有的 生成稳定的配合物,不加稳定剂的后果是
生成稳定的配合物,不加稳定剂的后果是_______ 。
(4)“用无水乙醇洗涤”过碳酸钠晶体的目的是_______ 和_______ 。
(5)产品中 含量的测定:准确称取产品
含量的测定:准确称取产品 于碘量瓶中,加入
于碘量瓶中,加入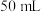 蒸馏水,并立即加入
蒸馏水,并立即加入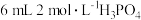 溶液,再加入
溶液,再加入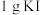 固体(过量),摇匀后于暗处放置
固体(过量),摇匀后于暗处放置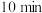 ,加入2滴淀粉溶液,用
,加入2滴淀粉溶液,用 标准液滴定至终点,消耗
标准液滴定至终点,消耗 标准溶液
标准溶液 。(已知:
。(已知: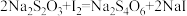 )
)
①确定达到滴定终点的现象是_______ 。
②加入1gKI固体摇匀后于暗处放置10min的目的是_______ 。
③根据实验数据计算产品中H2O2的质量分数为_______ 。
 (过碳酸钠)可用于食品保鲜消毒,具有碳酸钠和过氧化氢的双重性质。以工业纯碱和双氧水为原料,采用湿法制备过碳酸钠的实验装置及实验操作如下:
(过碳酸钠)可用于食品保鲜消毒,具有碳酸钠和过氧化氢的双重性质。以工业纯碱和双氧水为原料,采用湿法制备过碳酸钠的实验装置及实验操作如下:| 实验装置 | 实验操作 |
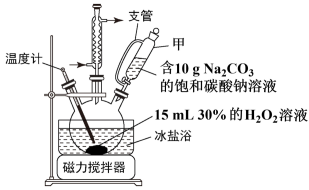 | 控制反应温度在以5℃下,将含 的饱和碳酸钠溶液滴入到三颈烧瓶中,充分反应后,边搅拌边加入 的饱和碳酸钠溶液滴入到三颈烧瓶中,充分反应后,边搅拌边加入 ,静置结晶,过滤,用无水乙醇洗涤 ,静置结晶,过滤,用无水乙醇洗涤 |
(1)仪器甲的名称是
(2)控制反应温度在5℃以下的原因是
(3)
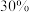 的
的 溶液中必须加入稳定剂,目的是与工业纯碱中含有的
溶液中必须加入稳定剂,目的是与工业纯碱中含有的 生成稳定的配合物,不加稳定剂的后果是
生成稳定的配合物,不加稳定剂的后果是(4)“用无水乙醇洗涤”过碳酸钠晶体的目的是
(5)产品中
 含量的测定:准确称取产品
含量的测定:准确称取产品 于碘量瓶中,加入
于碘量瓶中,加入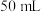 蒸馏水,并立即加入
蒸馏水,并立即加入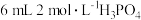 溶液,再加入
溶液,再加入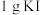 固体(过量),摇匀后于暗处放置
固体(过量),摇匀后于暗处放置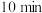 ,加入2滴淀粉溶液,用
,加入2滴淀粉溶液,用 标准液滴定至终点,消耗
标准液滴定至终点,消耗 标准溶液
标准溶液 。(已知:
。(已知: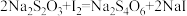 )
)①确定达到滴定终点的现象是
②加入1gKI固体摇匀后于暗处放置10min的目的是
③根据实验数据计算产品中H2O2的质量分数为
您最近一年使用:0次
2020-12-20更新
|
334次组卷
|
3卷引用:湖南省长沙市长郡中学、师大附中、长沙市一中联考联合体2021届高三12月联考化学试题
湖南省长沙市长郡中学、师大附中、长沙市一中联考联合体2021届高三12月联考化学试题湖南省长沙市炎德英才2021届高三第三次月考联考化学试题(已下线)大题03 无机制备类实验题-【考前抓大题】备战2021年高考化学(全国通用)
解答题-结构与性质
|
适中(0.65)
解题方法
19. 亚微米级 复合物多相催化过一硫酸盐降解有机污染物的过程如图所示:
复合物多相催化过一硫酸盐降解有机污染物的过程如图所示:
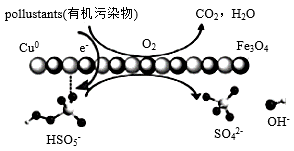
回答下列问题
(1)基态铜原子的M层电子排布式为_______ ,其位于元素周期表的_______ 区。
(2)C、S、H的电负性由大到小的顺序为_______ 。
(3) 中S的价层电子对数为
中S的价层电子对数为_______ ,其空间构型为_______ 。
(4)冰的结构如图所示,则1mol冰中含有_______ mol氢键

(5) 复合物也是有机反应中的催化剂,如
复合物也是有机反应中的催化剂,如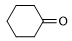


 ,
, 的键角
的键角_______ (填“大于”“小于”或“等于”) 的键角;理由是
的键角;理由是_______ 。
(6)铜的晶胞结构如图,铜原子的配位数为_______ ,若铜原子的半径为a ,则铜晶胞的密度为
,则铜晶胞的密度为_______  。
。

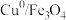 复合物多相催化过一硫酸盐降解有机污染物的过程如图所示:
复合物多相催化过一硫酸盐降解有机污染物的过程如图所示:
回答下列问题
(1)基态铜原子的M层电子排布式为
(2)C、S、H的电负性由大到小的顺序为
(3)
 中S的价层电子对数为
中S的价层电子对数为(4)冰的结构如图所示,则1mol冰中含有

(5)
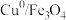 复合物也是有机反应中的催化剂,如
复合物也是有机反应中的催化剂,如


 ,
, 的键角
的键角 的键角;理由是
的键角;理由是(6)铜的晶胞结构如图,铜原子的配位数为
 ,则铜晶胞的密度为
,则铜晶胞的密度为 。
。
您最近一年使用:0次
2020-12-20更新
|
300次组卷
|
3卷引用:湖南省长沙市长郡中学、师大附中、长沙市一中联考联合体2021届高三12月联考化学试题
湖南省长沙市长郡中学、师大附中、长沙市一中联考联合体2021届高三12月联考化学试题湖南省长沙市炎德英才2021届高三第三次月考联考化学试题(已下线)大题08 物质结构与性质(一)(选修)-【考前抓大题】备战2021年高考化学(全国通用)
解答题-有机推断题
|
适中(0.65)
20. 化合物J是合成医药的中间体,其合成方法如下。

已知:

回答下列问题:
(1)B的结构简式为_______ 。
(2)反应B→C还需要的反应物是_______ 。
(3)G中的官能团名称为_______ 。
(4)E→G的反应类型为_______ 。
(5)写出D→E的化学反应方程式_______ 。
(6)符合下列条件的E的同分异构体有_______ 种,写出其中一种能发生银镜反应的物质的结构简式_______ 。
①是芳香化合物
②与化合物E具有相同种类和数目的官能团
③核磁共振氢谱有四组峰
(7)请设计由间硝基苯乙酮(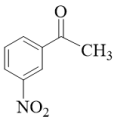 )制备
)制备 的合成路线(其他试剂任选)
的合成路线(其他试剂任选)_______ 。

已知:



回答下列问题:
(1)B的结构简式为
(2)反应B→C还需要的反应物是
(3)G中的官能团名称为
(4)E→G的反应类型为
(5)写出D→E的化学反应方程式
(6)符合下列条件的E的同分异构体有
①是芳香化合物
②与化合物E具有相同种类和数目的官能团
③核磁共振氢谱有四组峰
(7)请设计由间硝基苯乙酮(
 )制备
)制备 的合成路线(其他试剂任选)
的合成路线(其他试剂任选)
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、化学反应原理、化学与STSE、认识化学科学、物质结构与性质、有机化学基础、化学实验基础
试卷题型(共 20题)
题型
数量
单选题
12
多选题
3
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 硅酸钠的俗名和用途 金属的化学腐蚀与电化学腐蚀 化学科学对人类文明发展的意义 | |
| 2 | 0.65 | 离子方程式的正误判断 偏铝酸钠与二氧化碳的反应 电解池电解基本判断 | |
| 3 | 0.65 | 根据原子结构进行元素种类推断 根据物质性质进行元素种类推断 “位构性”关系理解及应用 | |
| 4 | 0.65 | 氧化还原反应的几组概念 氧化还原反应的应用 氧化还原反应有关计算 | |
| 5 | 0.85 | 氨气的实验室制法 乙酸乙酯制备实验的装置及操作 常见气体的制备与收集 | |
| 6 | 0.65 | 同系物的判断 有机化合物中碳的成键特征 苯分子结构的特点 | |
| 7 | 0.65 | 阿伏加德罗常数的应用 气体物质与NA相关的推算 | |
| 8 | 0.65 | Fe3+的检验 物质分离、提纯综合应用 萃取和分液 | |
| 9 | 0.65 | 硅酸盐 物质分离、提纯综合应用 常见无机物的制备 | |
| 10 | 0.65 | 电解原理 电解原理的应用 | |
| 14 | 0.65 | 催化剂对化学反应速率的影响 化学键基本概念 | |
| 15 | 0.4 | 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 弱电解质的电离平衡常数 | |
| 二、多选题 | |||
| 11 | 0.85 | 次氯酸及其性质 硝酸的强氧化性 甲烷的取代反应 乙醇的消去反应 | |
| 12 | 0.85 | 同分异构体确定途径——官能团异构 含碳碳双键物质的性质的推断 有机分子中原子共面的判断 丙酮与氢气的加成反应 | |
| 13 | 0.65 | 电解原理 电解原理的应用 电解池电极反应式及化学方程式的书写与判断 | |
| 三、解答题 | |||
| 16 | 0.4 | 化学反应热的计算 催化剂对化学反应速率的影响 化学平衡常数的有关计算 化学反应条件的控制及其应用 | 原理综合题 |
| 17 | 0.4 | 沉淀的溶解与生成 溶度积常数相关计算 物质分离、提纯综合应用 常见无机物的制备 | 工业流程题 |
| 18 | 0.65 | 酸碱中和滴定原理的应用 常见无机物的制备 物质含量的测定 物质制备的探究 | 实验探究题 |
| 19 | 0.65 | 电子排布式 电负性概念 价层电子对互斥理论 晶胞的有关计算 | 结构与性质 |
| 20 | 0.65 | 羧酸酯化反应 有机物的合成 有机推断综合考查 | 有机推断题 |



