解题方法
1 . 资料显示“ 的氧化性随溶液pH的增大逐渐减弱”。某化学小组同学用下列装置和试剂进行实验,探究
的氧化性随溶液pH的增大逐渐减弱”。某化学小组同学用下列装置和试剂进行实验,探究 与KI溶液发生反应的条件。
与KI溶液发生反应的条件。
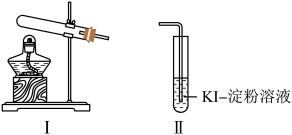
供选试剂: 溶液、
溶液、 固体、
固体、 固体。
固体。
该小组同学设计 、
、 两组实验,记录如下:
两组实验,记录如下:
(1)选择Ⅰ装置用 固体制取
固体制取 ,为避免
,为避免 固体随
固体随 进入Ⅱ试管对实验造成干扰,应进行的改进是
进入Ⅱ试管对实验造成干扰,应进行的改进是________ , 组实验中
组实验中 与KI溶液反应的离子方程式是
与KI溶液反应的离子方程式是________ 。
(2)对比 、
、 两组实验可知,
两组实验可知, 与KI溶液发生反应的适宜条件是
与KI溶液发生反应的适宜条件是________ 。为进一步探究该条件对反应速率的影响,可采取的实验措施是________ 。
(3)为进一步探究碱性条件下KI与 能否反应,用上图中的装置继续进行实验:
能否反应,用上图中的装置继续进行实验:
对于实验 的现象,小明同学提出猜想“
的现象,小明同学提出猜想“ 时
时 不能氧化
不能氧化 ”,设计了下列装置进行实验,验证猜想。
”,设计了下列装置进行实验,验证猜想。
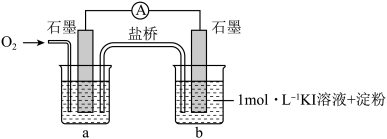
(i)烧杯a中的溶液为________ 。
(ii)实验结果表明,此猜想不成立。支持该结论的实验现象是通入 后
后________ 。
(iii)小刚同学向 的KOH溶液
的KOH溶液 含淀粉
含淀粉 中滴加碘水,溶液先变蓝后迅速褪色。经检测褪色后的溶液中含有
中滴加碘水,溶液先变蓝后迅速褪色。经检测褪色后的溶液中含有 ,褪色的原因是
,褪色的原因是________  用离子方程式表示
用离子方程式表示 。
。
(4)该小组同学对实验过程进行了反思:实验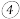 的现象产生的原因可能是
的现象产生的原因可能是________ 。
 的氧化性随溶液pH的增大逐渐减弱”。某化学小组同学用下列装置和试剂进行实验,探究
的氧化性随溶液pH的增大逐渐减弱”。某化学小组同学用下列装置和试剂进行实验,探究 与KI溶液发生反应的条件。
与KI溶液发生反应的条件。 
供选试剂:
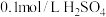 溶液、
溶液、 固体、
固体、 固体。
固体。该小组同学设计
 、
、 两组实验,记录如下:
两组实验,记录如下:| 实验操作 | 实验现象 | |
 | 向Ⅰ试管中加入  固体,连接装置Ⅰ、Ⅱ,点燃酒精灯 固体,连接装置Ⅰ、Ⅱ,点燃酒精灯 | Ⅱ试管中有气泡冒出,溶液不变蓝 |
 | 向Ⅰ试管中加入  固体, 固体,Ⅱ试管中加入适量 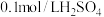 溶液,连接装置Ⅰ、Ⅱ,点燃酒精灯 溶液,连接装置Ⅰ、Ⅱ,点燃酒精灯 | Ⅱ试管中有气泡冒出,溶液变蓝 |
 固体制取
固体制取 ,为避免
,为避免 固体随
固体随 进入Ⅱ试管对实验造成干扰,应进行的改进是
进入Ⅱ试管对实验造成干扰,应进行的改进是 组实验中
组实验中 与KI溶液反应的离子方程式是
与KI溶液反应的离子方程式是(2)对比
 、
、 两组实验可知,
两组实验可知, 与KI溶液发生反应的适宜条件是
与KI溶液发生反应的适宜条件是(3)为进一步探究碱性条件下KI与
 能否反应,用上图中的装置继续进行实验:
能否反应,用上图中的装置继续进行实验:| 实验操作 | 实验现象 | |
 | 向Ⅰ试管中加入  固体,Ⅱ试管中滴加 KOH 溶液控制 固体,Ⅱ试管中滴加 KOH 溶液控制  , 连接装置Ⅰ、Ⅱ,点燃酒精灯 , 连接装置Ⅰ、Ⅱ,点燃酒精灯 | 溶液略变蓝 |
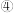 | 向Ⅰ试管中加入  固体,Ⅱ试管中滴加 KOH 溶液控制 固体,Ⅱ试管中滴加 KOH 溶液控制  , 连接装置Ⅰ、Ⅱ,点燃酒精灯 , 连接装置Ⅰ、Ⅱ,点燃酒精灯 | 无明显变化 |
 的现象,小明同学提出猜想“
的现象,小明同学提出猜想“ 时
时 不能氧化
不能氧化 ”,设计了下列装置进行实验,验证猜想。
”,设计了下列装置进行实验,验证猜想。 
(i)烧杯a中的溶液为
(ii)实验结果表明,此猜想不成立。支持该结论的实验现象是通入
 后
后(iii)小刚同学向
 的KOH溶液
的KOH溶液 含淀粉
含淀粉 中滴加碘水,溶液先变蓝后迅速褪色。经检测褪色后的溶液中含有
中滴加碘水,溶液先变蓝后迅速褪色。经检测褪色后的溶液中含有 ,褪色的原因是
,褪色的原因是 用离子方程式表示
用离子方程式表示 。
。(4)该小组同学对实验过程进行了反思:实验
 的现象产生的原因可能是
的现象产生的原因可能是
您最近一年使用:0次
解题方法
2 . 某研究性学习小组制备高铁酸钾(K2FeO4)并探究其性质。查阅文献,得到以下资料: K2FeO4为紫色固体,微溶于 KOH 溶液;具有强氧化性,在酸性或中性溶液中快速产生 O2,在碱性溶液中较稳定。
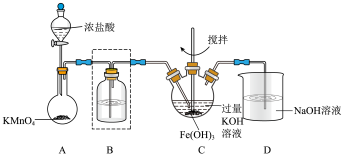
Ⅰ.制备 K2FeO4(夹持装置略)。
(1)A 为氯气的实验室发生装置。A 中反应方程式是______ (锰被还原为 Mn2+)。若反应中有 0.5molCl2产生,则电子转移的数目为______ 。工业制氯气的反应方程式为______ 。
(2)装置 B 中盛放的试剂是______ ,简述该装置在制备高铁酸钾中的作用______ 。
(3)C 中得到紫色固体和溶液。C 中 Cl2发生的反应有:3Cl2+2Fe(OH)3+10KOH→2K2FeO4+6KCl+8H2O,根据该反应方程式得出:碱性条件下,氧化性 Cl2______ FeO42-(填“>”或“<”)。另外C中还可能发生其他反应,请用离子方程式表示______ 。
Ⅱ.探究 K2FeO4 的性质
(4)甲同学取少量 K2FeO4 加入浑浊的泥浆水中,发现产生气体,搅拌,浑浊的泥浆水很快澄清。请简述 K2FeO4的净水原理。______ 。

Ⅰ.制备 K2FeO4(夹持装置略)。
(1)A 为氯气的实验室发生装置。A 中反应方程式是
(2)装置 B 中盛放的试剂是
(3)C 中得到紫色固体和溶液。C 中 Cl2发生的反应有:3Cl2+2Fe(OH)3+10KOH→2K2FeO4+6KCl+8H2O,根据该反应方程式得出:碱性条件下,氧化性 Cl2
Ⅱ.探究 K2FeO4 的性质
(4)甲同学取少量 K2FeO4 加入浑浊的泥浆水中,发现产生气体,搅拌,浑浊的泥浆水很快澄清。请简述 K2FeO4的净水原理。
您最近一年使用:0次
3 . 过二硫酸钠(Na2S2O8)也叫高硫酸钠,可用于废气处理及有害物质氧化降解.用(NH4)2S2O8溶液和一定浓度的NaOH溶液混合可制得Na2S2O8晶体,同时还会放出氨气。某化学兴趣小组利用该原理在实验室制备Na2S2O8晶体(装置如图所示).
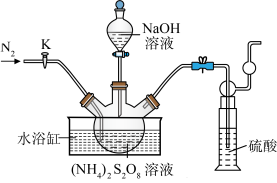
已知:反应过程中发生的副反应为2NH3+3Na2S2O8+6NaOH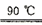 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2
(1)图中装有NaOH溶液的仪器的名称为___ ,反应过程中持续通入氮气的目的是___ 。
(2) (NH4)2S2O8可由电解硫酸铵和硫酸的混合溶液制得,写出电解时阳极的电极反应式:___ 。
(3)Na2S2O8溶于水中,会发生一定程度的水解,最终仅生成H2SO4、Na2SO4和另一种常温下为液态且具有强氧化性的物质,写出该反应的化学方程式:___ 。
(4)Na2S2O8具有强氧化性,该兴趣小组设计实验探究不同环境下Na2S2O8氧化性的强弱。将MnSO4•H2O(1.69g)与过量Na2S2O8(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如表格所示)。
①在___ (填“中性”“酸性”或“碱性”)条件下,Na2S2O8的氧化能力最强。
②中性氧化时,会产生大量气泡,其原因为___ 。
③若用0.1mol•L-1的H2O2溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为___ ;达到滴定终点时,消耗H2O2溶液的体积为V1rnL。则碱性氧化后的溶液中NaMnO4的质量为___ g(用含V1的代数式表示,5H2O2~2 )。
)。

已知:反应过程中发生的副反应为2NH3+3Na2S2O8+6NaOH
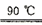 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2(1)图中装有NaOH溶液的仪器的名称为
(2) (NH4)2S2O8可由电解硫酸铵和硫酸的混合溶液制得,写出电解时阳极的电极反应式:
(3)Na2S2O8溶于水中,会发生一定程度的水解,最终仅生成H2SO4、Na2SO4和另一种常温下为液态且具有强氧化性的物质,写出该反应的化学方程式:
(4)Na2S2O8具有强氧化性,该兴趣小组设计实验探究不同环境下Na2S2O8氧化性的强弱。将MnSO4•H2O(1.69g)与过量Na2S2O8(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如表格所示)。
| 环境 | 调节溶液氧化环境时的现象 | 加热煮沸3min期间产生的现象 |
| 中性 | 加入VmL蒸馏水,无明显现象 | 30s时开始有大量气泡冒出,3min后溶液变深棕色,溶液中有悬浮小颗粒 |
| 碱性 | 加入VmL某浓度的NaOH溶液,瞬间变为棕色(MnO2) | 10s后溶液逐渐变为深紫色(MnO4-),没有明显冒气泡现象 |
| 酸性 | 加入VmL稀H2SO4无明显现象 | 煮沸3min后,有气泡冒出 |
①在
②中性氧化时,会产生大量气泡,其原因为
③若用0.1mol•L-1的H2O2溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为
 )。
)。
您最近一年使用:0次
2020-06-06更新
|
478次组卷
|
3卷引用:河北省邯郸市2020届高三第一次模拟考试理科综合化学试题
名校
4 . 1841年美国学者Fremy首次合成了 ,它是一种“环境友好型氧化剂”。某小组拟制备
,它是一种“环境友好型氧化剂”。某小组拟制备 ,并探究其性质。已知20℃时KCl的溶解度为37.4g,
,并探究其性质。已知20℃时KCl的溶解度为37.4g, 的溶解度为11.1g。
的溶解度为11.1g。
实验(一)制备 ,装置如图所示:
,装置如图所示:

(1)乙装置的作用是___________ 。
(2)甲装置中副产物为氯化钾,写出生成 的离子方程式:
的离子方程式:___________ 。
(3)实验完毕后,对甲装置中混合液蒸发浓缩、___________ 、过滤、洗涤、低温干燥。
实验(二)探究 性质及应用。
性质及应用。
取10g草酸溶于40mL水中,加入 粉末,充分混合,观察到有大量气泡产生,并产生黑色固体,将所得气体通入足量澄清石灰水中,溶液变浑浊。
粉末,充分混合,观察到有大量气泡产生,并产生黑色固体,将所得气体通入足量澄清石灰水中,溶液变浑浊。
(4)根据上述实验现象,可以判断产生的气体中含有___________ ,产生该气体的原因是___________ ,经测定所得气体中还含有 。
。
(5)实验完毕后,将混合物经过滤、洗涤、干燥得到黑色固体,利用如图实验装置探究黑色固体的成分。
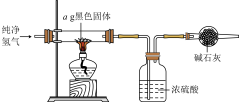
当黑色固体完全反应后,测得浓硫酸质量净增bg,当 等于
等于___________ (用分数表示)时,黑色固体为 。
。
(6)在其他条件相同时,测得一定浓度的 稳定性(用
稳定性(用 浓度表示)与pH关系如左图,其消毒效率与温度关系如右图所示:
浓度表示)与pH关系如左图,其消毒效率与温度关系如右图所示:
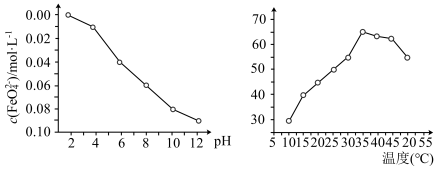
①根据左图得出结论是___________ 。
②在相同条件下, 作消毒剂最佳温度是
作消毒剂最佳温度是___________ 。
(7)查阅资料可知, 溶液呈紫红色,为探究
溶液呈紫红色,为探究 和
和 的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“
的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“ ”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应条件下氧化剂的氧化性越强。)
”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应条件下氧化剂的氧化性越强。)
方案1:在 溶液中加过量的
溶液中加过量的 粉末,溶液呈紫红色。
粉末,溶液呈紫红色。
方案2:如图所示,关闭K时,观察到电流计指针偏转,铂极产生红褐色物质,石墨极附近无色溶液变紫红色。

实验___________ (填“1”或“2”)能证明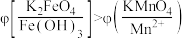 。
。
 ,它是一种“环境友好型氧化剂”。某小组拟制备
,它是一种“环境友好型氧化剂”。某小组拟制备 ,并探究其性质。已知20℃时KCl的溶解度为37.4g,
,并探究其性质。已知20℃时KCl的溶解度为37.4g, 的溶解度为11.1g。
的溶解度为11.1g。实验(一)制备
 ,装置如图所示:
,装置如图所示:
(1)乙装置的作用是
(2)甲装置中副产物为氯化钾,写出生成
 的离子方程式:
的离子方程式:(3)实验完毕后,对甲装置中混合液蒸发浓缩、
实验(二)探究
 性质及应用。
性质及应用。取10g草酸溶于40mL水中,加入
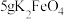 粉末,充分混合,观察到有大量气泡产生,并产生黑色固体,将所得气体通入足量澄清石灰水中,溶液变浑浊。
粉末,充分混合,观察到有大量气泡产生,并产生黑色固体,将所得气体通入足量澄清石灰水中,溶液变浑浊。(4)根据上述实验现象,可以判断产生的气体中含有
 。
。(5)实验完毕后,将混合物经过滤、洗涤、干燥得到黑色固体,利用如图实验装置探究黑色固体的成分。

当黑色固体完全反应后,测得浓硫酸质量净增bg,当
 等于
等于 。
。(6)在其他条件相同时,测得一定浓度的
 稳定性(用
稳定性(用 浓度表示)与pH关系如左图,其消毒效率与温度关系如右图所示:
浓度表示)与pH关系如左图,其消毒效率与温度关系如右图所示:
①根据左图得出结论是
②在相同条件下,
 作消毒剂最佳温度是
作消毒剂最佳温度是(7)查阅资料可知,
 溶液呈紫红色,为探究
溶液呈紫红色,为探究 和
和 的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“
的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“ ”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应条件下氧化剂的氧化性越强。)
”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应条件下氧化剂的氧化性越强。)方案1:在
 溶液中加过量的
溶液中加过量的 粉末,溶液呈紫红色。
粉末,溶液呈紫红色。方案2:如图所示,关闭K时,观察到电流计指针偏转,铂极产生红褐色物质,石墨极附近无色溶液变紫红色。

实验
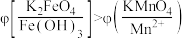 。
。
您最近一年使用:0次
名校
解题方法
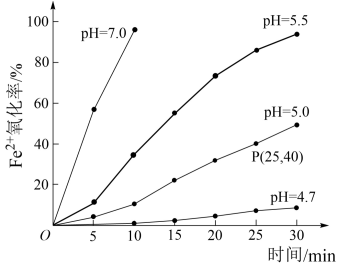
5 . 久置的FeSO4溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某研究小组为研究溶液中Fe2+被O2氧化的过程,查阅资料发现:溶液中Fe2+的氧化过程分为先后两步,首先是Fe2+水解,接着水解产物被O2氧化。于是小组同学决定研究常温下不同pH对Fe2+被O2氧化的影响,并测定了Fe2+氧化率随时间变化的关系,结果如图。
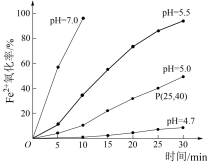
回答下列问题
(1)写出Fe2+水解的离子方程式是___________ ;要抑制FeSO4水解,可以的措施___________ 。
(2)若配制的FeSO4溶液浓度为0.01mol/L,反应过程中溶液体积不变,计算图中P点Fe2+氧化率的氧化速率___________ 。
(3)在酸性条件下,Fe2+被O2氧化的反应方程式为:___________ 。已知常温下该反应的平衡常数很大。则下列说法正确的是___________
a.Fe2+转化为Fe3+的趋势很大
b.Fe2+转化为Fe3+的速率很大
c.该反应进行得很完全
d.酸性条件下Fe2+不会被氧化
(4)结合图象分析可知,pH越大Fe2+氧化率越___________ 。
(5)研究小组在查阅资料时还得知:氧气的氧化性随溶液的酸性增强而增强。通过以上研究可知,配制FeSO4溶液的正确做法是___________ 。

回答下列问题
(1)写出Fe2+水解的离子方程式是
(2)若配制的FeSO4溶液浓度为0.01mol/L,反应过程中溶液体积不变,计算图中P点Fe2+氧化率的氧化速率
(3)在酸性条件下,Fe2+被O2氧化的反应方程式为:
a.Fe2+转化为Fe3+的趋势很大
b.Fe2+转化为Fe3+的速率很大
c.该反应进行得很完全
d.酸性条件下Fe2+不会被氧化
(4)结合图象分析可知,pH越大Fe2+氧化率越
(5)研究小组在查阅资料时还得知:氧气的氧化性随溶液的酸性增强而增强。通过以上研究可知,配制FeSO4溶液的正确做法是
您最近一年使用:0次
名校
解题方法
6 . 水体砷污染已成为一个亟待解决的全球性环境问题,我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的正五价砷[As(V )],其机制模型如图。
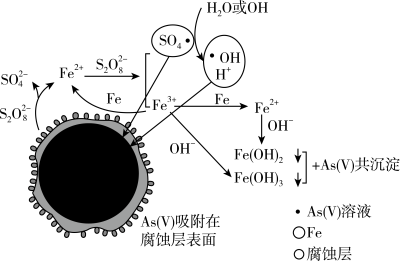
零价铁活化过硫酸钠去除改水中As(V)的机制模型
资料:
I.酸性条件下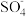 ●为主要的自由基,中性及弱碱性条件下
●为主要的自由基,中性及弱碱性条件下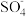 ●和●OH同时存在,强碱性条件下,●OH为主要的自由基。
●和●OH同时存在,强碱性条件下,●OH为主要的自由基。
II. Fe2+、Fe3+形成氢氧化物沉淀的pH
(1)砷与磷在元素周期表中位于同一主族,其原子比磷多一个电子层。
①砷在元素周期表中的位置是____________________ 。
②砷酸的化学式是__________________________ ,其酸性比H3PO4__________________________
(填“强”或“弱”)。
(2)零价铁与过硫酸钠反应,可持续释放Fe2+,Fe2+与 反应生成Fe3+和自由基,自由基具有强氧化性,利于形成Fe2+和Fe3+,以确保As( V)去除完全。
反应生成Fe3+和自由基,自由基具有强氧化性,利于形成Fe2+和Fe3+,以确保As( V)去除完全。
①零价铁与过硫酸钠反应的离子方程式是________________________ 。
②Fe3+转化为Fe2+的离子方程式是________________________________ 。
(3)不同pH对As(V)去除率的影响如图。5 min内pH=7和pH=9时去除率高的原因是________________ 。


零价铁活化过硫酸钠去除改水中As(V)的机制模型
资料:
I.酸性条件下
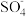 ●为主要的自由基,中性及弱碱性条件下
●为主要的自由基,中性及弱碱性条件下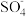 ●和●OH同时存在,强碱性条件下,●OH为主要的自由基。
●和●OH同时存在,强碱性条件下,●OH为主要的自由基。II. Fe2+、Fe3+形成氢氧化物沉淀的pH
| 离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe2+ | 7.04 | 9.08 |
| Fe3+ | 1.87 | 3.27 |
①砷在元素周期表中的位置是
②砷酸的化学式是
(填“强”或“弱”)。
(2)零价铁与过硫酸钠反应,可持续释放Fe2+,Fe2+与
 反应生成Fe3+和自由基,自由基具有强氧化性,利于形成Fe2+和Fe3+,以确保As( V)去除完全。
反应生成Fe3+和自由基,自由基具有强氧化性,利于形成Fe2+和Fe3+,以确保As( V)去除完全。①零价铁与过硫酸钠反应的离子方程式是
②Fe3+转化为Fe2+的离子方程式是
(3)不同pH对As(V)去除率的影响如图。5 min内pH=7和pH=9时去除率高的原因是

您最近一年使用:0次
名校
解题方法
7 . 久置的 溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某研究小组为研究溶液中
溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某研究小组为研究溶液中 被
被 氧化的过程,查阅资料发现:溶液中
氧化的过程,查阅资料发现:溶液中 的氧化过程分为先后两步,首先是
的氧化过程分为先后两步,首先是 水解接着水解产物被
水解接着水解产物被 氧化。于是小组同学决定研究常温下不同pH对
氧化。于是小组同学决定研究常温下不同pH对 被
被 氧化的影响,并测定了
氧化的影响,并测定了 氧化率随时间变化的关系,结果如图。
氧化率随时间变化的关系,结果如图。
回答下列问题:
(1)写出 水解的离子方程式
水解的离子方程式________________ ;要抑制 水解,可以采取的措施是
水解,可以采取的措施是________ 。
(2)若配制的 溶液浓度为
溶液浓度为 ,反应过程中溶液体积不变,计算图中P点
,反应过程中溶液体积不变,计算图中P点 的氧化速率
的氧化速率________________ 。
(3)在酸性条件下, 被
被 氧化的反应方程式为:
氧化的反应方程式为: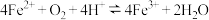 ,已知常温下该反应的平衡常数很大。则下列说法正确的是
,已知常温下该反应的平衡常数很大。则下列说法正确的是________ 。
a. 转化为
转化为 的趋势很大 b.
的趋势很大 b. 转化为
转化为 的速率很大
的速率很大
c.该反应进行得很完全 d.酸性条件下 不会被氧化
不会被氧化
(4)结合图象分析可知,pH越大 氧化率越
氧化率越________ (填“大”或“小”)。
(5)研究小组在查阅资料时还得知:氧气的氧化性随溶液的酸性增强而增强。通过以上研究可知,配制 溶液的正确做法是
溶液的正确做法是________________________ 。
 溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某研究小组为研究溶液中
溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某研究小组为研究溶液中 被
被 氧化的过程,查阅资料发现:溶液中
氧化的过程,查阅资料发现:溶液中 的氧化过程分为先后两步,首先是
的氧化过程分为先后两步,首先是 水解接着水解产物被
水解接着水解产物被 氧化。于是小组同学决定研究常温下不同pH对
氧化。于是小组同学决定研究常温下不同pH对 被
被 氧化的影响,并测定了
氧化的影响,并测定了 氧化率随时间变化的关系,结果如图。
氧化率随时间变化的关系,结果如图。
回答下列问题:
(1)写出
 水解的离子方程式
水解的离子方程式 水解,可以采取的措施是
水解,可以采取的措施是(2)若配制的
 溶液浓度为
溶液浓度为 ,反应过程中溶液体积不变,计算图中P点
,反应过程中溶液体积不变,计算图中P点 的氧化速率
的氧化速率(3)在酸性条件下,
 被
被 氧化的反应方程式为:
氧化的反应方程式为: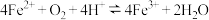 ,已知常温下该反应的平衡常数很大。则下列说法正确的是
,已知常温下该反应的平衡常数很大。则下列说法正确的是a.
 转化为
转化为 的趋势很大 b.
的趋势很大 b. 转化为
转化为 的速率很大
的速率很大c.该反应进行得很完全 d.酸性条件下
 不会被氧化
不会被氧化(4)结合图象分析可知,pH越大
 氧化率越
氧化率越(5)研究小组在查阅资料时还得知:氧气的氧化性随溶液的酸性增强而增强。通过以上研究可知,配制
 溶液的正确做法是
溶液的正确做法是
您最近一年使用:0次
2020-11-24更新
|
99次组卷
|
2卷引用:山东省临沂市平邑县、沂水县2020~2021学年高二上学期期中联考化学试题
8 . 氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照下表所示的方案完成实验。
(1)实验①和②的目的是______________________ 。
同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是_______________ (填一种即可)。
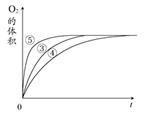
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示。分析该图能够得出的实验结论是_____________________ 。
Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如图2所示的实验装置进行实验。
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量______________________________________ 来比较。
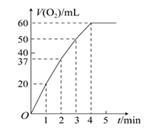
(2)0.1 g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如下图所示。解释反应速率变化的原因:_______________ 。
(3)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是_________ (填序号)。
A.化学反应速率理论可以指导怎样在一定时间内快出产品
B.勒夏特列原理可以指导怎样使有限原料多出产品
C.催化剂的使用是提高产品产率的有效办法
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照下表所示的方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2%H2O2溶液 | 无 |
| ② | 10 mL 5%H2O2溶液 | 无 |
| ③ | 10 mL 5%H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ④ | 10 mL 5%H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ⑤ | 10 mL 5%H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |

(1)实验①和②的目的是
同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示。分析该图能够得出的实验结论是

Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如图2所示的实验装置进行实验。
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量
(2)0.1 g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如下图所示。解释反应速率变化的原因:

(3)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是
A.化学反应速率理论可以指导怎样在一定时间内快出产品
B.勒夏特列原理可以指导怎样使有限原料多出产品
C.催化剂的使用是提高产品产率的有效办法
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
您最近一年使用:0次
2016-12-09更新
|
178次组卷
|
3卷引用:2015-2016学年湖南省株洲十八中高二上学期期中(理)化学试卷
9 . 水体砷污染已成为一个亟待解决的全球性环境问题,我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的正五价砷[As(Ⅴ)],其机制模型如下。

零价铁活化过硫酸钠去除废水中As(Ⅴ)的机制模型
资料:
Ⅰ.酸性条件下SO4−·为主要的自由基,中性及弱碱性条件下SO4−·和·OH同时存在,强碱性条件下·OH为主要的自由基。
Ⅱ.Fe2+、Fe3+形成氢氧化物沉淀的pH
(1)砷与磷在元素周期表中位于同一主族,其原子比磷多一个电子层。
① 砷在元素周期表中的位置是______ 。
② 砷酸的化学式是______ ,其酸性比H3PO4______ (填“强”或“弱”)。
(2)零价铁与过硫酸钠反应,可持续释放Fe2+,Fe2+与S2O82−反应生成Fe3+和自由基,自由基具有强氧化性,利于形成Fe2+和Fe3+,以确保As(Ⅴ)去除完全。
①S2O82−中S的化合价是______ 。
②零价铁与过硫酸钠反应的离子方程式是______ 。
③Fe3+转化为Fe2+的离子方程式是______ 。
(3)不同pH对As(Ⅴ)去除率的影响如图。5 min内pH = 7和pH = 9时去除率高的原因是______ 。


零价铁活化过硫酸钠去除废水中As(Ⅴ)的机制模型
资料:
Ⅰ.酸性条件下SO4−·为主要的自由基,中性及弱碱性条件下SO4−·和·OH同时存在,强碱性条件下·OH为主要的自由基。
Ⅱ.Fe2+、Fe3+形成氢氧化物沉淀的pH
| 离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe2+ | 7.04 | 9.08 |
| Fe3+ | 1.87 | 3.27 |
(1)砷与磷在元素周期表中位于同一主族,其原子比磷多一个电子层。
① 砷在元素周期表中的位置是
② 砷酸的化学式是
(2)零价铁与过硫酸钠反应,可持续释放Fe2+,Fe2+与S2O82−反应生成Fe3+和自由基,自由基具有强氧化性,利于形成Fe2+和Fe3+,以确保As(Ⅴ)去除完全。
①S2O82−中S的化合价是
②零价铁与过硫酸钠反应的离子方程式是
③Fe3+转化为Fe2+的离子方程式是
(3)不同pH对As(Ⅴ)去除率的影响如图。5 min内pH = 7和pH = 9时去除率高的原因是

您最近一年使用:0次
名校
解题方法
10 . 工业上,以钛白副产品硫酸亚铁制备的铁黄(FeOOH)代替硝酸铁等可溶性铁盐制备高铁酸钾,可降低生产工艺成本且产品质量好。工艺流程如图所示:

已知:①K2FeO4为暗紫色固体,可溶于水,微溶于KOH溶液。
②FeO 具有强氧化性,在酸性或者中性溶液中能产生O2,在碱性溶液中较稳定。
具有强氧化性,在酸性或者中性溶液中能产生O2,在碱性溶液中较稳定。
③铁黄在177℃开始分解。
(1)从电子排布的角度分析,Fe2+稳定性小于Fe3+的原因_______ 。
(2)制备铁黄的离子方程式为_______ 。
(3)实验测得反应液的温度、pH对铁黄产量的影响如图所示。
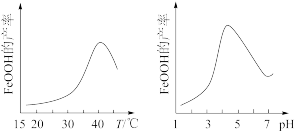
①反应液温度高于40 °C时,铁黄的产量下降的原因可能是_______ 。
②pH大于4.5时铁黄产量降低的主要原因可能是_______ 。
(4)粗产品K2FeO4提纯时采用重结晶、洗涤、低温烘干的方法,洗涤剂最好选用 _______(填序号)。
(5)用K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的S2-、CN-、NH3等,生成的Fe(OH)3胶体还能吸附水中的悬浮杂质。试写出K2FeO4处理含有CN- 的碱性污水时与CN-反应的离子方程式_______ 。

已知:①K2FeO4为暗紫色固体,可溶于水,微溶于KOH溶液。
②FeO
 具有强氧化性,在酸性或者中性溶液中能产生O2,在碱性溶液中较稳定。
具有强氧化性,在酸性或者中性溶液中能产生O2,在碱性溶液中较稳定。③铁黄在177℃开始分解。
(1)从电子排布的角度分析,Fe2+稳定性小于Fe3+的原因
(2)制备铁黄的离子方程式为
(3)实验测得反应液的温度、pH对铁黄产量的影响如图所示。
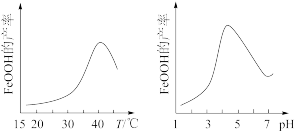
①反应液温度高于40 °C时,铁黄的产量下降的原因可能是
②pH大于4.5时铁黄产量降低的主要原因可能是
(4)粗产品K2FeO4提纯时采用重结晶、洗涤、低温烘干的方法,洗涤剂最好选用 _______(填序号)。
| A.冰水 | B.NaOH溶液 | C.稀硫酸 | D.Fe(NO3)3溶液 |
您最近一年使用:0次
2022-09-02更新
|
326次组卷
|
4卷引用:江苏省南师附中、天一中学、海安中学、海门中学四校2021-2022学年高三12月联考化学试题



