21-22高三上·江苏南通·期末
名校
解题方法
1 . 用化学方法降解水中有机物已成为污水处理领域的重要研究方向。
(1)酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图1所示。
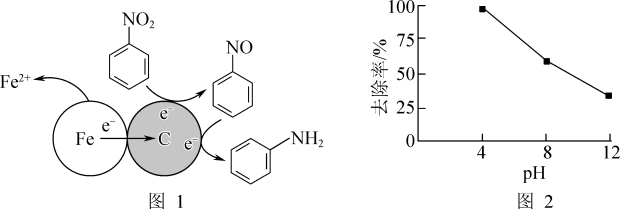
①该物质转化示意图可以描述为_______ 。
②其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图2所示。pH越大,硝基苯的去除率越低的原因是_______ 。
(2)向含Fe2+和苯胺(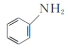 )的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O
)的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O
①HO·(羟基自由基)具有强氧化性,能将溶液中的苯胺氧化成CO2和N2。写出该反应的离子方程式:_______ 。
②H2O2也具有氧化性,设计验证苯胺是被HO·氧化而不是被H2O2氧化的实验方案:_______ 。
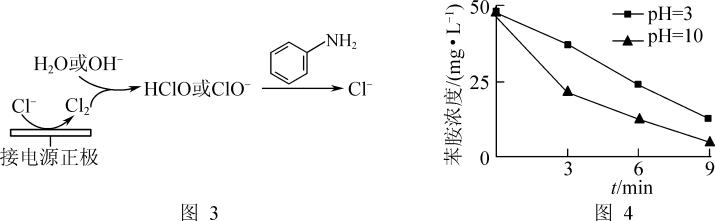
(3)利用电化学装置通过间接氧化法能氧化含苯胺的污水,其原理如图3所示。其他条件一定,测得不同初始pH条件下,溶液中苯胺的浓度与时间的关系如图4所示。反应相同时间,初始溶液pH=3时苯胺浓度大于pH=10时的原因是_______ 。[已知氧化性:HClO(H+)>ClO-(OH-)]
(1)酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图1所示。

①该物质转化示意图可以描述为
②其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图2所示。pH越大,硝基苯的去除率越低的原因是
(2)向含Fe2+和苯胺(
 )的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O
)的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O①HO·(羟基自由基)具有强氧化性,能将溶液中的苯胺氧化成CO2和N2。写出该反应的离子方程式:
②H2O2也具有氧化性,设计验证苯胺是被HO·氧化而不是被H2O2氧化的实验方案:
(3)利用电化学装置通过间接氧化法能氧化含苯胺的污水,其原理如图3所示。其他条件一定,测得不同初始pH条件下,溶液中苯胺的浓度与时间的关系如图4所示。反应相同时间,初始溶液pH=3时苯胺浓度大于pH=10时的原因是

您最近一年使用:0次
名校
2 . 已知重铬酸钾溶液在酸性条件下具有强氧化性,其氧化性随着溶液pH增大而减弱。其在溶液中存在如下平衡: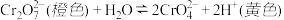 ,下列说法正确的是
,下列说法正确的是
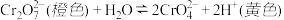 ,下列说法正确的是
,下列说法正确的是| A.上述反应属于氧化还原反应 |
B. 的氧化性强于 的氧化性强于 |
| C.加水稀释重铬酸钾溶液时,上述平衡向左移动 |
| D.用浓盐酸酸化重铬酸钾溶液时,溶液的橙色会加深 |
您最近一年使用:0次
2021-02-03更新
|
234次组卷
|
3卷引用:北京市东城区2020-2021学年高二上学期期末考试化学试题
3 . 甲烷、乙烯是两种重要的有机化合物,回答下列问题:
(1)工业上以乙烷(C2H6)为原料,用传统的热裂解法或现在的氧化裂解法制取乙烯:
①C2H6(g)=C2H4(g) +H2(g) ΔH1=+136kJ/mol;
②2C2H6(g)+O2(g)=2C2H4(g)+2H2O(g) ΔH2=-220kJ/mol
已知上述反应中部分化学键键能数据如下表:
由此计算a=_________ 。
(2)甲烷可用于消除氮氧化物NO2:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g),在温度为T1和T2时,分别降0.5molCH4和1.2molNO2充入1L恒容密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g),在温度为T1和T2时,分别降0.5molCH4和1.2molNO2充入1L恒容密闭容器中发生反应,测得有关数据如下表:
①温度为T1时,0—10min内NO2的平均反应速率v(NO2)=__________________ 。
②根据表中数据判断T1_________ T2(填“>”“<”或“=”),当温度为T2时反应进行到40min时,x_______ 0.15(填“>”“<”或“=”),该反应为_________ (填“放热”或“吸热”)反应。
③单位时间内形成C—H键与形成C==O氧键的数目之比为_________ 时,说明反应达到平衡状态。
④温度为T2时,若相平衡后的容器中再充入0.5molCH4和1.2molNO2,重新达到平衡时,n(N2)的范围是__________________ 。
(3)甲烷、乙烯完全燃烧均生成CO2,常温下H2CO3 H++HCO3- Ka1=4.3×10-7;HCO3-
H++HCO3- Ka1=4.3×10-7;HCO3- H++CO3-2- Ka2=5.6×10-11;NH3·H2O
H++CO3-2- Ka2=5.6×10-11;NH3·H2O NH4++OH- Kb=1.8×10-5;用氨水吸收CO2生成NH4HCO3溶液,则NH4HCO3溶液显
NH4++OH- Kb=1.8×10-5;用氨水吸收CO2生成NH4HCO3溶液,则NH4HCO3溶液显_________ (填“酸性”“碱性”或“中性”),计算反应NH4++HCO3-+H2O NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=_________ (结果保留小数点后1位)
(1)工业上以乙烷(C2H6)为原料,用传统的热裂解法或现在的氧化裂解法制取乙烯:
①C2H6(g)=C2H4(g) +H2(g) ΔH1=+136kJ/mol;
②2C2H6(g)+O2(g)=2C2H4(g)+2H2O(g) ΔH2=-220kJ/mol
已知上述反应中部分化学键键能数据如下表:
| 化学能 | H-H(g) | H-O(g) | O=O(g) |
| 键能( kJ/mol) | 436 | a | 496 |
由此计算a=
(2)甲烷可用于消除氮氧化物NO2:CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(g),在温度为T1和T2时,分别降0.5molCH4和1.2molNO2充入1L恒容密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g),在温度为T1和T2时,分别降0.5molCH4和1.2molNO2充入1L恒容密闭容器中发生反应,测得有关数据如下表:| 温度 | 物质的量 时间/min | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
①温度为T1时,0—10min内NO2的平均反应速率v(NO2)=
②根据表中数据判断T1
③单位时间内形成C—H键与形成C==O氧键的数目之比为
④温度为T2时,若相平衡后的容器中再充入0.5molCH4和1.2molNO2,重新达到平衡时,n(N2)的范围是
(3)甲烷、乙烯完全燃烧均生成CO2,常温下H2CO3
 H++HCO3- Ka1=4.3×10-7;HCO3-
H++HCO3- Ka1=4.3×10-7;HCO3- H++CO3-2- Ka2=5.6×10-11;NH3·H2O
H++CO3-2- Ka2=5.6×10-11;NH3·H2O NH4++OH- Kb=1.8×10-5;用氨水吸收CO2生成NH4HCO3溶液,则NH4HCO3溶液显
NH4++OH- Kb=1.8×10-5;用氨水吸收CO2生成NH4HCO3溶液,则NH4HCO3溶液显 NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=
您最近一年使用:0次
4 . 烟气中SO2和NOx(NO及NO2)的脱除对于环境保护意义重大。
(1)湿式氨法烟气脱硫脱氮是通过氨水吸收烟气,得到含NH4+、SO32-、SO42-、HSO3-、和NO2-的吸收液。
① 用离子方程式解释吸收液中含有SO32-的原因:_______________ 。
② 吸收液中的SO32-、HSO3-均对NO2具有吸收作用,但HSO3-对NO2的吸收能力比SO32-弱。
a. SO32-与NO2反应生成NO2-的离子方程式是_______________________ 。
b. 经测定,在烟气的吸收过程中,吸收液对NO2的吸收率随烟气通入量变化的曲线如下图所示。
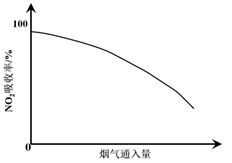
结合化学用语解释产生上述结果的原因:_____________ 。
(2)二氧化氯(ClO2)具有很强的氧化性,可用于烟气中SO2和NO的脱除。
① 酸性条件下,电解NaClO3溶液,生成ClO2的电极反应式是__________ 。
② 研究表明:ClO2氧化SO2和NO的反应历程与下列反应有关。
i.NO + ClO2 === NO2 + ClO
ii.NO + ClO === NO2 + Cl
iii.SO2 + ClO2 === SO3 + ClO
iv.SO2 + ClO === SO3 + Cl
实验测得:ClO2分别氧化纯SO2和纯NO的氧化率以及ClO2氧化SO2和NO混合气中的SO2氧化率随时间的变化情况如下图所示。
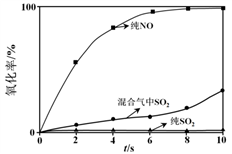
a. 结合上述信息,下列推论合理的是________ (填字母序号)。
A. NO的存在会影响ClO2氧化SO2的反应速率
B. ClO2氧化SO2的反应速率慢于ClO2氧化NO的反应速率
C. 反应i中生成的NO2可以加快ClO2氧化SO2的反应速率
b. 结合反应历程,分析混合气中SO2氧化速率较纯SO2氧化速率快的可能原因是_____ 。
(1)湿式氨法烟气脱硫脱氮是通过氨水吸收烟气,得到含NH4+、SO32-、SO42-、HSO3-、和NO2-的吸收液。
① 用离子方程式解释吸收液中含有SO32-的原因:
② 吸收液中的SO32-、HSO3-均对NO2具有吸收作用,但HSO3-对NO2的吸收能力比SO32-弱。
a. SO32-与NO2反应生成NO2-的离子方程式是
b. 经测定,在烟气的吸收过程中,吸收液对NO2的吸收率随烟气通入量变化的曲线如下图所示。

结合化学用语解释产生上述结果的原因:
(2)二氧化氯(ClO2)具有很强的氧化性,可用于烟气中SO2和NO的脱除。
① 酸性条件下,电解NaClO3溶液,生成ClO2的电极反应式是
② 研究表明:ClO2氧化SO2和NO的反应历程与下列反应有关。
i.NO + ClO2 === NO2 + ClO
ii.NO + ClO === NO2 + Cl
iii.SO2 + ClO2 === SO3 + ClO
iv.SO2 + ClO === SO3 + Cl
实验测得:ClO2分别氧化纯SO2和纯NO的氧化率以及ClO2氧化SO2和NO混合气中的SO2氧化率随时间的变化情况如下图所示。

a. 结合上述信息,下列推论合理的是
A. NO的存在会影响ClO2氧化SO2的反应速率
B. ClO2氧化SO2的反应速率慢于ClO2氧化NO的反应速率
C. 反应i中生成的NO2可以加快ClO2氧化SO2的反应速率
b. 结合反应历程,分析混合气中SO2氧化速率较纯SO2氧化速率快的可能原因是
您最近一年使用:0次
解题方法
5 . 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
CH3CH=CH2+CO+H2 CH3CH2CH2CHO
CH3CH2CH2CHO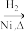 CH3CH2CH2CH2OH
CH3CH2CH2CH2OH
CO的制备原理:HCOOH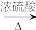 CO↑+H2O,并设计出原料气的制备装置(如下图所示)。
CO↑+H2O,并设计出原料气的制备装置(如下图所示)。
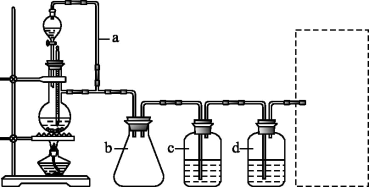
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式:_______ ,_______ 。
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是_______ ,_______ ;c和d中盛装的试剂分别是_______ ,_______ 。若用以上装置制备H2,气体发生装置中必需的玻璃仪器名称是_______ ;在虚线框内画出收集干燥H2的装置图_______ 。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这4种气体,混合气体通过试剂的顺序是_______ (填序号)。
①饱和Na2SO3溶液 ②KMnO4酸性溶液 ③澄清石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是_______ (填字母序号)。
a.低温、高压、催化剂 b.适当的温度、高压、催化剂 c.常温、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品。为纯化1-丁醇,该小组查阅文献得知:
①R—CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;
②沸点:乙醚34 ℃,1-丁醇118 ℃,并设计出如下提纯路线:
粗品 滤液
滤液
 有机层
有机层 1-丁醇
1-丁醇
乙醚 纯品
纯品
试剂1为_______ ,操作1为_______ ,操作2为_______ ,操作3为_______ 。
CH3CH=CH2+CO+H2
 CH3CH2CH2CHO
CH3CH2CH2CHO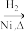 CH3CH2CH2CH2OH
CH3CH2CH2CH2OHCO的制备原理:HCOOH
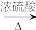 CO↑+H2O,并设计出原料气的制备装置(如下图所示)。
CO↑+H2O,并设计出原料气的制备装置(如下图所示)。
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式:
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这4种气体,混合气体通过试剂的顺序是
①饱和Na2SO3溶液 ②KMnO4酸性溶液 ③澄清石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是
a.低温、高压、催化剂 b.适当的温度、高压、催化剂 c.常温、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品。为纯化1-丁醇,该小组查阅文献得知:
①R—CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;
②沸点:乙醚34 ℃,1-丁醇118 ℃,并设计出如下提纯路线:
粗品
 滤液
滤液
 有机层
有机层 1-丁醇
1-丁醇乙醚
 纯品
纯品试剂1为
您最近一年使用:0次
6 . 硫酸铜晶体(CuSO4·5H2O)是铜盐中重要的无机化工原料,广泛应用于农业、电镀、饲料添加剂、催化剂、石油、选矿、油漆等行业。
I.采用孔雀石[主要成分CuCO3·Cu(OH)2]、硫酸(70%)、氨水为原料制取硫酸铜晶体。其工艺流程如图:

已知:(1)硫酸铜晶体易溶于水,难溶于乙醇。
(2)硫酸铜晶体在102℃时失水成CuSO4·3H2O,在113℃时失水成CuSO4·H2O,在258℃时失水成CuSO4。
请回答下列问题:
(1)已知氨浸时发生的反应为CuCO3·Cu(OH)2+8NH3·H2O=[Cu(NH3)4]2(OH)2CO3+8H2O,蒸氨时得到的固体呈黑色。孔雀石经过氨浸、蒸氨操作目的是:___ 。
(2)下列说法正确的是___ 。
A.步骤I,高温可提高浸取率
B.预处理时用破碎机将孔雀石破碎成粒子直径<1mm,其目的是提高反应速率和浸取率
C.步骤III,蒸氨出来的气体有污染,需要净化处理,经吸收净化所得的溶液可作化肥
D.步骤IV,固液分离操作可采用常压过滤,也可采用减压过滤
(3)步骤IV为一系列的操作:
①使晶体从溶液中析出,可采取的方式有___ (写出两条)。
②减压过滤后,洗涤沉淀可能需要用到以下操作:
a.加入水至浸没沉淀物;b.加入乙醇至浸没沉淀物;c.洗涤剂缓慢通过沉淀物;d.洗涤剂快速通过沉淀物;e.关小水龙头;f.开大水龙头;g.重复2-3次。
请选出正确的操作并排序 → → →f→___ 。
③晶体中所含结晶水可通过重量分析法测定,主要步骤有:a.称量b.置于烘箱中脱结晶水c.冷却d.称量e.重复b~d至恒重f.计算。步骤e的目的是___ 。
④若测得结晶水的含量偏低,则杂质可能是___ 。
II.采用金属铜单质制备硫酸铜晶体
(4)某兴趣小组查阅资料得知:Cu+CuCl2=2CuCl,4CuCl+O2+2H2O=2[Cu(OH)2·CuCl2],[Cu(OH)2·CuCl2]+H2SO4=CuSO4+CuCl2+2H2O。现设计如下实验来制备硫酸铜晶体,装置及相关物质溶解度随温度变化如图:

向铜和稀硫酸的混合物中加入氯化铜溶液,利用二连球鼓入空气,将铜溶解,当三颈烧瓶中呈乳状浑浊液时,滴加浓硫酸。装置中存在一处缺陷是___ ;最后可以利用重结晶的方法纯化硫酸铜晶体的原因为___ 。
I.采用孔雀石[主要成分CuCO3·Cu(OH)2]、硫酸(70%)、氨水为原料制取硫酸铜晶体。其工艺流程如图:

已知:(1)硫酸铜晶体易溶于水,难溶于乙醇。
(2)硫酸铜晶体在102℃时失水成CuSO4·3H2O,在113℃时失水成CuSO4·H2O,在258℃时失水成CuSO4。
请回答下列问题:
(1)已知氨浸时发生的反应为CuCO3·Cu(OH)2+8NH3·H2O=[Cu(NH3)4]2(OH)2CO3+8H2O,蒸氨时得到的固体呈黑色。孔雀石经过氨浸、蒸氨操作目的是:
(2)下列说法正确的是
A.步骤I,高温可提高浸取率
B.预处理时用破碎机将孔雀石破碎成粒子直径<1mm,其目的是提高反应速率和浸取率
C.步骤III,蒸氨出来的气体有污染,需要净化处理,经吸收净化所得的溶液可作化肥
D.步骤IV,固液分离操作可采用常压过滤,也可采用减压过滤
(3)步骤IV为一系列的操作:
①使晶体从溶液中析出,可采取的方式有
②减压过滤后,洗涤沉淀可能需要用到以下操作:
a.加入水至浸没沉淀物;b.加入乙醇至浸没沉淀物;c.洗涤剂缓慢通过沉淀物;d.洗涤剂快速通过沉淀物;e.关小水龙头;f.开大水龙头;g.重复2-3次。
请选出正确的操作并排序 → → →f→
③晶体中所含结晶水可通过重量分析法测定,主要步骤有:a.称量b.置于烘箱中脱结晶水c.冷却d.称量e.重复b~d至恒重f.计算。步骤e的目的是
④若测得结晶水的含量偏低,则杂质可能是
II.采用金属铜单质制备硫酸铜晶体
(4)某兴趣小组查阅资料得知:Cu+CuCl2=2CuCl,4CuCl+O2+2H2O=2[Cu(OH)2·CuCl2],[Cu(OH)2·CuCl2]+H2SO4=CuSO4+CuCl2+2H2O。现设计如下实验来制备硫酸铜晶体,装置及相关物质溶解度随温度变化如图:

向铜和稀硫酸的混合物中加入氯化铜溶液,利用二连球鼓入空气,将铜溶解,当三颈烧瓶中呈乳状浑浊液时,滴加浓硫酸。装置中存在一处缺陷是
您最近一年使用:0次
名校
解题方法
7 . 某实验小组的同学进行如下实验研究影响化学反应速率的因素。
I.以H2O2的分解反应为实验样本,研究浓度、催化剂、温度对化学反应速率的影响。实验方案如下:
通过实验得到O2的体积(V)与反应时间(t)的关系如图所示:请根据图象回答:
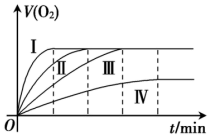
(1)实验方案④所对应的曲线是_______ (用曲线编号回答)。
(2)实验方案①和实验方案②的目的是:研究_______ 。
(3)分析实验②和③的结果,所得到的结论是_______ 。
II.经查阅资料可知Cu2+对H2O2分解也具有催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,研究小组的同学们分别设计了如甲、乙两图所示的实验。请回答:
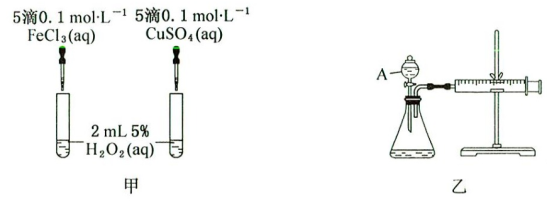
(1)定性分析:通过观察对比图甲中_______ ,可定性判断Fe3+和Cu2+对H2O2分解的催化效果。但是,有同学提出应该将FeCl3改为Fe2(SO4)3更为合理,其理由是_______ 。
(2)定量分析:如图乙所示,实验时均以生成30mL气体为基准,其他可能影响实验的因素均已忽略。图中仪器A的名称为_______ ,实验中需要测量的数据是_______ 。
(3)写出H2O2跟CuSO4溶液混合的化学反应方程式_______ 。
I.以H2O2的分解反应为实验样本,研究浓度、催化剂、温度对化学反应速率的影响。实验方案如下:
| 实验方案编号 | 反应物 | 催化剂 | 温度 |
| ① | 10mL10%H2O2溶液 | 无 | 25℃ |
| ② | 10mL20%H2O2溶液 | 无 | 25℃ |
| ③ | 10mL20%H2O2溶液 | 无 | 40℃ |
| ④ | 10mL20%H2O2溶液 | 1~2滴0.1mol/LFeCl3溶液 | 40℃ |

(1)实验方案④所对应的曲线是
(2)实验方案①和实验方案②的目的是:研究
(3)分析实验②和③的结果,所得到的结论是
II.经查阅资料可知Cu2+对H2O2分解也具有催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,研究小组的同学们分别设计了如甲、乙两图所示的实验。请回答:

(1)定性分析:通过观察对比图甲中
(2)定量分析:如图乙所示,实验时均以生成30mL气体为基准,其他可能影响实验的因素均已忽略。图中仪器A的名称为
(3)写出H2O2跟CuSO4溶液混合的化学反应方程式
您最近一年使用:0次
名校
8 . 为比较 和
和 对
对 分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
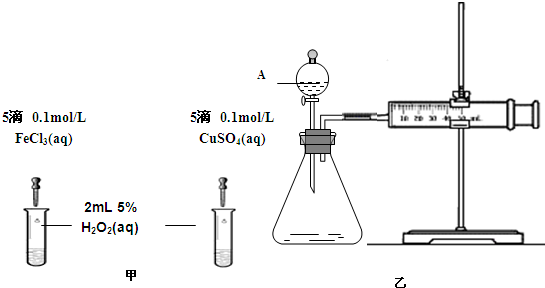
(1)定性分析:如图甲可通过观察_______ 的快慢,定性比较得出结论。有同学提出将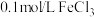 改为
改为_______  更为合理,其理由是
更为合理,其理由是_______ ;
(2)定量分析。如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是_______ ;
(3)查阅资料得知:将作为催化剂的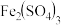 溶液加入
溶液加入 溶液后,溶液中会发生两个氧化还原反应,且两个反应中
溶液后,溶液中会发生两个氧化还原反应,且两个反应中 均参加了反应,试从
均参加了反应,试从催化剂的角度 分析,这两个氧化还原反应的离子方程式分别是: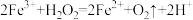 和
和_______ 。
II.欲用下图所示实验来证明 是
是 分解反应的催化剂。
分解反应的催化剂。
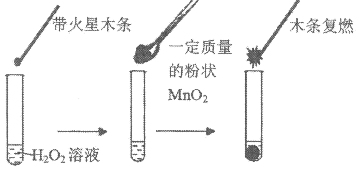
(1)该实验不能达到目的,若想证明 是催化剂还需要确认
是催化剂还需要确认_______ ;
(2)加入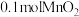 粉末于
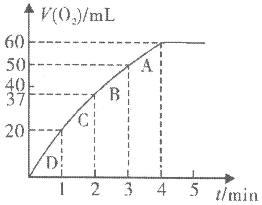
粉末于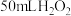 溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
①写出 在二氧化锰作用下发生反应的化学方程式
在二氧化锰作用下发生反应的化学方程式_______ ;
②A、B、C、D各点反应速率快慢的顺序为_______ >_______ >_______ >_______ 。
 和
和 对
对 分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
(1)定性分析:如图甲可通过观察
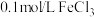 改为
改为 更为合理,其理由是
更为合理,其理由是(2)定量分析。如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是
(3)查阅资料得知:将作为催化剂的
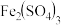 溶液加入
溶液加入 溶液后,溶液中会发生两个氧化还原反应,且两个反应中
溶液后,溶液中会发生两个氧化还原反应,且两个反应中 均参加了反应,试从
均参加了反应,试从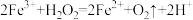 和
和II.欲用下图所示实验来证明
 是
是 分解反应的催化剂。
分解反应的催化剂。
(1)该实验不能达到目的,若想证明
 是催化剂还需要确认
是催化剂还需要确认(2)加入
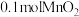 粉末于
粉末于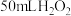 溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
①写出
 在二氧化锰作用下发生反应的化学方程式
在二氧化锰作用下发生反应的化学方程式②A、B、C、D各点反应速率快慢的顺序为
您最近一年使用:0次
9-10高一下·江苏南通·期中
解题方法
9 . 温家宝总理多次指出要大力抓好节能降耗、保护环境。请你分析并回答下列问题:
(1)“绿色化学”的最大特点在于它是在始端就采用预防实际污染的科学手段,因而过程和终端均为零排放和零污染,具有“原子经济性”。下列化学反应不符合“绿色化学”思想的是 ____________________。
(2)冶金废水中含有[Au(CN)2]-,其电离出的CN-有毒,当与H+结合生成HCN时,其毒性更强。工业上处理这种废水是在碱性条件下,用NaClO将CN-氧化为CO32-和一种无毒气体,该反应的方程式为 _____________________________,在酸性条件下,ClO-也能将CN-氧化,但实际处理时却不在酸性条件下进行的主要原因是 ____________________________________________________________。
(3)工业上目前使用两种方法制取乙醛——“乙炔水化法”和“乙烯氧化法”。下面两表提供生产过程中原料、反应条件、原料平衡转化率和产量等的有关信息:
表一:原料、反应条件、平衡转化率、日产量
表二:原料来源生产工艺
从两表中分析,现代工业上“乙烯氧化法”将逐步取代“乙炔水化法”的可能原因。
①从产率和产量角度分析 。
②从环境保护和能耗角度分析 。
(1)“绿色化学”的最大特点在于它是在始端就采用预防实际污染的科学手段,因而过程和终端均为零排放和零污染,具有“原子经济性”。下列化学反应不符合“绿色化学”思想的是 ____________________。
A.制备环氧乙烷: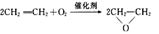 |
B.制备硫酸铜Cu+2H2SO4 CuSO4+SO2↑+2H2O CuSO4+SO2↑+2H2O |
C.制备甲醇: 2CH4+O2 2CH3OH 2CH3OH |
| D.制备硝酸铜:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O |
(3)工业上目前使用两种方法制取乙醛——“乙炔水化法”和“乙烯氧化法”。下面两表提供生产过程中原料、反应条件、原料平衡转化率和产量等的有关信息:
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
表二:原料来源生产工艺
| 原料生产工艺过程 | |
| 乙炔 |   |
| 乙烯 | 来源于石油裂解气 |
①从产率和产量角度分析 。
②从环境保护和能耗角度分析 。
您最近一年使用:0次
名校
解题方法
10 . 为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
(1)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,甲同学设计如下实验(三支试管中均盛有10 mL 5% H2O2 ) :
①实验结论是_______ 。
②实验Ⅲ的目的是_______ 。
(2)为分析不同微粒对H2O2分解的催化作用,乙同学向四支盛有10mL5% H2O2的试管中滴加不同溶液,实验记录如下:
结合实验(1)的Ⅲ,实验(2)可得出的结论是_______ 。
(3)丙同学对实验中Fe3+催化H2O2分解反应的机理产生了兴趣。查阅资料:Fe3+催化H2O2分解反应时发生了两步氧化还原反应:
i.2Fe3++H2O2 = 2Fe2++O2↑+2H+ ;ⅱ.……
①ii的离子方程式是_______ 。
②该小组同学利用下列实验方案了证实上述催化过程。请将实验方案补充完整。
a.取2 mL 5%H2O2溶液于试管中,滴加5滴0.1mol/L FeCl3溶液,充分振荡,迅速产生气泡,_______ ,证明反应ⅰ的发生。
b.另取2mL 5%H2O2溶液于试管中,滴加_______ ,证明反应ⅱ的发生。
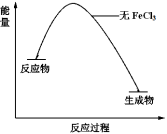
③H2O2溶液中无FeCl3时“反应过程—能量”示意图如图所示,请在图中画出H2O2溶液中加入FeCl3后,对应的“反应过程—能量”图__________ 。
(1)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,甲同学设计如下实验(三支试管中均盛有10 mL 5% H2O2 ) :
试管 | Ⅰ | Ⅱ | Ⅲ |
滴加试剂 | 5滴0.1mol/LFeCl3 | 5滴0.1mol/L CuCl2 | 5滴0.3 mol/LNaCl |
产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
②实验Ⅲ的目的是
(2)为分析不同微粒对H2O2分解的催化作用,乙同学向四支盛有10mL5% H2O2的试管中滴加不同溶液,实验记录如下:
试管 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
滴加试剂 | 2滴1mol/L Na2SO4 | 2滴1mol/L CuSO4 | 2滴1mol/L CuSO4和2滴1mol/L NaCl | 2滴1mol/L CuSO4和4滴1mol/L NaCl |
产生气泡情况 | 无气泡产生 | 均产生气泡,且气泡速率从Ⅱ到Ⅳ依次加快 | ||
(3)丙同学对实验中Fe3+催化H2O2分解反应的机理产生了兴趣。查阅资料:Fe3+催化H2O2分解反应时发生了两步氧化还原反应:
i.2Fe3++H2O2 = 2Fe2++O2↑+2H+ ;ⅱ.……
①ii的离子方程式是
②该小组同学利用下列实验方案了证实上述催化过程。请将实验方案补充完整。
a.取2 mL 5%H2O2溶液于试管中,滴加5滴0.1mol/L FeCl3溶液,充分振荡,迅速产生气泡,
b.另取2mL 5%H2O2溶液于试管中,滴加
③H2O2溶液中无FeCl3时“反应过程—能量”示意图如图所示,请在图中画出H2O2溶液中加入FeCl3后,对应的“反应过程—能量”图

您最近一年使用:0次
2021-02-24更新
|
248次组卷
|
3卷引用:北京市房山区2020-2021学年高二上学期期末考试化学试题
北京市房山区2020-2021学年高二上学期期末考试化学试题(已下线)必考点04 化学反应的方向和调控-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)北京市顺义区杨镇第一中学2022-2023学年高二上学期期中检测化学试题



