名校
1 . 1841年美国学者Fremy首次合成了 ,它是一种“环境友好型氧化剂”。某小组拟制备
,它是一种“环境友好型氧化剂”。某小组拟制备 ,并探究其性质。已知20℃时KCl的溶解度为37.4g,
,并探究其性质。已知20℃时KCl的溶解度为37.4g, 的溶解度为11.1g。
的溶解度为11.1g。
实验(一)制备 ,装置如图所示:
,装置如图所示:

(1)乙装置的作用是___________ 。
(2)甲装置中副产物为氯化钾,写出生成 的离子方程式:
的离子方程式:___________ 。
(3)实验完毕后,对甲装置中混合液蒸发浓缩、___________ 、过滤、洗涤、低温干燥。
实验(二)探究 性质及应用。
性质及应用。
取10g草酸溶于40mL水中,加入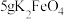 粉末,充分混合,观察到有大量气泡产生,并产生黑色固体,将所得气体通入足量澄清石灰水中,溶液变浑浊。
粉末,充分混合,观察到有大量气泡产生,并产生黑色固体,将所得气体通入足量澄清石灰水中,溶液变浑浊。
(4)根据上述实验现象,可以判断产生的气体中含有___________ ,产生该气体的原因是___________ ,经测定所得气体中还含有 。
。
(5)实验完毕后,将混合物经过滤、洗涤、干燥得到黑色固体,利用如图实验装置探究黑色固体的成分。
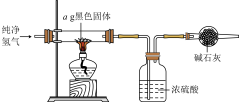
当黑色固体完全反应后,测得浓硫酸质量净增bg,当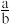 等于
等于___________ (用分数表示)时,黑色固体为 。
。
(6)在其他条件相同时,测得一定浓度的 稳定性(用
稳定性(用 浓度表示)与pH关系如左图,其消毒效率与温度关系如右图所示:
浓度表示)与pH关系如左图,其消毒效率与温度关系如右图所示:
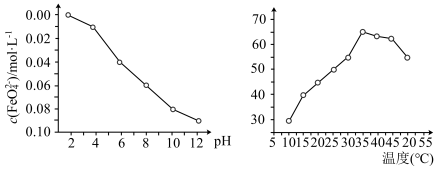
①根据左图得出结论是___________ 。
②在相同条件下, 作消毒剂最佳温度是
作消毒剂最佳温度是___________ 。
(7)查阅资料可知, 溶液呈紫红色,为探究
溶液呈紫红色,为探究 和
和 的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“
的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“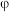 ”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应条件下氧化剂的氧化性越强。)
”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应条件下氧化剂的氧化性越强。)
方案1:在 溶液中加过量的
溶液中加过量的 粉末,溶液呈紫红色。
粉末,溶液呈紫红色。
方案2:如图所示,关闭K时,观察到电流计指针偏转,铂极产生红褐色物质,石墨极附近无色溶液变紫红色。

实验___________ (填“1”或“2”)能证明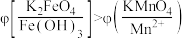 。
。
 ,它是一种“环境友好型氧化剂”。某小组拟制备
,它是一种“环境友好型氧化剂”。某小组拟制备 ,并探究其性质。已知20℃时KCl的溶解度为37.4g,
,并探究其性质。已知20℃时KCl的溶解度为37.4g, 的溶解度为11.1g。
的溶解度为11.1g。实验(一)制备
 ,装置如图所示:
,装置如图所示:
(1)乙装置的作用是
(2)甲装置中副产物为氯化钾,写出生成
 的离子方程式:
的离子方程式:(3)实验完毕后,对甲装置中混合液蒸发浓缩、
实验(二)探究
 性质及应用。
性质及应用。取10g草酸溶于40mL水中,加入
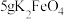 粉末,充分混合,观察到有大量气泡产生,并产生黑色固体,将所得气体通入足量澄清石灰水中,溶液变浑浊。
粉末,充分混合,观察到有大量气泡产生,并产生黑色固体,将所得气体通入足量澄清石灰水中,溶液变浑浊。(4)根据上述实验现象,可以判断产生的气体中含有
 。
。(5)实验完毕后,将混合物经过滤、洗涤、干燥得到黑色固体,利用如图实验装置探究黑色固体的成分。

当黑色固体完全反应后,测得浓硫酸质量净增bg,当
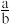 等于
等于 。
。(6)在其他条件相同时,测得一定浓度的
 稳定性(用
稳定性(用 浓度表示)与pH关系如左图,其消毒效率与温度关系如右图所示:
浓度表示)与pH关系如左图,其消毒效率与温度关系如右图所示:
①根据左图得出结论是
②在相同条件下,
 作消毒剂最佳温度是
作消毒剂最佳温度是(7)查阅资料可知,
 溶液呈紫红色,为探究
溶液呈紫红色,为探究 和
和 的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“
的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“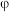 ”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应条件下氧化剂的氧化性越强。)
”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应条件下氧化剂的氧化性越强。)方案1:在
 溶液中加过量的
溶液中加过量的 粉末,溶液呈紫红色。
粉末,溶液呈紫红色。方案2:如图所示,关闭K时,观察到电流计指针偏转,铂极产生红褐色物质,石墨极附近无色溶液变紫红色。

实验
 。
。
您最近一年使用:0次
名校
解题方法
2 . 工业上,以钛白副产品硫酸亚铁制备的铁黄(FeOOH)代替硝酸铁等可溶性铁盐制备高铁酸钾,可降低生产工艺成本且产品质量好。工艺流程如图所示:

已知:①K2FeO4为暗紫色固体,可溶于水,微溶于KOH溶液。
②FeO 具有强氧化性,在酸性或者中性溶液中能产生O2,在碱性溶液中较稳定。
具有强氧化性,在酸性或者中性溶液中能产生O2,在碱性溶液中较稳定。
③铁黄在177℃开始分解。
(1)从电子排布的角度分析,Fe2+稳定性小于Fe3+的原因_______ 。
(2)制备铁黄的离子方程式为_______ 。
(3)实验测得反应液的温度、pH对铁黄产量的影响如图所示。
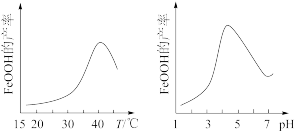
①反应液温度高于40 °C时,铁黄的产量下降的原因可能是_______ 。
②pH大于4.5时铁黄产量降低的主要原因可能是_______ 。
(4)粗产品K2FeO4提纯时采用重结晶、洗涤、低温烘干的方法,洗涤剂最好选用 _______(填序号)。
(5)用K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的S2-、CN-、NH3等,生成的Fe(OH)3胶体还能吸附水中的悬浮杂质。试写出K2FeO4处理含有CN- 的碱性污水时与CN-反应的离子方程式_______ 。

已知:①K2FeO4为暗紫色固体,可溶于水,微溶于KOH溶液。
②FeO
 具有强氧化性,在酸性或者中性溶液中能产生O2,在碱性溶液中较稳定。
具有强氧化性,在酸性或者中性溶液中能产生O2,在碱性溶液中较稳定。③铁黄在177℃开始分解。
(1)从电子排布的角度分析,Fe2+稳定性小于Fe3+的原因
(2)制备铁黄的离子方程式为
(3)实验测得反应液的温度、pH对铁黄产量的影响如图所示。
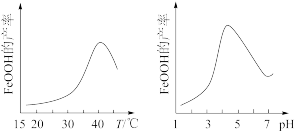
①反应液温度高于40 °C时,铁黄的产量下降的原因可能是
②pH大于4.5时铁黄产量降低的主要原因可能是
(4)粗产品K2FeO4提纯时采用重结晶、洗涤、低温烘干的方法,洗涤剂最好选用 _______(填序号)。
| A.冰水 | B.NaOH溶液 | C.稀硫酸 | D.Fe(NO3)3溶液 |
您最近一年使用:0次
2022-09-02更新
|
333次组卷
|
4卷引用:江苏省南菁高中、梁丰高中2023-2024学年高三上学期8月自主学习检测化学试题
2020·北京·模拟预测
名校
解题方法
3 . 某研究小组对碘化钾溶液在空气中发生氧化反应的速率进行实验探究。
【初步探究】
(1)为探究温度对反应速率的影响,实验②中试剂 A 应为______________ 。
(2)写出实验③中 I-反应的离子方程式:_____________________ 。
(3)对比实验②③④,可以得出的结论:_______________________ 。
【继续探究】溶液 pH 对反应速率的影响查阅资料:
i.pH<11.7 时,I-能被O2 氧化为 I2。
ii.pH= 9.28 时,I2发生歧化反应:3I2 +6OH-=IO3-+5I-+3H2O,pH越大,歧化速率越快。
(4)小组同学用 4 支试管在装有 O2 的储气瓶中进行实验,装置如图所示。

分析⑦和⑧中颜色无明显变化的原因_______ 。
(5)甲同学利用原电池原理设计实验证实 pH=10 的条件下确实可以发生 I-被 O2 氧化为 I2 的反应,如图所示,请你填写试剂和实验现象。
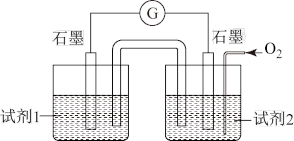
试剂1______________ 。 试剂2______________ 。实验现象:___________________________ 。
【深入探究】较高温度对反应速率的影响
小组同学分别在敞口试管和密闭试管中进行了实验⑨和⑩。
(6)对比实验⑨和⑩的现象差异,该小组同学对实验⑨中的现象提出两种假设,请你补充假设 1。
假设 1:_______________ 。
假设 2:45°C 以上 I2 易升华,70°C 水浴时,c(I2)太小难以显现黄色。
(7)针对假设 2 有两种不同观点。你若认为假设 2 成立,请推测试管⑨中“冷却至室温后滴加淀粉出现蓝色”的可能原因_______________ (写出一条)。你若认为假设 2 不成立,请设计实验方案证明_______________ 。
【初步探究】
| 示意图 | 序号 | 温度 | 试剂A | 现象 |
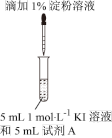 | ① | 0°C | 0.5 mol∙L−1稀硫酸 | 4 min 左右出现蓝色 |
| ② | 20°C | 1 min 左右出现蓝色 | ||
| ③ | 20°C | 0.1 mol∙L−1稀硫酸 | 15 min 左右出现蓝色 | |
| ④ | 20°C | 蒸馏水 | 30 min 左右出现蓝色 |
(2)写出实验③中 I-反应的离子方程式:
(3)对比实验②③④,可以得出的结论:
【继续探究】溶液 pH 对反应速率的影响查阅资料:
i.pH<11.7 时,I-能被O2 氧化为 I2。
ii.pH= 9.28 时,I2发生歧化反应:3I2 +6OH-=IO3-+5I-+3H2O,pH越大,歧化速率越快。
(4)小组同学用 4 支试管在装有 O2 的储气瓶中进行实验,装置如图所示。

| 序号 | ⑤ | ⑥ | ⑦ | ⑧ |
| 试管中溶液的 pH | 8 | 9 | 10 | 11 |
| 放置 10 小时后的现象 | 出现蓝色 | 颜色无明显变化 | ||
(5)甲同学利用原电池原理设计实验证实 pH=10 的条件下确实可以发生 I-被 O2 氧化为 I2 的反应,如图所示,请你填写试剂和实验现象。

试剂1
【深入探究】较高温度对反应速率的影响
小组同学分别在敞口试管和密闭试管中进行了实验⑨和⑩。
| 序号 | 温度 | 试剂 | 现象 |
| ⑨敞口试管 | 水浴 70°C | 5 mL 1 mol∙L−1 KI 溶液 5 mL 0.5 mol∙L−1 稀硫酸 | 20 min 内仍保持无色,冷却至室温后滴加淀粉溶液出现蓝色 |
| ⑩密闭试管 | 溶液迅速出现黄色,且黄色逐渐加深,冷却至室温后滴加淀粉溶液出现蓝色 |
假设 1:
假设 2:45°C 以上 I2 易升华,70°C 水浴时,c(I2)太小难以显现黄色。
(7)针对假设 2 有两种不同观点。你若认为假设 2 成立,请推测试管⑨中“冷却至室温后滴加淀粉出现蓝色”的可能原因
您最近一年使用:0次
2020-05-02更新
|
595次组卷
|
3卷引用:北京师范大学附属中学2022-2023学年高三上学期统练(VII)化学试题
北京师范大学附属中学2022-2023学年高三上学期统练(VII)化学试题(已下线)《2020年新高考政策解读与配套资源》模拟试题02-2020年北京新高考化学模拟试题北京市第八中学 2020届高三下学期化学自主测试三
解题方法
4 . 某小组设计制备补铁剂甘氨酸亚铁的实验步骤和装置图(夹持装置省略)如图:
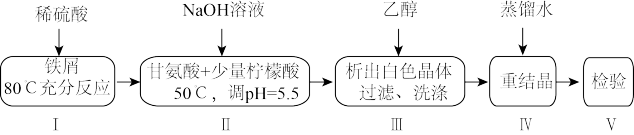
合成反应为:2H2NCH2COOH+FeSO4+2NaOH=(H2NCH2COO)2Fe+Na2SO4+2H2O。
有关物质性质如表所示:
回答下列问题:
(1)步骤I制备FeSO4,先打开K1、K2,关闭K3,充分反应后(仍有气泡),将B中溶液转移到D中的操作是______ 。
(2)步骤I、II中,为了防止Fe2+被氧化,采取的措施有______ 、______ (填2种)。
(3)步骤II,D中反应液pH过高或过低均会导致产率降低,原因是______ 。
(4)下列说法不正确 的是______ 。
(5)步骤V,检测产品中铁元素的含量,需要用到如图电子天平,以差量法 准确称量样品。操作的正确排序为:电子天平开机预热→A→B→______→______→______→______→F。______

A.调水平(使水平仪气泡归中)
B.利用标准码进行校准
C.往称量瓶中加入一定量样品,放回秤盘
D.将称量瓶置于秤盘中间,待示数不变时,按TAR键去皮
E.从称量瓶中倒出一定量样品,放回秤盘
F.关闭侧门,待示数不变时读数记录

合成反应为:2H2NCH2COOH+FeSO4+2NaOH=(H2NCH2COO)2Fe+Na2SO4+2H2O。
有关物质性质如表所示:
| 甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,微溶于乙醇 |
| 具有两性 | 酸性和还原性 | 常温不易,氧化变质 |

回答下列问题:
(1)步骤I制备FeSO4,先打开K1、K2,关闭K3,充分反应后(仍有气泡),将B中溶液转移到D中的操作是
(2)步骤I、II中,为了防止Fe2+被氧化,采取的措施有
(3)步骤II,D中反应液pH过高或过低均会导致产率降低,原因是
(4)下列说法
| A.步骤I、II使用滴液漏斗A或C滴入液体时,无需取下上口玻璃塞 |
| B.步骤III加入乙醇的作用是降低甘氨酸亚铁的溶解度,促使其结晶析出 |
| C.步骤III过滤后洗涤,往漏斗中加水浸没沉淀,小心搅拌以加快过滤 |
| D.步骤IV重结晶,将粗产品溶解于适量水中,蒸发浓缩至出现大量晶体,趁热过滤 |

A.调水平(使水平仪气泡归中)
B.利用标准码进行校准
C.往称量瓶中加入一定量样品,放回秤盘
D.将称量瓶置于秤盘中间,待示数不变时,按TAR键去皮
E.从称量瓶中倒出一定量样品,放回秤盘
F.关闭侧门,待示数不变时读数记录
您最近一年使用:0次
名校
5 . 二氧化氯(ClO2)具有强氧化性,是优良的饮用水消毒剂。ClO2常温下为黄绿色气体,熔点-59℃,沸点11℃,极易溶于水且不与水反应,浓的ClO2受热时易爆炸。我国广泛使用的方法是用干燥的Cl2与NaClO2固体反应制取ClO2,实验室模拟制备ClO2装置如图所示:
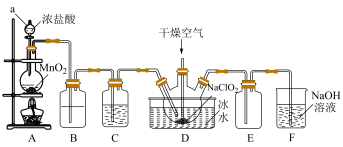
(1)仪器a的名称是:___________ ,装置A中反应的离子方程式为:___________ 。
(2)装置B中盛装的试剂是___________ ,装置C中试剂的作用是:___________ 。
(3)为防止ClO2制备装置发生爆炸,实验中采取的措施:①将装置置于冰水浴中降温,②___________ 。
(4)装置E为ClO2的收集装置,应将其置于___________ 水浴中(填“热”或“冰”)。
(5)装置F为氯气的尾气吸收装置,小组同学用胶头滴管将新制的饱和氯水慢慢滴入含有酚酞的NaOH溶液中,当滴到一定量时,红色突然褪去,小组同学对褪色原因提出假设:
假设1:___________ 。
假设2:可能是氯水中存在HClO具有强氧化性,漂白褪色。
该小组同学设计实验证明假设1是否成立。实验方案为:取少许褪色后的溶液于试管中,滴加足量的NaOH溶液,若___________ (填“实验现象”),则假设1成立。

(1)仪器a的名称是:
(2)装置B中盛装的试剂是
(3)为防止ClO2制备装置发生爆炸,实验中采取的措施:①将装置置于冰水浴中降温,②
(4)装置E为ClO2的收集装置,应将其置于
(5)装置F为氯气的尾气吸收装置,小组同学用胶头滴管将新制的饱和氯水慢慢滴入含有酚酞的NaOH溶液中,当滴到一定量时,红色突然褪去,小组同学对褪色原因提出假设:
假设1:
假设2:可能是氯水中存在HClO具有强氧化性,漂白褪色。
该小组同学设计实验证明假设1是否成立。实验方案为:取少许褪色后的溶液于试管中,滴加足量的NaOH溶液,若
您最近一年使用:0次
2023-11-06更新
|
632次组卷
|
2卷引用:宁夏银川市第二中学2023-2024学年高一上学期期中考试化学试题
名校
解题方法
6 . 次氯酸盐是常用的水处理剂。
已知:①有效氯含量(COAC)指与含氯消毒剂氧化能力相当的氯气量,单位为 。
。
②物质氧化性越强,氧化还原电位(ORP)越高。
③相同条件下,次氯酸的氧化性大于次氯酸盐
(1)配制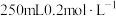 的
的 溶液
溶液
i、量取冰醋酸时应选用仪器___________ 。(填标号)
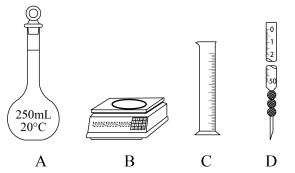
ii、冬季低温环境冰醋酸凝固时如何取出___________ 。
(2)温度及pH对 溶液有效氯含量(COAC)及氧化还原电位的影响:
溶液有效氯含量(COAC)及氧化还原电位的影响:
在不同温度下,用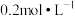 的乙酸溶液调节pH得到
的乙酸溶液调节pH得到 溶液COCA、ORP的关系如图1、图2所示。
溶液COCA、ORP的关系如图1、图2所示。
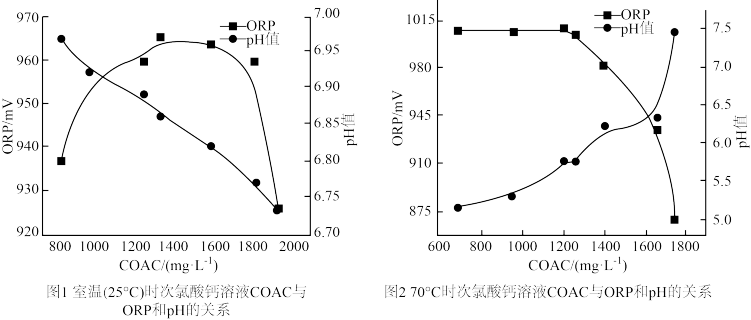
i.由图1可知,随着少量乙酸的滴入, 溶液的pH在
溶液的pH在___________ (填“增大”或“减小”。)
ii. 溶液氧化性在
溶液氧化性在 最大的原因是
最大的原因是___________ 。
iii. 溶液用于消毒时适宜的条件是:温度
溶液用于消毒时适宜的条件是:温度___________ 、pH___________ (填标号)。
A.25℃ B.70℃ C.5.75 D.6.85
(3)某小组探究70℃时,pH值及稳定剂对NaClO溶液有效氯含量的影响。甲同学设计实验方案如下
i.设计实验1和2的目的是___________ 。
ii.实验5中的a___________ 0.935(填“大于”、“小于”或“等于”)。
iii.根据实验3-5,可得出的结论是___________ 。
iv。下列物质中最适宜做为NaClO溶液稳定剂的是___________ 。
A. B.NaCl C.
B.NaCl C. D.
D.
已知:①有效氯含量(COAC)指与含氯消毒剂氧化能力相当的氯气量,单位为
 。
。②物质氧化性越强,氧化还原电位(ORP)越高。
③相同条件下,次氯酸的氧化性大于次氯酸盐
(1)配制
 的
的 溶液
溶液i、量取冰醋酸时应选用仪器

ii、冬季低温环境冰醋酸凝固时如何取出
(2)温度及pH对
 溶液有效氯含量(COAC)及氧化还原电位的影响:
溶液有效氯含量(COAC)及氧化还原电位的影响:在不同温度下,用
 的乙酸溶液调节pH得到
的乙酸溶液调节pH得到 溶液COCA、ORP的关系如图1、图2所示。
溶液COCA、ORP的关系如图1、图2所示。
i.由图1可知,随着少量乙酸的滴入,
 溶液的pH在
溶液的pH在ii.
 溶液氧化性在
溶液氧化性在 最大的原因是
最大的原因是iii.
 溶液用于消毒时适宜的条件是:温度
溶液用于消毒时适宜的条件是:温度A.25℃ B.70℃ C.5.75 D.6.85
(3)某小组探究70℃时,pH值及稳定剂对NaClO溶液有效氯含量的影响。甲同学设计实验方案如下
| 序号 | 硅酸钠的质量分数 | 碳酸钠的质量分数 | 初始COAC | pH值 | 12h后COAC | 12h后COAC/初始COAC |
| 1 | 0 | 0 | 1794 | 8.53 | 1218 | 0.679 |
| 2 | 0 | 0 | 1794 | 8.63 | 1288 | 0.718 |
| 3 | 0.9% | 0.6% | 1794 | 13.44 | 1676 | 0.935 |
| 4 | 1.5% | 0 | 1834 | 13.76 | 1597 | 0.871 |
| 5 | 0 | 1.5% | 1834 | 13.66 | - | a |
ii.实验5中的a
iii.根据实验3-5,可得出的结论是
iv。下列物质中最适宜做为NaClO溶液稳定剂的是
A.
 B.NaCl C.
B.NaCl C. D.
D.
您最近一年使用:0次
名校
7 .  可通过
可通过 与
与 在碱性溶液中反应制备。
在碱性溶液中反应制备。 和
和 均可用于氧化去除高氯(含高浓度
均可用于氧化去除高氯(含高浓度 )废水中的有机物。
)废水中的有机物。
(1)用 处理高氯废水中的有机物时,需在一定条件下使用。
处理高氯废水中的有机物时,需在一定条件下使用。
① 时,
时, 分解放出
分解放出 并产生
并产生 沉淀,该反应的离子方程式为
沉淀,该反应的离子方程式为_______ 。
②酸性溶液中 的氧化性大于
的氧化性大于 的氧化性。
的氧化性。 处理高氯废水中的有机物需在碱性条件下进行,其原因是
处理高氯废水中的有机物需在碱性条件下进行,其原因是_______ 。
(2)用 处理高氯废水中的有机物时,研究了“
处理高氯废水中的有机物时,研究了“ ”和“
”和“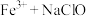 ”两种体系对高氯废水中有机物的氧化率(废水中被氧化有机物的量占废水中有机物总量的百分率)。
”两种体系对高氯废水中有机物的氧化率(废水中被氧化有机物的量占废水中有机物总量的百分率)。
①当废水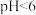 时,仅使用
时,仅使用 处理高氯废水,有机物的氧化率较低,其原因是
处理高氯废水,有机物的氧化率较低,其原因是_______ 。
②当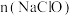 相同时,使用“
相同时,使用“ ”与“
”与“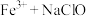 ”处理高氯废水,废水中有机物的氧化率随废水
”处理高氯废水,废水中有机物的氧化率随废水 的变化如题图所示。与“
的变化如题图所示。与“ ”体系相比,“
”体系相比,“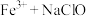 ”体系中有机物氧化率随着废水
”体系中有机物氧化率随着废水 升高显著增大的可能原因是
升高显著增大的可能原因是_______ 。
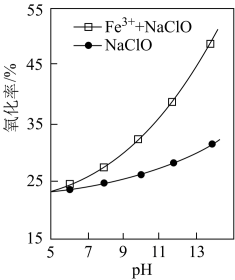
 可通过
可通过 与
与 在碱性溶液中反应制备。
在碱性溶液中反应制备。 和
和 均可用于氧化去除高氯(含高浓度
均可用于氧化去除高氯(含高浓度 )废水中的有机物。
)废水中的有机物。(1)用
 处理高氯废水中的有机物时,需在一定条件下使用。
处理高氯废水中的有机物时,需在一定条件下使用。①
 时,
时,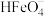 分解放出
分解放出 并产生
并产生 沉淀,该反应的离子方程式为
沉淀,该反应的离子方程式为②酸性溶液中
 的氧化性大于
的氧化性大于 的氧化性。
的氧化性。 处理高氯废水中的有机物需在碱性条件下进行,其原因是
处理高氯废水中的有机物需在碱性条件下进行,其原因是(2)用
 处理高氯废水中的有机物时,研究了“
处理高氯废水中的有机物时,研究了“ ”和“
”和“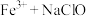 ”两种体系对高氯废水中有机物的氧化率(废水中被氧化有机物的量占废水中有机物总量的百分率)。
”两种体系对高氯废水中有机物的氧化率(废水中被氧化有机物的量占废水中有机物总量的百分率)。①当废水
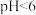 时,仅使用
时,仅使用 处理高氯废水,有机物的氧化率较低,其原因是
处理高氯废水,有机物的氧化率较低,其原因是②当
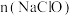 相同时,使用“
相同时,使用“ ”与“
”与“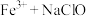 ”处理高氯废水,废水中有机物的氧化率随废水
”处理高氯废水,废水中有机物的氧化率随废水 的变化如题图所示。与“
的变化如题图所示。与“ ”体系相比,“
”体系相比,“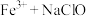 ”体系中有机物氧化率随着废水
”体系中有机物氧化率随着废水 升高显著增大的可能原因是
升高显著增大的可能原因是
您最近一年使用:0次
2021-04-19更新
|
654次组卷
|
3卷引用:常见无机物的性质
解题方法
8 . 实验室以碳酸铈[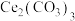 ]为原料制备氧化铈(
]为原料制备氧化铈( )粉末,部分实验过程如下:
)粉末,部分实验过程如下:
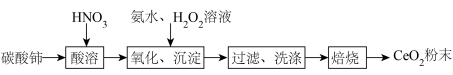
已知: 难溶于稀硝酸;
难溶于稀硝酸; 极易水解,酸性较强时有强氧化性。
极易水解,酸性较强时有强氧化性。
(1)“氧化、沉淀”过程
①向酸溶后的溶液中加入氨水和 溶液,维持pH为5~6充分反应,生成胶状红褐色过氧化铈[
溶液,维持pH为5~6充分反应,生成胶状红褐色过氧化铈[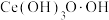 ]沉淀,加热煮沸,过氧化铈转化为黄色氢氧化铈[
]沉淀,加热煮沸,过氧化铈转化为黄色氢氧化铈[ ]。反应生成过氧化铈的离子方程式为
]。反应生成过氧化铈的离子方程式为___________ 。
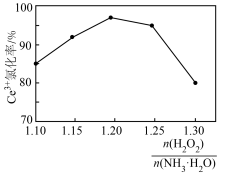
②双氧水与氨水的加入量之比对 氧化率的影响如图所示,
氧化率的影响如图所示, 与
与 物质的量之比大于1.20时,
物质的量之比大于1.20时, 氧化率下降的原因是
氧化率下降的原因是___________ 。
(2)“过滤、洗涤”过程
①“过滤”需用到的玻璃仪器有烧杯、漏斗和___________ 。
②“洗涤”的实验操作是___________ 。
(3)“焙烧”过程
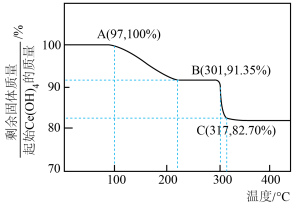
焙烧 过程中测得剩余固体质量与起始固体质量的比值随温度变化的曲线如图所示。则301~317℃范围内,B→C发生反应的化学方程式为
过程中测得剩余固体质量与起始固体质量的比值随温度变化的曲线如图所示。则301~317℃范围内,B→C发生反应的化学方程式为___________ (写出确定物质化学式的计算过程)。
(4)由稀土碳酸盐获取
以稀土碳酸盐样品[含有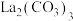 、
、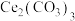 和可溶性
和可溶性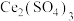 ]为原料可获得纯净的
]为原料可获得纯净的 请补充实验方案:向稀土碳酸盐样品中
请补充实验方案:向稀土碳酸盐样品中______ ,烘干,得到 固体。[已知:
固体。[已知: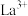 不与
不与 反应;
反应;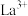 、
、 开始转化为氢氧化物沉淀的pH分别为7.8、7.6;可选用的试剂有:1
开始转化为氢氧化物沉淀的pH分别为7.8、7.6;可选用的试剂有:1 氨水、30%
氨水、30% 溶液、2
溶液、2
 溶液、2mol·L-1HCl溶液、1mol·L-1
溶液、2mol·L-1HCl溶液、1mol·L-1 溶液、去离子水]
溶液、去离子水]
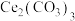 ]为原料制备氧化铈(
]为原料制备氧化铈( )粉末,部分实验过程如下:
)粉末,部分实验过程如下:
已知:
 难溶于稀硝酸;
难溶于稀硝酸; 极易水解,酸性较强时有强氧化性。
极易水解,酸性较强时有强氧化性。(1)“氧化、沉淀”过程
①向酸溶后的溶液中加入氨水和
 溶液,维持pH为5~6充分反应,生成胶状红褐色过氧化铈[
溶液,维持pH为5~6充分反应,生成胶状红褐色过氧化铈[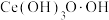 ]沉淀,加热煮沸,过氧化铈转化为黄色氢氧化铈[
]沉淀,加热煮沸,过氧化铈转化为黄色氢氧化铈[ ]。反应生成过氧化铈的离子方程式为
]。反应生成过氧化铈的离子方程式为②双氧水与氨水的加入量之比对
 氧化率的影响如图所示,
氧化率的影响如图所示, 与
与 物质的量之比大于1.20时,
物质的量之比大于1.20时, 氧化率下降的原因是
氧化率下降的原因是
(2)“过滤、洗涤”过程
①“过滤”需用到的玻璃仪器有烧杯、漏斗和
②“洗涤”的实验操作是
(3)“焙烧”过程
焙烧
 过程中测得剩余固体质量与起始固体质量的比值随温度变化的曲线如图所示。则301~317℃范围内,B→C发生反应的化学方程式为
过程中测得剩余固体质量与起始固体质量的比值随温度变化的曲线如图所示。则301~317℃范围内,B→C发生反应的化学方程式为
(4)由稀土碳酸盐获取

以稀土碳酸盐样品[含有
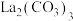 、
、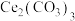 和可溶性
和可溶性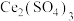 ]为原料可获得纯净的
]为原料可获得纯净的 请补充实验方案:向稀土碳酸盐样品中
请补充实验方案:向稀土碳酸盐样品中 固体。[已知:
固体。[已知: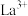 不与
不与 反应;
反应;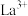 、
、 开始转化为氢氧化物沉淀的pH分别为7.8、7.6;可选用的试剂有:1
开始转化为氢氧化物沉淀的pH分别为7.8、7.6;可选用的试剂有:1 氨水、30%
氨水、30% 溶液、2
溶液、2
 溶液、2mol·L-1HCl溶液、1mol·L-1
溶液、2mol·L-1HCl溶液、1mol·L-1 溶液、去离子水]
溶液、去离子水]
您最近一年使用:0次
21-22高三上·江苏南通·期末
名校
解题方法
9 . 用化学方法降解水中有机物已成为污水处理领域的重要研究方向。
(1)酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图1所示。
①该物质转化示意图可以描述为_______ 。
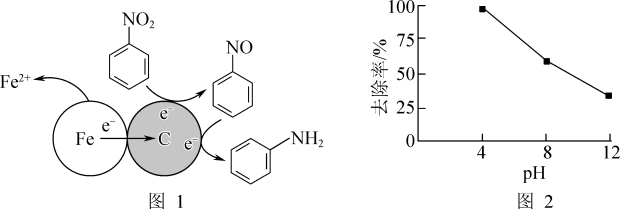
②其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图2所示。pH越大,硝基苯的去除率越低的原因是_______ 。
(2)向含Fe2+和苯胺( )的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O
)的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O
①HO·(羟基自由基)具有强氧化性,能将溶液中的苯胺氧化成CO2和N2。写出该反应的离子方程式:_______ 。
②H2O2也具有氧化性,设计验证苯胺是被HO·氧化而不是被H2O2氧化的实验方案:_______ 。
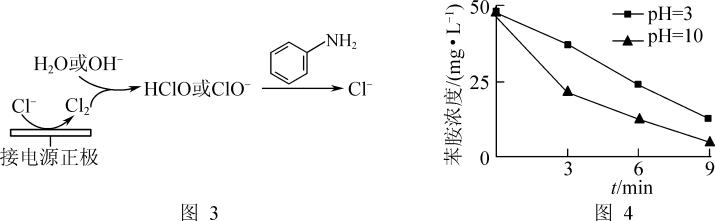
(3)利用电化学装置通过间接氧化法能氧化含苯胺的污水,其原理如图3所示。其他条件一定,测得不同初始pH条件下,溶液中苯胺的浓度与时间的关系如图4所示。反应相同时间,初始溶液pH=3时苯胺浓度大于pH=10时的原因是_______ 。[已知氧化性:HClO(H+)>ClO-(OH-)]
(1)酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图1所示。

①该物质转化示意图可以描述为
②其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图2所示。pH越大,硝基苯的去除率越低的原因是
(2)向含Fe2+和苯胺(
 )的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O
)的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O①HO·(羟基自由基)具有强氧化性,能将溶液中的苯胺氧化成CO2和N2。写出该反应的离子方程式:
②H2O2也具有氧化性,设计验证苯胺是被HO·氧化而不是被H2O2氧化的实验方案:
(3)利用电化学装置通过间接氧化法能氧化含苯胺的污水,其原理如图3所示。其他条件一定,测得不同初始pH条件下,溶液中苯胺的浓度与时间的关系如图4所示。反应相同时间,初始溶液pH=3时苯胺浓度大于pH=10时的原因是

您最近一年使用:0次
名校
解题方法
10 . 钌 粉主要用于生产钌靶材,而钌靶材是生产计算机硬盘不可替代的材料。以钌废料(废料中钌主要以单质的形式存在,还含有Al、Cr、Cr、CO、Ti、Fe等杂质)制备高纯钌粉的流程如下:
粉主要用于生产钌靶材,而钌靶材是生产计算机硬盘不可替代的材料。以钌废料(废料中钌主要以单质的形式存在,还含有Al、Cr、Cr、CO、Ti、Fe等杂质)制备高纯钌粉的流程如下:
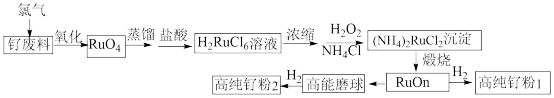
已知:i.钌在碱性条件下被氯气氧化为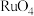 ,
,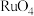 是有毒的挥发性物质,用盐酸吸收得到红色
是有毒的挥发性物质,用盐酸吸收得到红色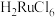 溶液,其中还含有少量
溶液,其中还含有少量 ;
;
ii.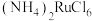 易溶于水,微溶于酒精。
易溶于水,微溶于酒精。
回答下列问题:
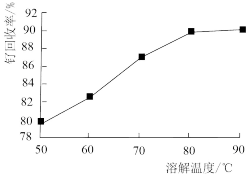
(1)钌废料在碱性条件下被氯气氧化的离子方程式为_______ ;钌废料氧化时,随着温度的升高,钌的回收率变化如图所示。综合考虑,确定氧化时的温度以_______ ℃为宜。
(2)用盐酸吸收蒸馏产物时发生主要反应的化学方程式是_______ 。
(3)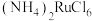 沉淀用乙醇洗涤而不用水洗涤的优点是
沉淀用乙醇洗涤而不用水洗涤的优点是_______ 。
(4)加入 的主要作用是
的主要作用是_______ ,同时又调节了溶液的 ,有利于沉淀反应的发生。流程中可以循环利用的物质
,有利于沉淀反应的发生。流程中可以循环利用的物质_______ 。
(5)煅烧的过程分为两步:第1步是氯钌酸铵分解生成钌单质和一种无毒的气体单质,同时有两种化合物生成;第2步是钌单质与氧气反应生成钌的氧化物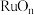 (
(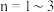 )。第1步的化学方程式是
)。第1步的化学方程式是_______ 。
 粉主要用于生产钌靶材,而钌靶材是生产计算机硬盘不可替代的材料。以钌废料(废料中钌主要以单质的形式存在,还含有Al、Cr、Cr、CO、Ti、Fe等杂质)制备高纯钌粉的流程如下:
粉主要用于生产钌靶材,而钌靶材是生产计算机硬盘不可替代的材料。以钌废料(废料中钌主要以单质的形式存在,还含有Al、Cr、Cr、CO、Ti、Fe等杂质)制备高纯钌粉的流程如下: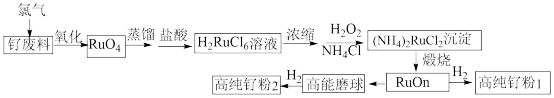
已知:i.钌在碱性条件下被氯气氧化为
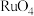 ,
,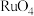 是有毒的挥发性物质,用盐酸吸收得到红色
是有毒的挥发性物质,用盐酸吸收得到红色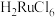 溶液,其中还含有少量
溶液,其中还含有少量 ;
;ii.
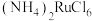 易溶于水,微溶于酒精。
易溶于水,微溶于酒精。回答下列问题:
(1)钌废料在碱性条件下被氯气氧化的离子方程式为

(2)用盐酸吸收蒸馏产物时发生主要反应的化学方程式是
(3)
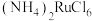 沉淀用乙醇洗涤而不用水洗涤的优点是
沉淀用乙醇洗涤而不用水洗涤的优点是(4)加入
 的主要作用是
的主要作用是 ,有利于沉淀反应的发生。流程中可以循环利用的物质
,有利于沉淀反应的发生。流程中可以循环利用的物质(5)煅烧的过程分为两步:第1步是氯钌酸铵分解生成钌单质和一种无毒的气体单质,同时有两种化合物生成;第2步是钌单质与氧气反应生成钌的氧化物
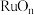 (
(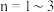 )。第1步的化学方程式是
)。第1步的化学方程式是
您最近一年使用:0次
2023-01-16更新
|
275次组卷
|
5卷引用:山东省鄄城县第一中学2022-2023学年高三上学期期末考试化学试题
山东省鄄城县第一中学2022-2023学年高三上学期期末考试化学试题山东省菏泽市郓城县实验中学2022-2023学年高三上学期期末考试化学试题(已下线)湖北省七市(州)2023届高三3月联合统一调研测试化学试题变式题(工业流程题)河南省南阳市新野县第一高级中学校2023-2024学年高三上学期12月月考化学试题(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(工业流程题)



