解题方法
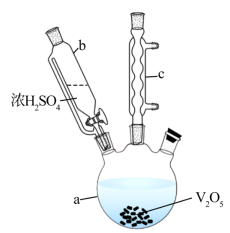
1 . 硫酸氧矾(VOSO4)对高血糖、高血症等具有一定的治疗作用。制备VOSO4的实验流程及实验装置如图(夹持及加热装置已省略)。
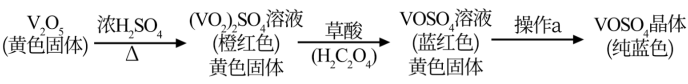
已知:草酸又名乙二酸,是一种二元有机弱酸,易溶于乙醇,可溶于水,不溶于苯,受热易分解,具有还原性。回答下列问题:
(1)仪器c的名称为___________ ,在a中反应生成(VO2)2SO4___________ (填“是”或“不是”)氧化还原反应。
(2)加入草酸前,为防止草酸因反应而减少,需对反应液采取的措施为___________ 、___________ 。
(3)反应液由橙红色变为蓝黑色的反应的化学方程式为___________ 。
(4)硫酸氧钒中钒含量的测定:
Ⅰ.制备VOSO4溶液:称取0. 51 g V2O5,置于上图装置中反应,V2O5全部转化为VOSO4。
Ⅱ.滴定预处理:
①将制得的VOSO4溶液配成250mL溶液;
②取25.00 mL溶液于锥形瓶中,滴加酸性高锰酸钾(可将VO2+转化为VO )溶液至反应完全;
)溶液至反应完全;
③滴加亚硝酸钠溶液反应掉过量的高锰酸钾溶液,加入2mL尿素溶液至溶液不再产生气泡。已知:尿素不直接与亚硝酸盐反应,但可将亚硝酸转化为氮气;亚硝酸可将VO 转化为VO2+。
转化为VO2+。
Ⅲ.滴定过程:加入10mL硫酸-磷酸混酸,调节pH=0,滴入指示剂,用0.05 mol·L−1硫酸亚铁铵标准溶液(将VO 转化为VO2+)滴定至终点。测量三次,消耗标准溶液平均体积为10.00mL。
转化为VO2+)滴定至终点。测量三次,消耗标准溶液平均体积为10.00mL。
步骤③中加入尿素的目的是___________ ;测得硫酸氧钒中钒的质量分数为___________ (保留三位有效数字)。实验过程中,下列操作会导致所测钒含量偏低的是___________ 。
A.预处理过程中加入尿素的量不足
B.盛装硫酸亚铁铵标准液的滴定管未润洗
C.滴定管读数时,开始时仰视刻度线,结束时平视刻度线
D.滴定前滴定管有气泡,滴定结束后发现滴定管内无气泡


已知:草酸又名乙二酸,是一种二元有机弱酸,易溶于乙醇,可溶于水,不溶于苯,受热易分解,具有还原性。回答下列问题:
(1)仪器c的名称为
(2)加入草酸前,为防止草酸因反应而减少,需对反应液采取的措施为
(3)反应液由橙红色变为蓝黑色的反应的化学方程式为
(4)硫酸氧钒中钒含量的测定:
Ⅰ.制备VOSO4溶液:称取0. 51 g V2O5,置于上图装置中反应,V2O5全部转化为VOSO4。
Ⅱ.滴定预处理:
①将制得的VOSO4溶液配成250mL溶液;
②取25.00 mL溶液于锥形瓶中,滴加酸性高锰酸钾(可将VO2+转化为VO
 )溶液至反应完全;
)溶液至反应完全;③滴加亚硝酸钠溶液反应掉过量的高锰酸钾溶液,加入2mL尿素溶液至溶液不再产生气泡。已知:尿素不直接与亚硝酸盐反应,但可将亚硝酸转化为氮气;亚硝酸可将VO
 转化为VO2+。
转化为VO2+。Ⅲ.滴定过程:加入10mL硫酸-磷酸混酸,调节pH=0,滴入指示剂,用0.05 mol·L−1硫酸亚铁铵标准溶液(将VO
 转化为VO2+)滴定至终点。测量三次,消耗标准溶液平均体积为10.00mL。
转化为VO2+)滴定至终点。测量三次,消耗标准溶液平均体积为10.00mL。步骤③中加入尿素的目的是
A.预处理过程中加入尿素的量不足
B.盛装硫酸亚铁铵标准液的滴定管未润洗
C.滴定管读数时,开始时仰视刻度线,结束时平视刻度线
D.滴定前滴定管有气泡,滴定结束后发现滴定管内无气泡
您最近一年使用:0次
2021-12-09更新
|
679次组卷
|
5卷引用:一轮巩固卷4-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(辽宁专用)
(已下线)一轮巩固卷4-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(辽宁专用)山东省威海市文登区2021-2022学年高三上学期期中考试化学试题(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)一轮巩固卷4-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(湖北专用)
解题方法
2 . 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
CH3CH=CH2+CO+H2 CH3CH2CH2CHO
CH3CH2CH2CHO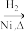 CH3CH2CH2CH2OH
CH3CH2CH2CH2OH
CO的制备原理:HCOOH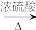 CO↑+H2O,并设计出原料气的制备装置(如下图所示)。
CO↑+H2O,并设计出原料气的制备装置(如下图所示)。
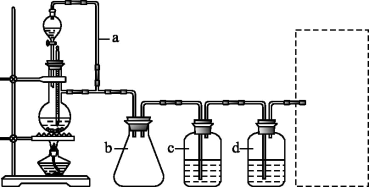
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式:_______ ,_______ 。
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是_______ ,_______ ;c和d中盛装的试剂分别是_______ ,_______ 。若用以上装置制备H2,气体发生装置中必需的玻璃仪器名称是_______ ;在虚线框内画出收集干燥H2的装置图_______ 。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这4种气体,混合气体通过试剂的顺序是_______ (填序号)。
①饱和Na2SO3溶液 ②KMnO4酸性溶液 ③澄清石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是_______ (填字母序号)。
a.低温、高压、催化剂 b.适当的温度、高压、催化剂 c.常温、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品。为纯化1-丁醇,该小组查阅文献得知:
①R—CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;
②沸点:乙醚34 ℃,1-丁醇118 ℃,并设计出如下提纯路线:
粗品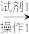 滤液
滤液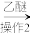
 有机层
有机层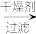 1-丁醇
1-丁醇
乙醚 纯品
纯品
试剂1为_______ ,操作1为_______ ,操作2为_______ ,操作3为_______ 。
CH3CH=CH2+CO+H2
 CH3CH2CH2CHO
CH3CH2CH2CHO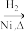 CH3CH2CH2CH2OH
CH3CH2CH2CH2OHCO的制备原理:HCOOH
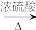 CO↑+H2O,并设计出原料气的制备装置(如下图所示)。
CO↑+H2O,并设计出原料气的制备装置(如下图所示)。
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式:
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这4种气体,混合气体通过试剂的顺序是
①饱和Na2SO3溶液 ②KMnO4酸性溶液 ③澄清石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是
a.低温、高压、催化剂 b.适当的温度、高压、催化剂 c.常温、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品。为纯化1-丁醇,该小组查阅文献得知:
①R—CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;
②沸点:乙醚34 ℃,1-丁醇118 ℃,并设计出如下提纯路线:
粗品
 滤液
滤液
 有机层
有机层 1-丁醇
1-丁醇乙醚
 纯品
纯品试剂1为
您最近一年使用:0次
3 . 某同学学习了化学反应速率后,联想到曾用H2O2制备氧气,于是设计了下面的实验方案并进行实验探究。
【查阅资料】过氧化氢(H2O2),其水溶液俗称双氧水,常温下是一种无色液体,性质比较稳定。在加热的条件下,它能分解生成氧气。研究表明,将新制的5﹪的H2O2溶液加热到65℃时就有氧气放出,加热到80℃时就有较多氧气产生。
(1)上述实验发生反应的化学方程式为_____ 。
(2)实验甲和实验乙的实验目的是_______ ;实验丙、实验丁和实验戊的实验目的是_____ 。
(3)实验过程中该同学对实验丙、丁、戊中产生的气体进行收集,并在2分钟内6个时间点对注射器内气体进行读数,记录数据如下表。(注:速率用v=△V/△t)
对实验戊,0~20 s的反应速率v1=_____ mL/s,100~120 s的反应速率v2=_____ mL/s。不考虑实验测量误差,二者速率存在差异的主要原因是_____ 。
实验编号 | 反 应 物 | 催 化 剂 |
甲 | 试管中加入3 mL 2﹪ H2O2溶液和3滴蒸馏水 | 无 |
乙 | 试管中加入3 mL 5﹪ H2O2溶液和3滴蒸馏水 | 无 |
丙 | 试管中加入3 mL 5﹪ H2O2溶液和3滴蒸馏水 | 1 mL 0.1 mol/L FeCl3溶液 |
丁 | 试管中加入3 mL 5﹪ H2O2溶液和3滴稀盐酸溶液 | 1 mL 0.1 mol/L FeCl3溶液 |
戊 | 试管中加入3 mL 5﹪ H2O2溶液和3滴NaOH溶液 | 1 mL 0.1 mol/L FeCl3溶液 |
(1)上述实验发生反应的化学方程式为
(2)实验甲和实验乙的实验目的是
(3)实验过程中该同学对实验丙、丁、戊中产生的气体进行收集,并在2分钟内6个时间点对注射器内气体进行读数,记录数据如下表。(注:速率用v=△V/△t)
时间/s | 20 | 40 | 60 | 80 | 100 | 120 | |
气体体积/mL | 实验丙 | 9.5 | 19.5 | 29.0 | 36.5 | 46.0 | 54.5 |
实验丁 | 8.0 | 16.0 | 23.5 | 31.5 | 39.0 | 46.5 | |
实验戊 | 15.5 | 30.0 | 44.5 | 58.5 | 71.5 | 83.0 | |
您最近一年使用:0次
4 . 随着经济全球化,我国已于2020年全面脱贫,家用汽车普及,有效处理汽车排放的尾气是需要进行研究的一项重要课题。利用催化技术可将尾气中的NO和CO转化成CO2和N2,为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究:
(1)资料查阅①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
(实验设计)课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。完成以下实验设计表格
(图象分析与结论)利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如图:
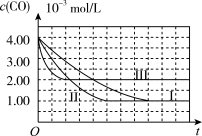
(2)计算第II组实验中,达平衡时NO的浓度为________ ;
(3)由曲线I、II可知,增大催化剂比表面积,汽车尾气转化速率____________________ (填“增大”、“减小”、“无影响”)。
(1)资料查阅①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
(实验设计)课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。完成以下实验设计表格
| 实验编号 | 实验目的 | T /℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积 m2/g |
| I | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| II | ① | 280 | 6.50×10-3 | 4.00×10-3 | 120 |
| III | 探究温度对尾气转化速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | ② |

(2)计算第II组实验中,达平衡时NO的浓度为
(3)由曲线I、II可知,增大催化剂比表面积,汽车尾气转化速率
您最近一年使用:0次
名校
解题方法
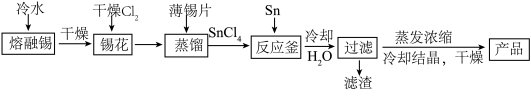
5 . 氯化亚锡用途广泛,在无机工业中用作还原剂,在口腔护理行业中,二水氯化亚锡多用于防龋齿脱敏类牙膏中,以预防龋齿的发生。某研究小组制取二水氯化亚锡工艺流程如下:
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡。
(1)四氯化锡暴露于空气中与空气中水分反应生成白烟,有强烈的刺激性气味,生成偏锡酸(H2SnO3),写出该反应的化学方程式____ ;
(2)将金属锡熔融,然后泼入冷水,激成锡花,其目的是____ ;
(3)在制备二水氯化亚锡时,温度对锡转化率的影响如图1所示,则该反应应控制的温度范围为____ ℃;

(4)反应原料中盐酸浓度对结晶率的影响如图2所示,则盐酸浓度应控制的范围为___ ,原因____ 。
(5)反应釜中发生反应的化学方程式为_____ ;
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应)
①将该试样溶于盐酸,发生反应为Sn+2HCl=SnCl2+H2↑;
②加入过量FeCl3溶液
③用已知浓度的K2Cr2O7滴定②中生成的Fe2+,则反应的离子方程式为____ ;
(7)取1.125g锡粉,经上述各步反应后,共用去0.1000mol/L K2Cr2O7溶液30.00mL,锡粉中锡的质量分数为____ 。

查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡。
(1)四氯化锡暴露于空气中与空气中水分反应生成白烟,有强烈的刺激性气味,生成偏锡酸(H2SnO3),写出该反应的化学方程式
(2)将金属锡熔融,然后泼入冷水,激成锡花,其目的是
(3)在制备二水氯化亚锡时,温度对锡转化率的影响如图1所示,则该反应应控制的温度范围为

(4)反应原料中盐酸浓度对结晶率的影响如图2所示,则盐酸浓度应控制的范围为
(5)反应釜中发生反应的化学方程式为
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应)
①将该试样溶于盐酸,发生反应为Sn+2HCl=SnCl2+H2↑;
②加入过量FeCl3溶液
③用已知浓度的K2Cr2O7滴定②中生成的Fe2+,则反应的离子方程式为
(7)取1.125g锡粉,经上述各步反应后,共用去0.1000mol/L K2Cr2O7溶液30.00mL,锡粉中锡的质量分数为
您最近一年使用:0次
2019-03-25更新
|
614次组卷
|
3卷引用:【市级联考】辽宁省沈阳市2019届高三下学期一模考试化学试题
名校
6 . 化学是一门以实验为基础的科学,化学实验是研究化学反应、分析物质成分的重要手段。
Ⅰ.某化学小组为了研究外界条件对化学反应速率的影响,进行了KI溶液在酸性条件下与氧气反应的实验,记录实验数据如表:
(1)实验试剂除了1mol/LKI溶液、0.1mol/L H2SO4溶液外,还需要的试剂是___________ ,实验现象为___________ 。
(2)上述实验操作中除了需要(1)的条件外,还必须控制不变的是___________ (填字母)。
A.温度 B.试剂的浓度 C.试剂的用量(体积) D.试剂添加的顺序
Ⅱ.为检测某食品中亚硫酸盐含量(通常以1 kg样品中含SO2的质量计),某研究小组设计了如下两种实验流程
(1)通入N2并煮沸的原因是___________
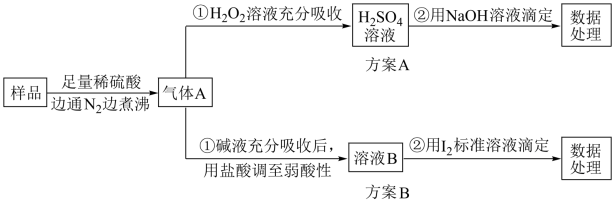
(2)A方案第②步用酚酞做指示剂进行滴定,滴定时边滴边摇动锥形瓶,眼睛应观察___________ 。滴定终点的现象是___________
(3)写出B方案滴定时的离子方程式:___________ 。
(4)按B方案若取样品20g配成100mL溶液,滴定消耗0.01000 mol·L-1 I2溶液的体积如表所示:
滴定中误差较大的是第___________ 次实验,造成这种误差的可能原因是___________ 。
A.滴定管在装液前未用标准溶液润洗2~3次
B.滴定前读数仰视溶液凹液面,达到滴定终点后俯视溶液凹液面最低点读数
C.达到滴定终点,锥形瓶内溶液变色后立即读数
D.滴定开始前滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
则1 kg样品中含SO2的质量是___________ g。
Ⅰ.某化学小组为了研究外界条件对化学反应速率的影响,进行了KI溶液在酸性条件下与氧气反应的实验,记录实验数据如表:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度(℃) | 30 | 40 | 50 | 60 | 70 |
| 显色时间(s) | 160 | 80 | 40 | 20 | 10 |
(2)上述实验操作中除了需要(1)的条件外,还必须控制不变的是
A.温度 B.试剂的浓度 C.试剂的用量(体积) D.试剂添加的顺序
Ⅱ.为检测某食品中亚硫酸盐含量(通常以1 kg样品中含SO2的质量计),某研究小组设计了如下两种实验流程
(1)通入N2并煮沸的原因是

(2)A方案第②步用酚酞做指示剂进行滴定,滴定时边滴边摇动锥形瓶,眼睛应观察
(3)写出B方案滴定时的离子方程式:
(4)按B方案若取样品20g配成100mL溶液,滴定消耗0.01000 mol·L-1 I2溶液的体积如表所示:
| 滴定次数 | 待测溶液体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 20.00 | 1.02 | 21.03 |
| 2 | 20.00 | 2.00 | 25.00 |
| 3 | 20.00 | 0.60 | 20.59 |
A.滴定管在装液前未用标准溶液润洗2~3次
B.滴定前读数仰视溶液凹液面,达到滴定终点后俯视溶液凹液面最低点读数
C.达到滴定终点,锥形瓶内溶液变色后立即读数
D.滴定开始前滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
则1 kg样品中含SO2的质量是
您最近一年使用:0次
2021-01-15更新
|
432次组卷
|
2卷引用:辽宁省实验中学、大连八中、大连二十四中、鞍山一中、东北育才学校五校协作体2020-2021学年高二上学期期末化学试题
14-15高二上·辽宁沈阳·期末
7 . 某酸性工业废水中含有 。光照下,草酸(
。光照下,草酸( )能将其中的
)能将其中的 今转化为
今转化为 。某课题组研究发现,少量铁明矾
。某课题组研究发现,少量铁明矾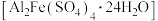 能对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
能对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25 下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度的草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度的草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
测得实验①和②溶液中的 浓度随时间变化关系如图所示。
浓度随时间变化关系如图所示。
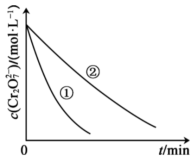
(2)实验①和②的结果表明___________ 对该反应的速率有影响。
(3)该课题组对铁明矾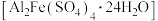 中起催化作用的成分提出如下假设(请你完成假设二和假设三):
中起催化作用的成分提出如下假设(请你完成假设二和假设三):
假设一: 起催化作用;
起催化作用;
假设二:___________ ;
假设三:___________ ;……
(4)请你设计实验验证上述假设一完成下表中内容[除了上述实验提供的试剂外,可供选择的药品有 、
、 、
、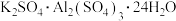 、
、 等。溶液中
等。溶液中 的浓度可用仪器测定]。
的浓度可用仪器测定]。
 。光照下,草酸(
。光照下,草酸( )能将其中的
)能将其中的 今转化为
今转化为 。某课题组研究发现,少量铁明矾
。某课题组研究发现,少量铁明矾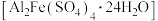 能对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
能对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:(1)在25
 下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度的草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度的草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 10 | 30 | |
| ② | 5 | 60 | 10 | |
| ③ | 60 | 20 |
测得实验①和②溶液中的
 浓度随时间变化关系如图所示。
浓度随时间变化关系如图所示。
(2)实验①和②的结果表明
(3)该课题组对铁明矾
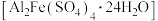 中起催化作用的成分提出如下假设(请你完成假设二和假设三):
中起催化作用的成分提出如下假设(请你完成假设二和假设三):假设一:
 起催化作用;
起催化作用;假设二:
假设三:
(4)请你设计实验验证上述假设一完成下表中内容[除了上述实验提供的试剂外,可供选择的药品有
 、
、 、
、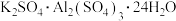 、
、 等。溶液中
等。溶液中 的浓度可用仪器测定]。
的浓度可用仪器测定]。| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 取 | 反应进行相同时间后:若溶液中的 浓度,则假设一成立;若溶液中的 浓度,则假设一成立;若溶液中的 浓度 浓度 |
您最近一年使用:0次
2021-03-09更新
|
136次组卷
|
4卷引用:2013-2014学年辽宁省沈阳市高二上教学质量监测化学试卷
(已下线)2013-2014学年辽宁省沈阳市高二上教学质量监测化学试卷(已下线)2014届辽宁省沈阳市高二上教学质量监测化学试卷 广西南宁市2020-2021学年高二上学期期末考试(原理)化学试题安徽省滁州九校2021-2022学年高二上学期第四次调研考试化学试题
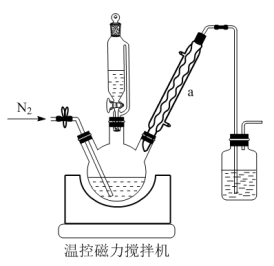
8 . 氯化亚锡(SnCl2)用途广泛,在无机工业中用作还原剂(Sn2+易被氧化为Sn4+), 在钾华蓝生产中能防止硫酸亚铁氧化成高价铁。从锡渣废料(主要成分为Sn和SnO)中制备氯化亚锡晶体( SnCl2·2H2O)部分装置如图,过程如下:
②加热到一定温度, 反应约30分钟
③反应完成后冷却至室温,水洗,抽滤
④用盐酸淋洗,向滤液中加入少许单质锡,调pH<2,在CO2气流下进行蒸发浓缩,冷却结晶得氯化亚锡晶体
锡渣在酸的条件下转化率与温度的关系
pH对Sn2+存在形式的影响
回答下列问题:
(1)仪器a的名称是___________ 。
(2)使用恒压滴液漏斗的原因是___________ 。
(3)制备过程中通入N2的目的是___________ 。
(4)②加热到一定温度,最适宜的温度范围为___________ 。
(5)④向滤液中加入少许单质锡的原因___________ 。
(6)④调pH<2的原因___________ 。
(7)产品含量的测定:
准确称取产品2.26克,在酸性条件下,用硫酸铁铵氧化Sn2+,在硫酸-磷酸混酸条件下,以二苯胺磺酸钠作指示剂,用0.100mol/L标准酸性重铬酸钾溶液滴定Fe2+,消耗标准酸性重铬酸钾溶液32.30mL。产品中氯化亚锡(SnCl2·2H2O)的质量分数为___________ 。
②加热到一定温度, 反应约30分钟
③反应完成后冷却至室温,水洗,抽滤
④用盐酸淋洗,向滤液中加入少许单质锡,调pH<2,在CO2气流下进行蒸发浓缩,冷却结晶得氯化亚锡晶体
锡渣在酸的条件下转化率与温度的关系
| 电镀锡渣质量/g | 浓盐酸用量/mL | 反应温度/°C | 转化率/% |
| 10 | 8 | 室温 | - |
| 10 | 8 | 50~60 | 10~15 |
| 10 | 8 | 100~ 120 | 30~40 |
| 10 | 8 | 200~250 | 70 |
| pH | Sn2+的形式 |
| <2 | SnCl2溶液 |
| 2~13 | Sn(OH)2沉淀 |
| >13 | H2SnO2溶液 |
(1)仪器a的名称是
(2)使用恒压滴液漏斗的原因是
(3)制备过程中通入N2的目的是
(4)②加热到一定温度,最适宜的温度范围为
(5)④向滤液中加入少许单质锡的原因
(6)④调pH<2的原因
(7)产品含量的测定:
准确称取产品2.26克,在酸性条件下,用硫酸铁铵氧化Sn2+,在硫酸-磷酸混酸条件下,以二苯胺磺酸钠作指示剂,用0.100mol/L标准酸性重铬酸钾溶液滴定Fe2+,消耗标准酸性重铬酸钾溶液32.30mL。产品中氯化亚锡(SnCl2·2H2O)的质量分数为
您最近一年使用:0次
2022-01-13更新
|
407次组卷
|
2卷引用:辽宁省沈阳市2021-2022学年高三上学期教学质量检测(一)化学试卷
名校
解题方法
9 . 黄铁矿(主要成分为FeS2)的有效利用对环境具有重要意义。
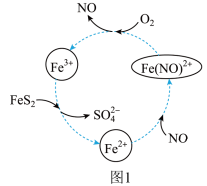
(1)在酸性条件下催化氧化黄铁矿的物质转化关系如图1所示。
①图1转化过程的总反应中,FeS2做__ (填“催化剂”“氧化剂”或“还原剂”,下同)。该转化过程中NO的作用是__ 。
②写出图1中Fe3+与FeS2反应的离子方程式:__ 。
(2)Fe2+被氧化为Fe3+的过程中,控制起始时Fe2+的浓度、溶液体积和通入O2的速率不变,改变其他条件时,Fe2+被氧化的转化率随时间的变化如图2所示。
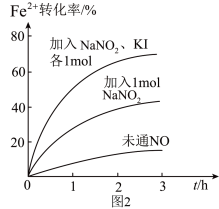
①加入NaNO2发生反应:2H++3NO =NO
=NO +2NO↑+H2O。该反应中若有6molNaNO2完全反应,转移电子的物质的量为
+2NO↑+H2O。该反应中若有6molNaNO2完全反应,转移电子的物质的量为__ mol。
②加入NaNO2、KI发生反应:4H++2NO +2I-=2NO↑+I2+2H2O。解释图2中该条件下能进一步提高单位时间内Fe2+转化率的原因:
+2I-=2NO↑+I2+2H2O。解释图2中该条件下能进一步提高单位时间内Fe2+转化率的原因:__ 。

(1)在酸性条件下催化氧化黄铁矿的物质转化关系如图1所示。
①图1转化过程的总反应中,FeS2做
②写出图1中Fe3+与FeS2反应的离子方程式:
(2)Fe2+被氧化为Fe3+的过程中,控制起始时Fe2+的浓度、溶液体积和通入O2的速率不变,改变其他条件时,Fe2+被氧化的转化率随时间的变化如图2所示。

①加入NaNO2发生反应:2H++3NO
 =NO
=NO +2NO↑+H2O。该反应中若有6molNaNO2完全反应,转移电子的物质的量为
+2NO↑+H2O。该反应中若有6molNaNO2完全反应,转移电子的物质的量为②加入NaNO2、KI发生反应:4H++2NO
 +2I-=2NO↑+I2+2H2O。解释图2中该条件下能进一步提高单位时间内Fe2+转化率的原因:
+2I-=2NO↑+I2+2H2O。解释图2中该条件下能进一步提高单位时间内Fe2+转化率的原因:
您最近一年使用:0次
2020-08-16更新
|
327次组卷
|
6卷引用:辽宁省沈阳市辽中区第二高级中学2021-2022学年高二下学期摸底考试化学试题
辽宁省沈阳市辽中区第二高级中学2021-2022学年高二下学期摸底考试化学试题河北省承德市各县第一中学2018届高三上学期期末考试化学试题(已下线)第08讲 氧化还原反应的基本概念和规律(精练)——2021年高考化学一轮复习讲练测(已下线)第03讲 氧化还原反应(练)-2023年高考化学一轮复习讲练测(新教材新高考)宁夏平罗中学2022-2023学年高三上学期第一次月考化学试题(已下线)第4讲 氧化还原反应的基本概念与规律



