名校
解题方法
1 . 某研究性学习小组为合成1丁醇,查阅资料得知一条合成路线:CH3CH===CH2+CO+H2→CH3CH2CH2CHO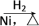 CH3CH2CH2CH2OH,CO的制备原理:HCOOH
CH3CH2CH2CH2OH,CO的制备原理:HCOOH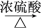 CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2丙醇,从中选择合适的试剂制备氢气、丙烯。写出化学方程式:______________________________________________ 。
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是________ 、________ ;c和d中盛装的试剂分别是________ 、________ 。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是________ (填序号)。
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是________ 。
a.低温、高压、催化剂 b.适当的温度、高压、催化剂
c.常温、常压、催化剂 d.适当的温度、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1丁醇粗品,为纯化1丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和)―→RCH(OH)SO3Na↓;②沸点:乙醚 34 ℃,1丁醇 118 ℃,并设计出如下提纯路线:
粗品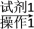 滤液
滤液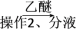 有机层
有机层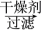 1丁醇、乙醚
1丁醇、乙醚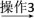 纯品
纯品
试剂1为________ ,操作1为________ ,操作2为________ ,操作3为________ 。
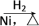 CH3CH2CH2CH2OH,CO的制备原理:HCOOH
CH3CH2CH2CH2OH,CO的制备原理:HCOOH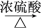 CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。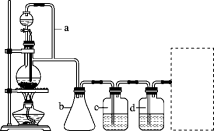
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2丙醇,从中选择合适的试剂制备氢气、丙烯。写出化学方程式:
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是
a.低温、高压、催化剂 b.适当的温度、高压、催化剂
c.常温、常压、催化剂 d.适当的温度、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1丁醇粗品,为纯化1丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和)―→RCH(OH)SO3Na↓;②沸点:乙醚 34 ℃,1丁醇 118 ℃,并设计出如下提纯路线:
粗品
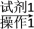 滤液
滤液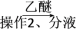 有机层
有机层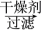 1丁醇、乙醚
1丁醇、乙醚 纯品
纯品试剂1为
您最近一年使用:0次
2016-12-09更新
|
296次组卷
|
3卷引用:2016届河北省邯郸一中高三下学期二模理综化学试卷
名校
解题方法
2 . 碳达峰是指我国承诺2030年前,二氧化碳的排放不再增长。因此,诸多科学家都在大力研合理利用 和CO以减少碳的排放。
和CO以减少碳的排放。
(1) 可通过以下4种方式转化成有机物,从而有效实现碳循环。
可通过以下4种方式转化成有机物,从而有效实现碳循环。
a.
b.
c.
已知:
以上反应中,最环保节能的是_______ ,原子利用率最高的是_______ 。(填编号)
(2)我国科学家设计出一条仅11步的工业合成路线,实现了 到淀粉的合成。其第一步是把
到淀粉的合成。其第一步是把 还原为甲醇(CH3OH),该方法的化学方程式是:
还原为甲醇(CH3OH),该方法的化学方程式是: 。
。
回答下列问题:
①能说明该反应已达平衡状态的是_______ (填字母)。
A.单位时间内生成 的同时消耗了
的同时消耗了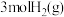
B.在恒温恒容的容器中,混合气体的平均摩尔质量保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,混合气体的密度不再变化
②该反应正逆反应的活化能大小为: (正)
(正)_______  (逆),且该反应在
(逆),且该反应在_______ 自发进行(填“高温”、“低温”“任何温度”或“任何温度都不”)
(3)利用CO高温时与磷石膏(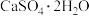 )反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
)反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
①在700℃时,主要的还原产物是一种硫的最低价盐,该物质为_______ 。
②在1150℃时,向盛有足量 的真空恒容密闭容器中充入一定量CO,反应体系起始压强为
的真空恒容密闭容器中充入一定量CO,反应体系起始压强为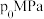 ,主要发生反应:
,主要发生反应: 。该反应达到平衡时,
。该反应达到平衡时,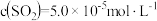 ,CO的转化率为50%,则初始时
,CO的转化率为50%,则初始时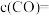
_______ mol/L,该反应的压强平衡常数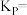
_______ MPa(忽略副反应;气体分压=总压×气体物质的量分数)。
(4)工业上也可用炭粉还原磷石膏,该反应的产物与C/S值(炭粉与 的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、
的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、 和
和 ;当C/S值大于0.7时,反应所得气体中
;当C/S值大于0.7时,反应所得气体中 的体积分数下降,可能的原因是
的体积分数下降,可能的原因是_______ 。

 和CO以减少碳的排放。
和CO以减少碳的排放。(1)
 可通过以下4种方式转化成有机物,从而有效实现碳循环。
可通过以下4种方式转化成有机物,从而有效实现碳循环。a.

b.

c.

已知:

以上反应中,最环保节能的是
(2)我国科学家设计出一条仅11步的工业合成路线,实现了
 到淀粉的合成。其第一步是把
到淀粉的合成。其第一步是把 还原为甲醇(CH3OH),该方法的化学方程式是:
还原为甲醇(CH3OH),该方法的化学方程式是: 。
。回答下列问题:
①能说明该反应已达平衡状态的是
A.单位时间内生成
 的同时消耗了
的同时消耗了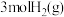
B.在恒温恒容的容器中,混合气体的平均摩尔质量保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,混合气体的密度不再变化
②该反应正逆反应的活化能大小为:
 (正)
(正) (逆),且该反应在
(逆),且该反应在(3)利用CO高温时与磷石膏(
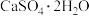 )反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
)反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。①在700℃时,主要的还原产物是一种硫的最低价盐,该物质为
②在1150℃时,向盛有足量
 的真空恒容密闭容器中充入一定量CO,反应体系起始压强为
的真空恒容密闭容器中充入一定量CO,反应体系起始压强为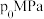 ,主要发生反应:
,主要发生反应: 。该反应达到平衡时,
。该反应达到平衡时,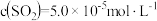 ,CO的转化率为50%,则初始时
,CO的转化率为50%,则初始时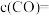
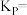
(4)工业上也可用炭粉还原磷石膏,该反应的产物与C/S值(炭粉与
 的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、
的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、 和
和 ;当C/S值大于0.7时,反应所得气体中
;当C/S值大于0.7时,反应所得气体中 的体积分数下降,可能的原因是
的体积分数下降,可能的原因是
您最近一年使用:0次
名校
解题方法
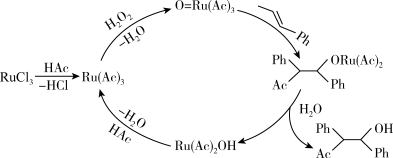
3 . 钌( )为稀有元素,广泛应用于电子、航空航天、化工等领域。某含钌的废渣主要成分为
)为稀有元素,广泛应用于电子、航空航天、化工等领域。某含钌的废渣主要成分为 、
、 、
、 、
、 ,一种从中回收
,一种从中回收 制
制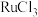 的工艺流程如下:
的工艺流程如下:
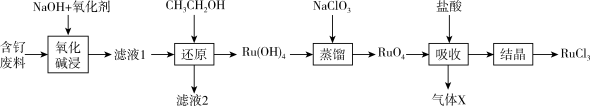
(1)“氧化碱浸”时,两种氧化剂在不同温度对钌浸出率和渣率分别如图1、图2所示,则适宜选择的氧化剂为_______ ;最佳反应温度为_______ 。
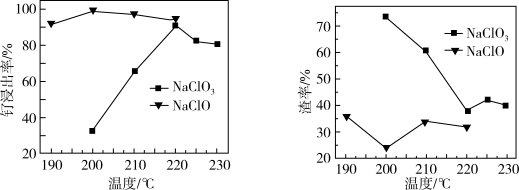
图1 图2
(2)滤液1中溶质主要成分为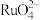 、
、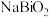 、
、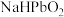 和
和_______ ;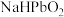 中
中 的化合价为
的化合价为_______ ; 转化为
转化为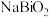 的化学方程式为
的化学方程式为_______ 。
(3)“还原”过程生成 和乙醛,且
和乙醛,且 明显增大,则该过程的离子反应方程式为
明显增大,则该过程的离子反应方程式为_______ 。
(4)“吸收”过程产生的气体X经Y溶液吸收后,经进一步处理可以循环利用,则X和Y的化学式分别为_______ 、_______ 。
(5)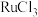 在有机合成中有重要应用,其参与某有机物合成的路线如下图3所示(
在有机合成中有重要应用,其参与某有机物合成的路线如下图3所示( 代表乙酸,
代表乙酸, 代表苯基),则下列说法正确的是_______。
代表苯基),则下列说法正确的是_______。
 )为稀有元素,广泛应用于电子、航空航天、化工等领域。某含钌的废渣主要成分为
)为稀有元素,广泛应用于电子、航空航天、化工等领域。某含钌的废渣主要成分为 、
、 、
、 、
、 ,一种从中回收
,一种从中回收 制
制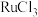 的工艺流程如下:
的工艺流程如下:
(1)“氧化碱浸”时,两种氧化剂在不同温度对钌浸出率和渣率分别如图1、图2所示,则适宜选择的氧化剂为

图1 图2
(2)滤液1中溶质主要成分为
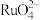 、
、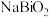 、
、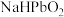 和
和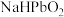 中
中 的化合价为
的化合价为 转化为
转化为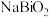 的化学方程式为
的化学方程式为(3)“还原”过程生成
 和乙醛,且
和乙醛,且 明显增大,则该过程的离子反应方程式为
明显增大,则该过程的离子反应方程式为(4)“吸收”过程产生的气体X经Y溶液吸收后,经进一步处理可以循环利用,则X和Y的化学式分别为
(5)
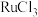 在有机合成中有重要应用,其参与某有机物合成的路线如下图3所示(
在有机合成中有重要应用,其参与某有机物合成的路线如下图3所示(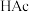 代表乙酸,
代表乙酸, 代表苯基),则下列说法正确的是_______。
代表苯基),则下列说法正确的是_______。
A.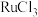 为催化剂 为催化剂 | B. 作还原剂 作还原剂 | C.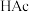 为中间产物 为中间产物 | D.主要生成物为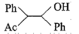 |
您最近一年使用:0次
2022-01-22更新
|
1026次组卷
|
3卷引用:广东省茂名市2022届高三第一次综合测试(一模)化学试题
广东省茂名市2022届高三第一次综合测试(一模)化学试题(已下线)押广东卷化学第18题 化学工艺流程题-备战2022年高考化学临考题号押题(广东卷)福建省厦门第一中学2021-2022学年高一下学期5月月考化学试题
名校
解题方法
4 . 生产工艺的实现,涉及能源消耗、环境保护、综合经济效益等等。
Ⅰ.(1)下列单元操作中采用了热交换工艺设备,以利用化学反应中放出的热量,达到节能减排效果的有_______ (填序号)。
A. 电解食盐水制烧碱 B. 合成氨中的催化合成
C. 硫酸生产中的催化氧化 D. 煅烧石灰石制取生石灰
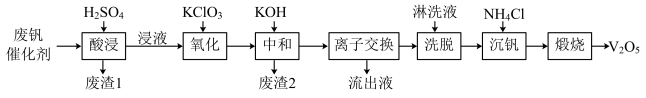
Ⅱ.以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
以下是一种废钒催化剂回收工艺路线:
(2)“酸浸”时V2O4转化为VO2+,反应的离子方程式为_________ ,同时V2O5转化为VO2+。“废渣1”的主要成分是________ 。
(3)“氧化”中使VO2+变为VO2+,则“氧化”环节中氧化剂与还原剂的物质的量之比为_____ 。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+V4O124-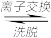 R4V4O12+4OH−(以ROH为强碱性阴离子交换树脂)。为了提高化洗脱效率,淋洗液应该呈
R4V4O12+4OH−(以ROH为强碱性阴离子交换树脂)。为了提高化洗脱效率,淋洗液应该呈_______ 性(填“酸”“碱”“中”)。
(5)检验“流出液”中含量最多的阳离子,其实验操作步骤是____ 。__ kg(保留小数点后一位)。
Ⅰ.(1)下列单元操作中采用了热交换工艺设备,以利用化学反应中放出的热量,达到节能减排效果的有
A. 电解食盐水制烧碱 B. 合成氨中的催化合成
C. 硫酸生产中的催化氧化 D. 煅烧石灰石制取生石灰
Ⅱ.以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
| 物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
| 质量分数/% | 2.20~2.90 | 2.8~3.32 | 22~28 | 60~65 | 1~2 | <1 |
(2)“酸浸”时V2O4转化为VO2+,反应的离子方程式为
(3)“氧化”中使VO2+变为VO2+,则“氧化”环节中氧化剂与还原剂的物质的量之比为
(4)“离子交换”和“洗脱”可简单表示为:4ROH+V4O124-
 R4V4O12+4OH−(以ROH为强碱性阴离子交换树脂)。为了提高化洗脱效率,淋洗液应该呈
R4V4O12+4OH−(以ROH为强碱性阴离子交换树脂)。为了提高化洗脱效率,淋洗液应该呈(5)检验“流出液”中含量最多的阳离子,其实验操作步骤是
(6)“煅烧”中发生反应的化学方程式2NH4VO3 V2O5+H2O+2NH3↑,写出“沉钒”过程的离子方程式
V2O5+H2O+2NH3↑,写出“沉钒”过程的离子方程式
您最近一年使用:0次
名校
解题方法
5 . 20世纪初问世的“哈伯一博施”人工固氮法,是化工生产实现高温、高压、催化反应的第一个里程碑,也给世界农业发展带来了福音。
(1)氢气为上述方法的原料之一,写出以天然气、水蒸气为原料,在高温下制备氢气的化学方程式______ 。
(2)上述合成氨的方法有下列流程:
①原料气制备;②氨的合成;③原料气净化和压缩;④氨的分离。其先后顺序为______。
(3)合成氨生产中,下列说法正确的是______。
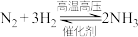
(1)氢气为上述方法的原料之一,写出以天然气、水蒸气为原料,在高温下制备氢气的化学方程式
(2)上述合成氨的方法有下列流程:
①原料气制备;②氨的合成;③原料气净化和压缩;④氨的分离。其先后顺序为______。
| A.①②③④ | B.①③②④ | C.④③②① | D.②③④① |
| A.使用催化剂,提高原料的利用率 | B.采用高温、高压工艺均可提高氨的产率 |
| C.产物用水吸收以分离出反应体系 | D.氢气与氮气的投料比值为2.8~2.9 |
您最近一年使用:0次
6 . 环戊二烯是一种重要的有机合成原料,用其制备环戊烯涉及的反应如下:
(1)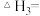
______ (用含“ ”和“
”和“ ”的式子表示),该反应在
”的式子表示),该反应在______ (填“高温”或“低温”)条件下能自发进行。
(2)下列操作中,能提高环戊二烯平衡转化率的是______ (填标号)。
A.增加环戊二烯的用量 B.恒温恒压下通入惰性气体 C.移除环戊烯
(3)保持其他条件不变,在相同时间内,环戊二烯转化率及环戊烯、环戊烷的选择性与温度的关系如下图所示:______ (填标号)。
A.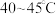 B.
B.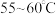 C.
C.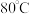 左右
左右
②随着温度的升高,环戊二烯转化率升高而环戊烯选择性降低,其原因是______ 。
(4)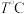 ,向恒容密闭容器中加入
,向恒容密闭容器中加入 环戊二烯
环戊二烯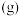 和
和
 ,反应达到平衡时,环戊二烯的转化率为
,反应达到平衡时,环戊二烯的转化率为 ,环戊烷物质的量为
,环戊烷物质的量为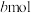 ,则用气体物质的量分数
,则用气体物质的量分数 表示的主反应的平衡常数
表示的主反应的平衡常数
______ (用含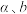 的计算式表示)。
的计算式表示)。
(5)用环戊二烯制备的二茂铁 可用作火箭燃料添加剂、汽油抗爆剂、橡胶熟化剂、紫外线吸收剂等。二茂铁的晶胞结构如图所示(未画出微粒),密度为
可用作火箭燃料添加剂、汽油抗爆剂、橡胶熟化剂、紫外线吸收剂等。二茂铁的晶胞结构如图所示(未画出微粒),密度为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则一个晶胞中含
,则一个晶胞中含 的数目为
的数目为______ 。
主反应: ;
;
副反应1: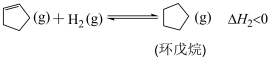 。
。
副反应2:
(1)
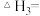
 ”和“
”和“ ”的式子表示),该反应在
”的式子表示),该反应在(2)下列操作中,能提高环戊二烯平衡转化率的是
A.增加环戊二烯的用量 B.恒温恒压下通入惰性气体 C.移除环戊烯
(3)保持其他条件不变,在相同时间内,环戊二烯转化率及环戊烯、环戊烷的选择性与温度的关系如下图所示:
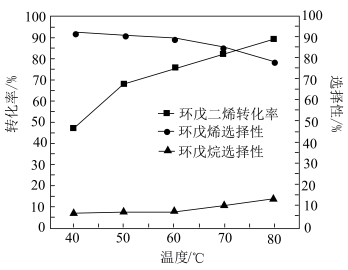
A.
 B.
B.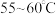 C.
C.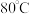 左右
左右②随着温度的升高,环戊二烯转化率升高而环戊烯选择性降低,其原因是
(4)
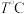 ,向恒容密闭容器中加入
,向恒容密闭容器中加入 环戊二烯
环戊二烯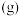 和
和
 ,反应达到平衡时,环戊二烯的转化率为
,反应达到平衡时,环戊二烯的转化率为 ,环戊烷物质的量为
,环戊烷物质的量为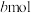 ,则用气体物质的量分数
,则用气体物质的量分数 表示的主反应的平衡常数
表示的主反应的平衡常数
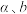 的计算式表示)。
的计算式表示)。(5)用环戊二烯制备的二茂铁
 可用作火箭燃料添加剂、汽油抗爆剂、橡胶熟化剂、紫外线吸收剂等。二茂铁的晶胞结构如图所示(未画出微粒),密度为
可用作火箭燃料添加剂、汽油抗爆剂、橡胶熟化剂、紫外线吸收剂等。二茂铁的晶胞结构如图所示(未画出微粒),密度为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则一个晶胞中含
,则一个晶胞中含 的数目为
的数目为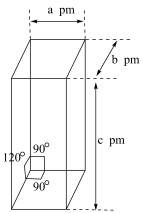
您最近一年使用:0次
名校
解题方法
7 . 下图为工业合成氨流程图,该反应速率方程为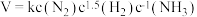 ,原料气(
,原料气(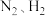 及少量
及少量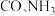 的混合气体)在进入合成塔前可经过铜氨液净化处理,其反应为:
的混合气体)在进入合成塔前可经过铜氨液净化处理,其反应为: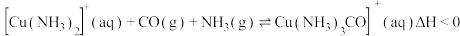 ,有关说法错误的是
,有关说法错误的是
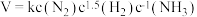 ,原料气(
,原料气(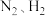 及少量
及少量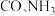 的混合气体)在进入合成塔前可经过铜氨液净化处理,其反应为:
的混合气体)在进入合成塔前可经过铜氨液净化处理,其反应为: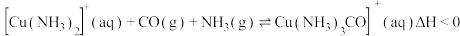 ,有关说法错误的是
,有关说法错误的是
| A.步骤①中“净化”可以防止催化剂中毒 |
| B.步骤②中“加压”既可以提高合成氨原料的转化率,又可以加快反应速率 |
| C.为保证足够高的反应速率,反应达到一定转化率时需及时将氨从体系中分离 |
D.“净化”时适当升高温度,可增大反应速率和 的平衡转化率 的平衡转化率 |
您最近一年使用:0次
名校
8 . 中国科学家首次实现了二氧化碳到淀粉的从头合成,CO2的捕集、利用与封存成为科学家研究的重要课题。
以CO2、C2H6为原料合成C2H4涉及的主要反应如下:
I.CO2(g)+C2H6(g) C2H4(g)+H2O(g)+CO(g) ΔH=+177kJ·mol-1 (主反应)
C2H4(g)+H2O(g)+CO(g) ΔH=+177kJ·mol-1 (主反应)
II.C2H6(g) CH4(g)+H2(g)+C(s) ΔH=+9kJ·mol-1 (副反应)
CH4(g)+H2(g)+C(s) ΔH=+9kJ·mol-1 (副反应)
(1)反应I的反应历程可分为如下两步:
i. C2H6(g) C2H4(g)+H2(g) ΔH1 (反应速率较快)
C2H4(g)+H2(g) ΔH1 (反应速率较快)
ii. H2(g)+CO2(g) H2O(g)+CO(g) ΔH2=+44kJ·mol-1 (反应速率较慢)
H2O(g)+CO(g) ΔH2=+44kJ·mol-1 (反应速率较慢)
①∆H1=_______
②相比于提高c(C2H6),提高c(CO2)对反应I速率影响更大,原因是_______ 。
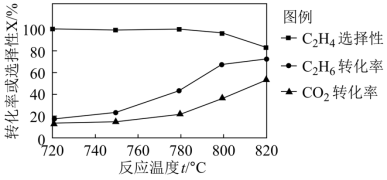
(2)向恒压密闭容器中充入CO2和C2H6合成C2H4,发生主反应,温度对催化剂K-Fe-Mn/Si-2性能的影响如图所示,工业生产综合各方面的因素,反应选择800℃的原因是_______ 。 C2H4(g)+2H2(g) ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
C2H4(g)+2H2(g) ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示: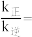
____ (用含有x的代数式表示);当温度升高时,k正增大m倍,k逆增大n倍,则m_____ n(填“>”、“<”或“=”)。
以CO2、C2H6为原料合成C2H4涉及的主要反应如下:
I.CO2(g)+C2H6(g)
 C2H4(g)+H2O(g)+CO(g) ΔH=+177kJ·mol-1 (主反应)
C2H4(g)+H2O(g)+CO(g) ΔH=+177kJ·mol-1 (主反应)II.C2H6(g)
 CH4(g)+H2(g)+C(s) ΔH=+9kJ·mol-1 (副反应)
CH4(g)+H2(g)+C(s) ΔH=+9kJ·mol-1 (副反应)(1)反应I的反应历程可分为如下两步:
i. C2H6(g)
 C2H4(g)+H2(g) ΔH1 (反应速率较快)
C2H4(g)+H2(g) ΔH1 (反应速率较快)ii. H2(g)+CO2(g)
 H2O(g)+CO(g) ΔH2=+44kJ·mol-1 (反应速率较慢)
H2O(g)+CO(g) ΔH2=+44kJ·mol-1 (反应速率较慢)①∆H1=
②相比于提高c(C2H6),提高c(CO2)对反应I速率影响更大,原因是
(2)向恒压密闭容器中充入CO2和C2H6合成C2H4,发生主反应,温度对催化剂K-Fe-Mn/Si-2性能的影响如图所示,工业生产综合各方面的因素,反应选择800℃的原因是
 C2H4(g)+2H2(g) ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
C2H4(g)+2H2(g) ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示: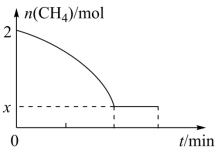
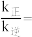
您最近一年使用:0次
解题方法
9 . 氨在能源、化肥生产等领域有着非常重要的用途。
(1)与H2﹣O2燃料电池相比,氨易液化,运输和储存方便,安全性能更高。新型NH3﹣O2燃料电池原理如图1所示。___________ (填“正极”或“负极”),电极2的反应式为 ___________ 。
②氨气也可以在纯氧中燃烧,此时化学能转化为热能。
已知:2H2(g)+O2(g)=2H2O(g)ΔH1
N2(g)+3H2(g)⇌2NH3(g)ΔH2
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)ΔH3
ΔH1、ΔH2、ΔH3之间的关系式为:ΔH3=___________ 。
(2)氨的合成是当前的研究热点,目前最主要的方法是Haber﹣Bosch法:通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
①该反应放热,但仍选择较高温度。其原因是___________ 。
②列举一条既能提高速率又能提高原料转化率的措施___________ 。
(3)常温常压下电解法合成氨的原理如图2所示。___________ 。
②阴极生成氨的电极反应式为___________ 。
③经检测在阴极表面发生了副反应,导致氨的产量降低。写出该副反应的电极反应式___________ 。
(1)与H2﹣O2燃料电池相比,氨易液化,运输和储存方便,安全性能更高。新型NH3﹣O2燃料电池原理如图1所示。
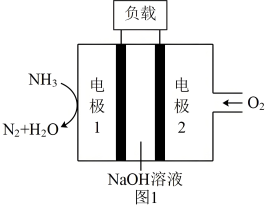
②氨气也可以在纯氧中燃烧,此时化学能转化为热能。
已知:2H2(g)+O2(g)=2H2O(g)ΔH1
N2(g)+3H2(g)⇌2NH3(g)ΔH2
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)ΔH3
ΔH1、ΔH2、ΔH3之间的关系式为:ΔH3=
(2)氨的合成是当前的研究热点,目前最主要的方法是Haber﹣Bosch法:通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
①该反应放热,但仍选择较高温度。其原因是
②列举一条既能提高速率又能提高原料转化率的措施
(3)常温常压下电解法合成氨的原理如图2所示。
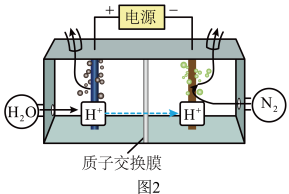
②阴极生成氨的电极反应式为
③经检测在阴极表面发生了副反应,导致氨的产量降低。写出该副反应的电极反应式
您最近一年使用:0次
名校
解题方法
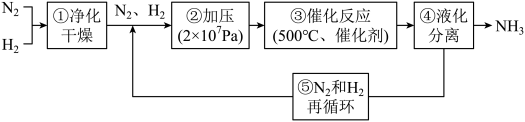
10 . 工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖。工业合成氨生产示意图如图所示。
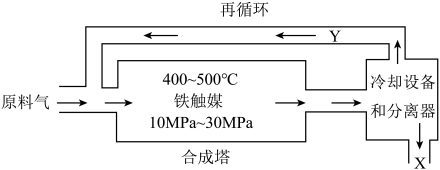
(1)下列有关合成氨工业的说法正确的是___________
(2)循环利用的Y是氮气和氢气,目的是___________ 。
(3)在合成氨工业中,要使氨的产率增大,同时又能提高反应速率,可采取的措施有___________ (填编号)。
①使用催化剂 ②恒温恒容,增大原料气 和
和 充入量 ③及时分离产生的
充入量 ③及时分离产生的
④升高温度 ⑤恒温恒容,充入惰性气体 使压强增大
使压强增大
(4)氮的固定和氮的循环是几百年来科学家一直研究的课题。下表列举了不同温度下大气固氮和工业固氮的部分 值。
值。
分析数据可知:
①在 下模拟工业固氮,某时刻
下模拟工业固氮,某时刻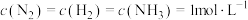 ,此时v正
,此时v正___________ v逆(填“>”“<”或“=”)。
②人类不适合大规模模拟大气固氮的原因是___________ 。
(5)哈伯1908年发表的文献中写到,在高温下,铁和铂都能作为使气态氨分解成为氢气、氮气的催化剂,下面是他做过的实验中的两组(条件都为901℃和3039.75 kPa)。
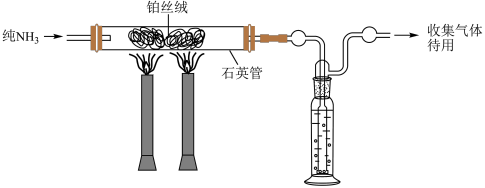
①使纯氨气通过白炽的铂丝,剩余的氨用浓硫酸洗涤除去。然后使气态混合物在相同条件下通过铁催化剂,出来的气体再缓缓通过20mL盐酸除去氨气。用气量计测得标准状况下剩余干燥气体的体积为2.02L。盐酸溶液用KOH溶液滴定,最终计算得到通入盐酸前氨气为1.86×10-4mol。
计算回答:在901℃下,N2 (g)+ 3H2 (g)
(g) 2NH3(g)的Kp=
2NH3(g)的Kp=___________ kPa-2。(保留一位有效数字)
②使纯氨气直接通过同一铁催化剂,出来的气体同样缓缓通入20mL盐酸,用气量计测得标准状况下剩余干燥气体的体积为1.82L。同理可以滴定后计算出通入盐酸前氨气的量,进而计算出Kp。在操作、计算误差合理的范围内,①、②得到的Kp基本相等。这对你有何启发?___________ 。

(1)下列有关合成氨工业的说法正确的是___________
| A.工业合成氨的反应是熵减小的放热反应,在低温时可自发进行 |
| B.合成氨反应中,反应物的总键能小于产物的总键能 |
C.合成氨厂一般采用的压强为 ,因为该压强下铁触媒的活性最高 ,因为该压强下铁触媒的活性最高 |
D. 的量越多, 的量越多, 的转化率越大,因此,充入的 的转化率越大,因此,充入的 越多越有利于 越多越有利于 的合成 的合成 |
(2)循环利用的Y是氮气和氢气,目的是
(3)在合成氨工业中,要使氨的产率增大,同时又能提高反应速率,可采取的措施有
①使用催化剂 ②恒温恒容,增大原料气
 和
和 充入量 ③及时分离产生的
充入量 ③及时分离产生的
④升高温度 ⑤恒温恒容,充入惰性气体
 使压强增大
使压强增大(4)氮的固定和氮的循环是几百年来科学家一直研究的课题。下表列举了不同温度下大气固氮和工业固氮的部分
 值。
值。| 反应 | 大气固氮 | 工业固氮 | |||
温度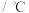 | 27 | 2000 | 25 | 400 | 450 |
 |  | 0.1 | 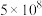 | 0.507 | 0.152 |
①在
 下模拟工业固氮,某时刻
下模拟工业固氮,某时刻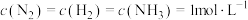 ,此时v正
,此时v正②人类不适合大规模模拟大气固氮的原因是
(5)哈伯1908年发表的文献中写到,在高温下,铁和铂都能作为使气态氨分解成为氢气、氮气的催化剂,下面是他做过的实验中的两组(条件都为901℃和3039.75 kPa)。

①使纯氨气通过白炽的铂丝,剩余的氨用浓硫酸洗涤除去。然后使气态混合物在相同条件下通过铁催化剂,出来的气体再缓缓通过20mL盐酸除去氨气。用气量计测得标准状况下剩余干燥气体的体积为2.02L。盐酸溶液用KOH溶液滴定,最终计算得到通入盐酸前氨气为1.86×10-4mol。
计算回答:在901℃下,N2 (g)+ 3H2
 (g)
(g) 2NH3(g)的Kp=
2NH3(g)的Kp=②使纯氨气直接通过同一铁催化剂,出来的气体同样缓缓通入20mL盐酸,用气量计测得标准状况下剩余干燥气体的体积为1.82L。同理可以滴定后计算出通入盐酸前氨气的量,进而计算出Kp。在操作、计算误差合理的范围内,①、②得到的Kp基本相等。这对你有何启发?
您最近一年使用:0次
2023-10-26更新
|
45次组卷
|
2卷引用:四川省蓬溪中学校2023-2024学年高二上学期10月月考化学试题



