某研究性学习小组为合成1丁醇,查阅资料得知一条合成路线:CH3CH===CH2+CO+H2→CH3CH2CH2CHO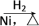 CH3CH2CH2CH2OH,CO的制备原理:HCOOH
CH3CH2CH2CH2OH,CO的制备原理:HCOOH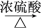 CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2丙醇,从中选择合适的试剂制备氢气、丙烯。写出化学方程式:______________________________________________ 。
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是________ 、________ ;c和d中盛装的试剂分别是________ 、________ 。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是________ (填序号)。
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是________ 。
a.低温、高压、催化剂 b.适当的温度、高压、催化剂
c.常温、常压、催化剂 d.适当的温度、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1丁醇粗品,为纯化1丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和)―→RCH(OH)SO3Na↓;②沸点:乙醚 34 ℃,1丁醇 118 ℃,并设计出如下提纯路线:
粗品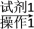 滤液
滤液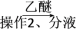 有机层
有机层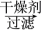 1丁醇、乙醚
1丁醇、乙醚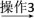 纯品
纯品
试剂1为________ ,操作1为________ ,操作2为________ ,操作3为________ 。
 CH3CH2CH2CH2OH,CO的制备原理:HCOOH
CH3CH2CH2CH2OH,CO的制备原理:HCOOH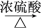 CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。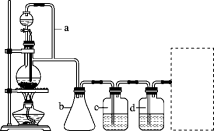
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2丙醇,从中选择合适的试剂制备氢气、丙烯。写出化学方程式:
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是
a.低温、高压、催化剂 b.适当的温度、高压、催化剂
c.常温、常压、催化剂 d.适当的温度、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1丁醇粗品,为纯化1丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和)―→RCH(OH)SO3Na↓;②沸点:乙醚 34 ℃,1丁醇 118 ℃,并设计出如下提纯路线:
粗品
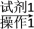 滤液
滤液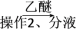 有机层
有机层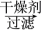 1丁醇、乙醚
1丁醇、乙醚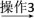 纯品
纯品试剂1为
更新时间:2016-12-09 15:03:11
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】乙烯是世界上产量最大的化学产品之一,乙烯工业是石油化工产业的核心。氨气是化肥工业和基础有机合成工业的重要原料。
(1)甲醇制备乙烯的主要反应:
i.2CH3OH(g)=C2H4(g)+2H2O(g) △H1=-20.9kJ·mol-1
ii.3CH3OH(G)=C3H6(g)+3H2O(g) △H2=-98.1kJ·mol-1
iii.4CH3OH(g)=C4H8(g)+4H2O(g) △H3=-118.1kJ·mol-1
①C3H6转化为C2H4的热化学方程式iv:2C3H6=3C2H4(g) △H4=___________ 。
②加入N2作为稀释剂,反应i中C2H4的产率将___________ (填“增大”、减小”或“不变”)
(2)乙炔在Pd表面选择加氢生成乙烯的反应机理如图。其中吸附在Pd表面上的物种用*标注。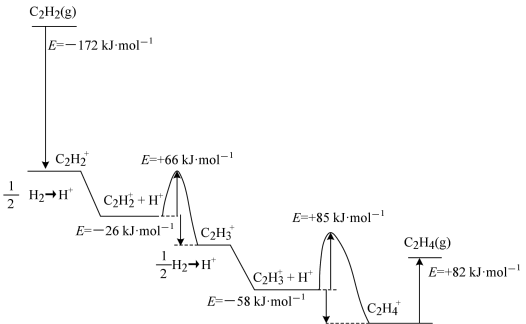
上述吸附反应为___________ (填“放热”或“吸热”)反应,该历程中最大能垒(活化能)Ea(正)=___________ kJ·mol-1,该步骤的化学方程式为:___________ 。
(3)在合成氨的实际生产中,未反应的气体(含不参与反应的惰性气体)可多次循环使用。当氢氮比[c(H2):c(N2)]为3时,平衡时氨气的含量关系式为:ω(NH3)=0.325•KP•P•(1-i)2,(KP表示平衡常数;P表示平衡体系压强;i表示惰性气体体积分数)。当温度为500℃,平衡体系压强为2.3MPa,不含惰性气体时,平衡时氨气的含量为ω。若温度不变,体系中有13%的惰性气体,此时增大压强,Kp___________ 将(填“变大”、“变小”或“不变”)。欲使平衡时氨气的含量仍为ω应将压强调整至___________ MPa(2位有效数字)。
(4)在t℃、压强为3.6MPa条件下,向一恒压密闭容器中通入氢氮比为3的混合气体,体系中气体的含量与时间变化关系如图所示:反应20min达到平衡,试求0~20min内氨气的平均反应速率v(NH3)=___________ MPa·min-1.若起始条件一样,在恒容容器中发生反应,则达到平衡时H2的含量符合图中___________ 点(填“d”、“e”、“f”或“g”)。
(1)甲醇制备乙烯的主要反应:
i.2CH3OH(g)=C2H4(g)+2H2O(g) △H1=-20.9kJ·mol-1
ii.3CH3OH(G)=C3H6(g)+3H2O(g) △H2=-98.1kJ·mol-1
iii.4CH3OH(g)=C4H8(g)+4H2O(g) △H3=-118.1kJ·mol-1
①C3H6转化为C2H4的热化学方程式iv:2C3H6=3C2H4(g) △H4=
②加入N2作为稀释剂,反应i中C2H4的产率将
(2)乙炔在Pd表面选择加氢生成乙烯的反应机理如图。其中吸附在Pd表面上的物种用*标注。

上述吸附反应为
(3)在合成氨的实际生产中,未反应的气体(含不参与反应的惰性气体)可多次循环使用。当氢氮比[c(H2):c(N2)]为3时,平衡时氨气的含量关系式为:ω(NH3)=0.325•KP•P•(1-i)2,(KP表示平衡常数;P表示平衡体系压强;i表示惰性气体体积分数)。当温度为500℃,平衡体系压强为2.3MPa,不含惰性气体时,平衡时氨气的含量为ω。若温度不变,体系中有13%的惰性气体,此时增大压强,Kp
(4)在t℃、压强为3.6MPa条件下,向一恒压密闭容器中通入氢氮比为3的混合气体,体系中气体的含量与时间变化关系如图所示:反应20min达到平衡,试求0~20min内氨气的平均反应速率v(NH3)=

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】课本里介绍的合成氨技术叫哈伯法,是德国诺贝尔化学奖获得者哈伯发明的。其合成原理为:N2(g)+3H2(g) 2NH3(g) ;△H <0
2NH3(g) ;△H <0
(1)下列关于工业合成氨的说法不正确的是______ 。
A.因为△H <0,所以该反应一定不需要加热
B.高压有利于氨气的生成
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂加快反应速率是因为催化剂降低了反应的△H
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是_____ 。
a.容器内N2、H2、 NH3的浓度之比为1:3:2
b.v正(N2)=v逆(H2)
c.容器内压强保持不变
d.合气体的密度保持不变
(3)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。

①图象中T2和T1的关系是: T2____ T1(填“>,<或=”,下同)
②a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是____ (填字母)。
(4)恒温下,往一个4 L的密闭容器中充入5.2 mol H2和 2 mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
①此条件下该反应的氢气平衡浓度为______ 。
②若维持容器体积不变,温度不变,往原平衡体系中加入H2、 N2和NH3各 4mol,化学平衡将向__ 反应方向移动(填 “正”或“逆”)。
③N2(g)+3H2(g) 2NH3(g) ;△H =-92 kJ/mol。在恒温恒容的密闭容器中充入1 mol N2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为
2NH3(g) ;△H =-92 kJ/mol。在恒温恒容的密闭容器中充入1 mol N2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为_____ mol。
(5)已知:N2(g)+3H2(g) 2NH3(g) ;△H =-92 kJ/mol。
2NH3(g) ;△H =-92 kJ/mol。
N2(g) +O2(g) = 2NO(g) △H= +181 kJ/mol
2H2(g)+O2(g)= 2H2O(g) △H= -484 kJ/mol
写出氨气催化氧化生成NO和水蒸气的热化学方程式_____ 。
 2NH3(g) ;△H <0
2NH3(g) ;△H <0(1)下列关于工业合成氨的说法不正确的是
A.因为△H <0,所以该反应一定不需要加热
B.高压有利于氨气的生成
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂加快反应速率是因为催化剂降低了反应的△H
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、 NH3的浓度之比为1:3:2
b.v正(N2)=v逆(H2)
c.容器内压强保持不变
d.合气体的密度保持不变
(3)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。

①图象中T2和T1的关系是: T2
②a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是
(4)恒温下,往一个4 L的密闭容器中充入5.2 mol H2和 2 mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①此条件下该反应的氢气平衡浓度为
②若维持容器体积不变,温度不变,往原平衡体系中加入H2、 N2和NH3各 4mol,化学平衡将向
③N2(g)+3H2(g)
 2NH3(g) ;△H =-92 kJ/mol。在恒温恒容的密闭容器中充入1 mol N2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为
2NH3(g) ;△H =-92 kJ/mol。在恒温恒容的密闭容器中充入1 mol N2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为(5)已知:N2(g)+3H2(g)
 2NH3(g) ;△H =-92 kJ/mol。
2NH3(g) ;△H =-92 kJ/mol。N2(g) +O2(g) = 2NO(g) △H= +181 kJ/mol
2H2(g)+O2(g)= 2H2O(g) △H= -484 kJ/mol
写出氨气催化氧化生成NO和水蒸气的热化学方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】燃煤烟气中含有大量NOx、CO2、CO和SO2,经处理可获得重要的化工原料。
(1)用CH4催化还原NOx可以消除氮氧化物的污染。
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574.0kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574.0kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) ΔH2=+1160.0kJ·mol-1
2N2(g)+CO2(g)+2H2O(g) ΔH2=+1160.0kJ·mol-1
若反应中还原NOx至N2,消耗标准状况下4.48LCH4,则反应过程中转移的电子总数为______ 。
(2)利用烟气中分离所得的CO2、CO与H2按一定比例混合在催化剂的作用下合成甲醇,发生的主要反应如下:
反应1:CO(g)+2H2(g) CH3OH(g)ΔH1=-99.0kJ·mol-1
CH3OH(g)ΔH1=-99.0kJ·mol-1
反应2:CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH2=+83.0kJ·mol-1
CH3OH(g)+H2O(g)ΔH2=+83.0kJ·mol-1
反应3:CO2(g)+H2(g) CO(g)+H2O(g)ΔH3=+384.0kJ·mol-1
CO(g)+H2O(g)ΔH3=+384.0kJ·mol-1
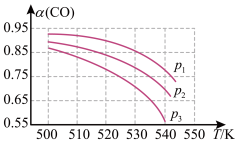
反应体系中CO平衡转化率(α)与温度和压强的关系如图所示。
①α(CO)随温度升高而减小的原因是_____ 。
②图中的p1、p2、p3由大到小的顺序为______ 。
(3)亚氯酸钠(NaClO2)和次氯酸钠(NaClO)混合液作为复合吸收剂可脱除烟气中的NOx、SO2,使其转化为 、
、 。
。
①写出NO与NaClO2反应的离子方程式:____ 。
②如图表示在一定条件下温度与复合吸收剂对烟气中SO2、NO脱除效率的关系。图中SO2比NO脱除效率高的原因可能是___ 。
(1)用CH4催化还原NOx可以消除氮氧化物的污染。
CH4(g)+4NO2(g)
 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574.0kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574.0kJ·mol-1 CH4(g)+4NO(g)
 2N2(g)+CO2(g)+2H2O(g) ΔH2=+1160.0kJ·mol-1
2N2(g)+CO2(g)+2H2O(g) ΔH2=+1160.0kJ·mol-1 若反应中还原NOx至N2,消耗标准状况下4.48LCH4,则反应过程中转移的电子总数为
(2)利用烟气中分离所得的CO2、CO与H2按一定比例混合在催化剂的作用下合成甲醇,发生的主要反应如下:
反应1:CO(g)+2H2(g)
 CH3OH(g)ΔH1=-99.0kJ·mol-1
CH3OH(g)ΔH1=-99.0kJ·mol-1反应2:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)ΔH2=+83.0kJ·mol-1
CH3OH(g)+H2O(g)ΔH2=+83.0kJ·mol-1反应3:CO2(g)+H2(g)
 CO(g)+H2O(g)ΔH3=+384.0kJ·mol-1
CO(g)+H2O(g)ΔH3=+384.0kJ·mol-1
反应体系中CO平衡转化率(α)与温度和压强的关系如图所示。
①α(CO)随温度升高而减小的原因是
②图中的p1、p2、p3由大到小的顺序为
(3)亚氯酸钠(NaClO2)和次氯酸钠(NaClO)混合液作为复合吸收剂可脱除烟气中的NOx、SO2,使其转化为
 、
、 。
。①写出NO与NaClO2反应的离子方程式:
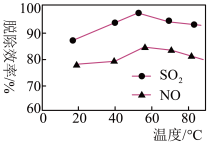
②如图表示在一定条件下温度与复合吸收剂对烟气中SO2、NO脱除效率的关系。图中SO2比NO脱除效率高的原因可能是

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
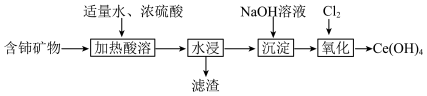
【推荐1】Ce(OH)4可用于制备(NH4)2[Ce(NO3)6]等重要的含铈化合物。实验室由含铈矿物(主要含CeO2还含CaO及金属氟化物等杂质)制备Ce(OH)4的主要实验过程如图:
已知:Ce(OH)3、Ce(OH)4分别为灰白色、黄色难溶物。
(1)“加热酸溶”步骤中不使用玻璃仪器而应使用铅制容器,其主要原因用化学方程式可表示为________ ;CeO2与浓硫酸反应生成Ce2(SO4)3和一种能使带火星的木条复燃的气体,其化学方程式为________ 。
(2)“水浸”过程得到的滤渣主要成分为________ 。
(3)“沉淀”步骤中得到的沉淀为Ce(OH)3,能证明沉淀已完全的实验操作为________ 。
(4)制备Ce(OH)4的装置如图所示:
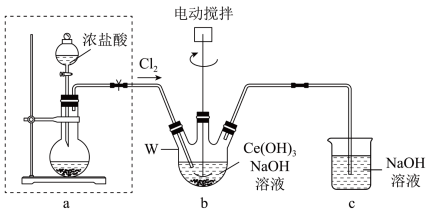
①装置a的烧瓶中盛放的固体为________ (填化学式)。
②制备Ce(OH)4的实验方案为:按照如图搭好装置,________ ,加入药品,打开电动搅拌装置,________ ,直到b中看到________ 为止,停止通Cl2后改通空气一段时间,将装置b中的反应混合物过滤取出,用蒸馏水洗涤至________ 为止,低温晾干即得到较纯净的Ce(OH)4。(除装置图试剂外,还须用试剂:硝酸银溶液、稀硝酸)

已知:Ce(OH)3、Ce(OH)4分别为灰白色、黄色难溶物。
(1)“加热酸溶”步骤中不使用玻璃仪器而应使用铅制容器,其主要原因用化学方程式可表示为
(2)“水浸”过程得到的滤渣主要成分为
(3)“沉淀”步骤中得到的沉淀为Ce(OH)3,能证明沉淀已完全的实验操作为
(4)制备Ce(OH)4的装置如图所示:

①装置a的烧瓶中盛放的固体为
②制备Ce(OH)4的实验方案为:按照如图搭好装置,
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
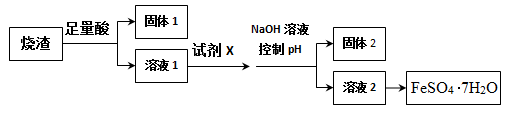
【推荐2】其同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、A12O3),不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如图流程:
已知,某些金属阳离子可以通过“控制pH”[既调节溶液的酸碱性,pH=-lgc(H+)),pH值越大,碱性越强]使其转化为沉淀。固体2为白色沉淀。
(1)加足量酸之前,烧渣需经过进一步粉碎处理,粉碎的目的是__________ 。
(2)溶解烧渣选用的足量酸能否是盐酸,并说明理由_____ 。
(3)固体1有诸多用途,请列举其中一个____ ,试剂X的作用是______ 。
(4)某同学在控制pH这步操作时不慎将氢氧化钠溶液加过量了,结果得到的白色沉淀迅速转化为灰绿色,最终变为红褐色沉淀。请用化学用语解释固体2白色变成红褐色的原_____________ 。
(5)从溶液2中得到绿矾的过程中除需控制温度,防止产品分解外还应注意______ 。
(6)唐代苏敬《新修本草》对绿矾有如下描述:“本来绿色,新出窑未见风者,正如琉璃。陶及今人谓之石胆,烧之赤色。”另已知1mol绿矾隔绝空气高温煅烧完全分解,转移NA个电子。试写出绿矾隔绝空气高温煅烧分解的化学反应方程式____________ 。

已知,某些金属阳离子可以通过“控制pH”[既调节溶液的酸碱性,pH=-lgc(H+)),pH值越大,碱性越强]使其转化为沉淀。固体2为白色沉淀。
(1)加足量酸之前,烧渣需经过进一步粉碎处理,粉碎的目的是
(2)溶解烧渣选用的足量酸能否是盐酸,并说明理由
(3)固体1有诸多用途,请列举其中一个
(4)某同学在控制pH这步操作时不慎将氢氧化钠溶液加过量了,结果得到的白色沉淀迅速转化为灰绿色,最终变为红褐色沉淀。请用化学用语解释固体2白色变成红褐色的原
(5)从溶液2中得到绿矾的过程中除需控制温度,防止产品分解外还应注意
(6)唐代苏敬《新修本草》对绿矾有如下描述:“本来绿色,新出窑未见风者,正如琉璃。陶及今人谓之石胆,烧之赤色。”另已知1mol绿矾隔绝空气高温煅烧完全分解,转移NA个电子。试写出绿矾隔绝空气高温煅烧分解的化学反应方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
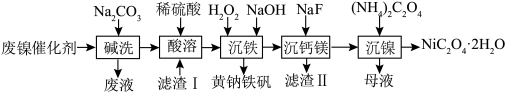
【推荐3】 是一种淡绿色晶体,难溶于水。以一种废镍催化剂(含NiO、MgO、FeO、CaO,还含有少量油脂等)为原料制取制备
是一种淡绿色晶体,难溶于水。以一种废镍催化剂(含NiO、MgO、FeO、CaO,还含有少量油脂等)为原料制取制备 的工艺流程如下:
的工艺流程如下:
已知:酸浸后溶液中金属离子有 、
、 、
、 、
、 ;本题中,
;本题中, 不被氧化。
不被氧化。
回答下列问题:
(1)“碱洗”工序中,加入 溶液后应加热煮沸5min,煮沸的目的为
溶液后应加热煮沸5min,煮沸的目的为_______ 。
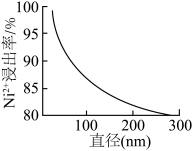
(2)酸浸。碱洗后的废镍催化剂先粉碎后再用稀硫酸浸取,测得单位时间内 的浸出率与粉碎后废镍催化剂固体颗粒直径大小关系如图所示。固体颗粒直径越大,
的浸出率与粉碎后废镍催化剂固体颗粒直径大小关系如图所示。固体颗粒直径越大, 的浸出率越低的原因是
的浸出率越低的原因是_______ 。
(3)沉铁。向所得浸出液中加入足量 溶液,并控制溶液温度不超过40℃。充分反应后向溶液中滴加NaOH溶液至溶液的pH约为4,过滤得黄铁钠矾[
溶液,并控制溶液温度不超过40℃。充分反应后向溶液中滴加NaOH溶液至溶液的pH约为4,过滤得黄铁钠矾[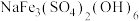 ]。向浸出液中加
]。向浸出液中加 溶液,并控制温度的目的是
溶液,并控制温度的目的是_______ 。
(4)沉镁钙。向沉铁后的溶液中滴加NaF溶液,将 、
、 转化成
转化成 沉淀和
沉淀和 沉淀。测得不同pH条件下,溶液中剩余
沉淀。测得不同pH条件下,溶液中剩余 、
、 的浓度与pH的关系如图所示。已知沉铁后溶液中
的浓度与pH的关系如图所示。已知沉铁后溶液中 ,
,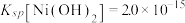 。
。

①pH越低,溶液中剩余 、
、 的浓度越大的原因是
的浓度越大的原因是_______ 。
②实验时通常控制溶液的pH在6~7之间。实验时pH不能大于7的原因是_______ 。
(5)测定某 产品的纯度,现进行如下实验:准确取2.400g样品,用足量硫酸溶解后,加水稀释到250mL,取25.00mL所配溶液于锥形瓶中,加入12.00mL 0.0500
产品的纯度,现进行如下实验:准确取2.400g样品,用足量硫酸溶解后,加水稀释到250mL,取25.00mL所配溶液于锥形瓶中,加入12.00mL 0.0500 标准
标准 溶液,振荡使其充分反应。向反应后的溶液滴加0.03000
溶液,振荡使其充分反应。向反应后的溶液滴加0.03000 的
的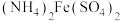 标准溶液与过量的
标准溶液与过量的 反应,恰好完全反应时消耗
反应,恰好完全反应时消耗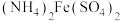 标准溶液体积为20.00mL。计算
标准溶液体积为20.00mL。计算 产品的纯度
产品的纯度_______ (写出计算过程,杂质不参与反应)。
实验过程中反应如下:
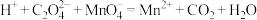 (未配平)
(未配平)
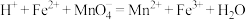 (未配平)
(未配平)
 是一种淡绿色晶体,难溶于水。以一种废镍催化剂(含NiO、MgO、FeO、CaO,还含有少量油脂等)为原料制取制备
是一种淡绿色晶体,难溶于水。以一种废镍催化剂(含NiO、MgO、FeO、CaO,还含有少量油脂等)为原料制取制备 的工艺流程如下:
的工艺流程如下:
已知:酸浸后溶液中金属离子有
 、
、 、
、 、
、 ;本题中,
;本题中, 不被氧化。
不被氧化。回答下列问题:
(1)“碱洗”工序中,加入
 溶液后应加热煮沸5min,煮沸的目的为
溶液后应加热煮沸5min,煮沸的目的为(2)酸浸。碱洗后的废镍催化剂先粉碎后再用稀硫酸浸取,测得单位时间内
 的浸出率与粉碎后废镍催化剂固体颗粒直径大小关系如图所示。固体颗粒直径越大,
的浸出率与粉碎后废镍催化剂固体颗粒直径大小关系如图所示。固体颗粒直径越大, 的浸出率越低的原因是
的浸出率越低的原因是
(3)沉铁。向所得浸出液中加入足量
 溶液,并控制溶液温度不超过40℃。充分反应后向溶液中滴加NaOH溶液至溶液的pH约为4,过滤得黄铁钠矾[
溶液,并控制溶液温度不超过40℃。充分反应后向溶液中滴加NaOH溶液至溶液的pH约为4,过滤得黄铁钠矾[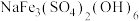 ]。向浸出液中加
]。向浸出液中加 溶液,并控制温度的目的是
溶液,并控制温度的目的是(4)沉镁钙。向沉铁后的溶液中滴加NaF溶液,将
 、
、 转化成
转化成 沉淀和
沉淀和 沉淀。测得不同pH条件下,溶液中剩余
沉淀。测得不同pH条件下,溶液中剩余 、
、 的浓度与pH的关系如图所示。已知沉铁后溶液中
的浓度与pH的关系如图所示。已知沉铁后溶液中 ,
,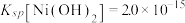 。
。
①pH越低,溶液中剩余
 、
、 的浓度越大的原因是
的浓度越大的原因是②实验时通常控制溶液的pH在6~7之间。实验时pH不能大于7的原因是
(5)测定某
 产品的纯度,现进行如下实验:准确取2.400g样品,用足量硫酸溶解后,加水稀释到250mL,取25.00mL所配溶液于锥形瓶中,加入12.00mL 0.0500
产品的纯度,现进行如下实验:准确取2.400g样品,用足量硫酸溶解后,加水稀释到250mL,取25.00mL所配溶液于锥形瓶中,加入12.00mL 0.0500 标准
标准 溶液,振荡使其充分反应。向反应后的溶液滴加0.03000
溶液,振荡使其充分反应。向反应后的溶液滴加0.03000 的
的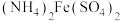 标准溶液与过量的
标准溶液与过量的 反应,恰好完全反应时消耗
反应,恰好完全反应时消耗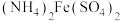 标准溶液体积为20.00mL。计算
标准溶液体积为20.00mL。计算 产品的纯度
产品的纯度实验过程中反应如下:
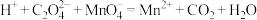 (未配平)
(未配平)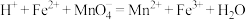 (未配平)
(未配平)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】有机化合物对人类的生活和社会发展具有极其重要的意义。请回答下列问题:
(1)人们认为苯是一种不饱和烃,但是苯不能使溴水褪色,性质类似烷烃,写出苯与液溴发生取代反应的化学方程式_____________________________________________
(2)1834年德国科学家米希尔里希,通过蒸馏安息香酸(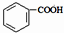 即苯甲酸)和石灰的混合物得到液体,命名为苯,写出苯甲酸钠与碱石灰共热(与NaOH反应)生成苯的化学方程式
即苯甲酸)和石灰的混合物得到液体,命名为苯,写出苯甲酸钠与碱石灰共热(与NaOH反应)生成苯的化学方程式_____________________________
(3)某烷烃碳架结构如图所示: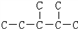 ,此烷烃的一溴代物有
,此烷烃的一溴代物有_________ 种;若此烷烃为单烯烃加氢制得,则此烯烃的结构有__________ 种。
(4)某有机物由C、H、O三种元素组成,球棍模型如图所示:

写出此有机物与金属钠反应的化学方程式_________________________________
(5)乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用下列装置来制备。
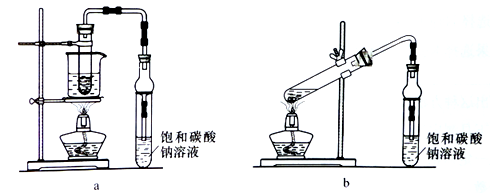
完成下列填空:
①实验时,加入药品的顺序是______________ ,该反应进行的比较缓慢,为了提高反应速率,一般要加入浓硫酸做催化剂,并_____________ 。
②反应结束后,将试管中收集到的产品倒入分液漏斗中,_________ 、静置,然后分液。
③若用b装置制备乙酸乙酯,其缺点有__________________ (答一条即可)。
(1)人们认为苯是一种不饱和烃,但是苯不能使溴水褪色,性质类似烷烃,写出苯与液溴发生取代反应的化学方程式
(2)1834年德国科学家米希尔里希,通过蒸馏安息香酸(
 即苯甲酸)和石灰的混合物得到液体,命名为苯,写出苯甲酸钠与碱石灰共热(与NaOH反应)生成苯的化学方程式
即苯甲酸)和石灰的混合物得到液体,命名为苯,写出苯甲酸钠与碱石灰共热(与NaOH反应)生成苯的化学方程式(3)某烷烃碳架结构如图所示:
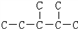 ,此烷烃的一溴代物有
,此烷烃的一溴代物有(4)某有机物由C、H、O三种元素组成,球棍模型如图所示:

写出此有机物与金属钠反应的化学方程式
(5)乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用下列装置来制备。

完成下列填空:
①实验时,加入药品的顺序是
②反应结束后,将试管中收集到的产品倒入分液漏斗中,
③若用b装置制备乙酸乙酯,其缺点有
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】苯甲醇与苯甲酸是重要的化工原料,可通过苯甲醛在氢氧化钠水溶液中的歧化反应制得,反应式为:2 +NaOH
+NaOH
 +
+ ,某研究小组在实验室制备苯甲醇与苯甲酸,反应结束后对反应液按下列步骤处理:
,某研究小组在实验室制备苯甲醇与苯甲酸,反应结束后对反应液按下列步骤处理:

重结晶过程:溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥
已知:苯甲醇易溶于乙醚、乙醇,在水中溶解度较小。请根据以上信息,回答问题:
(1)萃取分离苯甲醇与苯甲酸钠时,合适的萃取剂是_______ ,其理由是_______ 充分萃取并静置分层,打开分液漏斗上口的玻璃塞后,上、下层依次分离。
(2)苯甲酸在A、B、C三种溶剂中的溶解度(s)随温度变化的曲线如下图所示:

①重结晶时,合适的溶剂是_______ (填字母)。
②洗涤时采用的合适洗涤剂是_______ (填字母)。
A.饱和食盐水 B.Na2CO3溶液 C.稀硫酸 D.蒸馏水
(3)如图是减压过滤装置,请指出其中一处明显错误:_______ 。

 +NaOH
+NaOH
 +
+ ,某研究小组在实验室制备苯甲醇与苯甲酸,反应结束后对反应液按下列步骤处理:
,某研究小组在实验室制备苯甲醇与苯甲酸,反应结束后对反应液按下列步骤处理:
重结晶过程:溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥
已知:苯甲醇易溶于乙醚、乙醇,在水中溶解度较小。请根据以上信息,回答问题:
(1)萃取分离苯甲醇与苯甲酸钠时,合适的萃取剂是
(2)苯甲酸在A、B、C三种溶剂中的溶解度(s)随温度变化的曲线如下图所示:

①重结晶时,合适的溶剂是
②洗涤时采用的合适洗涤剂是
A.饱和食盐水 B.Na2CO3溶液 C.稀硫酸 D.蒸馏水
(3)如图是减压过滤装置,请指出其中一处明显错误:

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】1,2—二氯乙烷(CH2ClCH2Cl)外观为无色或浅黄色透明液体,难溶于水,易溶于有机溶剂,碱性条件下水解程度较大,主要用作氯乙烯(聚氯乙烯单体)制取过程的中间体。实验室制备1,2—二氯乙烷的主要原理:C2H5OH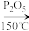 CH2=CH2+H2O;Cl2+CH2=CH2→CH2ClCH2Cl。
CH2=CH2+H2O;Cl2+CH2=CH2→CH2ClCH2Cl。

(1)写出装置A中发生反应的离子方程式___ 。
(2)B装置中的作用是___ 。
(3)根据制备原理,G装置中应该添加的仪器是___ 。
(4)D装置中多孔球泡的作用是___ 。
(5)A装置橡皮管的作用___ 。
(6)D装置排出尾气可以通过盛有__ 、NaOH溶液的洗气瓶进行吸收。
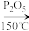 CH2=CH2+H2O;Cl2+CH2=CH2→CH2ClCH2Cl。
CH2=CH2+H2O;Cl2+CH2=CH2→CH2ClCH2Cl。
(1)写出装置A中发生反应的离子方程式
(2)B装置中的作用是
(3)根据制备原理,G装置中应该添加的仪器是
(4)D装置中多孔球泡的作用是
(5)A装置橡皮管的作用
(6)D装置排出尾气可以通过盛有
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】现有失去标签的CaCl2、AgNO3、HCl、和Na2CO3四瓶溶液。为了确定四种溶液的成分,将它们编号为A、B、C、D后进行化学实验。实验记录如下:
上述实验中A、B、C、D四瓶溶液分别是(用化学式表示所含溶质)
A___ B___ C___ D___
| 实验顺序 | 实验内容 | 实验现象 |
| ① | A+B | 无明显现象 |
| ② | B+D | 有无色无味气体放出 |
| ③ | C+B | 有白色沉淀生成 |
| ④ | A+D | 有白色沉淀生成 |
A
您最近一年使用:0次
【推荐2】将过量的0.2g铜粉与5mL1 mol•L‾1FeCl3溶液混合,充分振荡,溶液棕黄色变浅,溶液变绿,有灰白色固体出现。通过查阅资料,初步认为灰白色固体可能含CuCl(CuCl白色晶体,不溶于水、硫酸、稀硝酸,溶于氨水、浓盐酸溶液中,生成络合物)。为进一步探究灰白色固体是否含CuCl,进行一系列实验。已知:① CuCl+2NH3•H2O [Cu(NH3)2]++Cl‾+2H2O(无色溶液)② 提供的试剂:稀HNO3、AgNO3溶液、氨水、KSCN溶液
[Cu(NH3)2]++Cl‾+2H2O(无色溶液)② 提供的试剂:稀HNO3、AgNO3溶液、氨水、KSCN溶液
请回答下列问题:
(1)生成CuCl的化学方程式____________________________________ 。
(2)下列为常见的分离装置(装置中的其他仪器忽略),从上述溶液中分离出固体混合物,应选用的相应装置中的仪器名称是_______________ 。
A.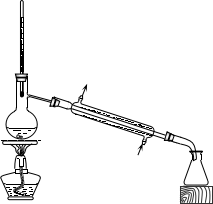 B.
B.  C.
C. D.
D. E.
E. F.
F.
(3)提纯灰白色固体:将固体混合物用蒸馏水洗涤以除去固体表面的Fe3+、Cl‾。为检验固体混合物是否洗涤干净,最佳方案是检验洗涤液中是否含有_______ (填离子符号),理由是_____________________________________________ 。
(4)设计实验检验得到的灰白色固体中含有CuCl,该实验过程中用到的试剂为____________________ 。
(5)实验测得灰白色固体混合物质量为a g,其中CuCl b g。上述实验过程中还有CuCl2生成,则生成CuCl2的物质的量是____________ (列出计算式即可)。
 [Cu(NH3)2]++Cl‾+2H2O(无色溶液)② 提供的试剂:稀HNO3、AgNO3溶液、氨水、KSCN溶液
[Cu(NH3)2]++Cl‾+2H2O(无色溶液)② 提供的试剂:稀HNO3、AgNO3溶液、氨水、KSCN溶液请回答下列问题:
(1)生成CuCl的化学方程式
(2)下列为常见的分离装置(装置中的其他仪器忽略),从上述溶液中分离出固体混合物,应选用的相应装置中的仪器名称是
A.
 B.
B.  C.
C. D.
D. E.
E. F.
F.
(3)提纯灰白色固体:将固体混合物用蒸馏水洗涤以除去固体表面的Fe3+、Cl‾。为检验固体混合物是否洗涤干净,最佳方案是检验洗涤液中是否含有
(4)设计实验检验得到的灰白色固体中含有CuCl,该实验过程中用到的试剂为
(5)实验测得灰白色固体混合物质量为a g,其中CuCl b g。上述实验过程中还有CuCl2生成,则生成CuCl2的物质的量是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】高氯酸铵(NH4ClO4)常作火箭发射的推进剂,实验室用NaClO4、NH4Cl等原料制取(部分物质的溶解度如图1、图2),其实验流程如图3:
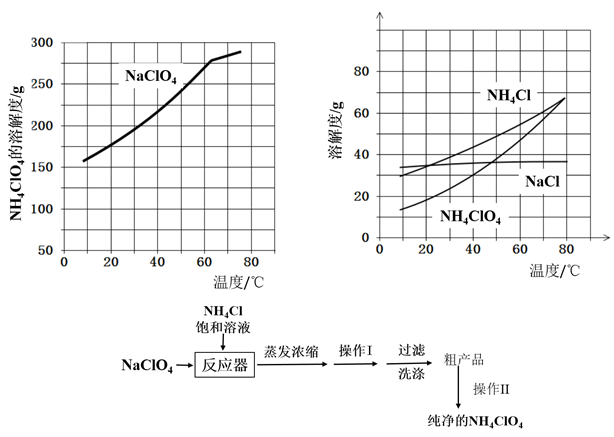
(1)反应器中发生反应的基本反应类型是________ 。
(2)上述流程中由粗产品获得纯净高氯酸铵的方法为________ 。
(3)洗涤粗产品时,宜用________ (填“0℃冷水”或“80°C热水”)洗涤。
(4)已知NH4ClO4在400℃时开始分解为N2、Cl2、H2O。某课题组设计实验探究NH4ClO4的分解产物(假设装置内药品均足量,部分夹持装置已省略)
实验开始前,已用CO2气体将整套实验装置中空气排尽;焦性没食子酸溶液用于吸收氧气。
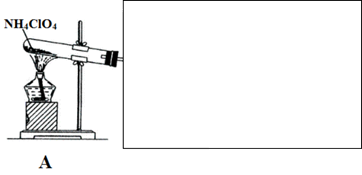
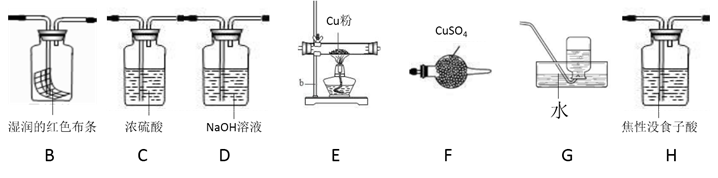
①写出高氯酸铵分解的化学方程式________ 。
②为了验证上述产物,按气流从左至右,装置的连接顺序为A→________ (填装置对应的字母),证明氧气存在的实验现象为________ 。
③若装置E硬质玻璃管中的Cu粉换成Mg粉,向得到的产物中滴加蒸馏水,产生使湿润的红色石蕊试纸变蓝的气体。滴加蒸馏水发生反应的化学方程式为________ 。

(1)反应器中发生反应的基本反应类型是
(2)上述流程中由粗产品获得纯净高氯酸铵的方法为
(3)洗涤粗产品时,宜用
(4)已知NH4ClO4在400℃时开始分解为N2、Cl2、H2O。某课题组设计实验探究NH4ClO4的分解产物(假设装置内药品均足量,部分夹持装置已省略)
实验开始前,已用CO2气体将整套实验装置中空气排尽;焦性没食子酸溶液用于吸收氧气。


①写出高氯酸铵分解的化学方程式
②为了验证上述产物,按气流从左至右,装置的连接顺序为A→
③若装置E硬质玻璃管中的Cu粉换成Mg粉,向得到的产物中滴加蒸馏水,产生使湿润的红色石蕊试纸变蓝的气体。滴加蒸馏水发生反应的化学方程式为
您最近一年使用:0次



