解题方法
1 . 以煤为原料,经由甲醇可制取甲醚,也可以制取烯烃并可以此取代传统的以石油为原料制取烯烃的路线。
(1)已知:在25℃和101kPa条件下,甲醇的燃烧热为-726.5 ,乙烯的燃烧热为-1411
,乙烯的燃烧热为-1411  ,
,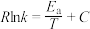 (
( 为活化能,R、C为常数,k为平衡常数)。则:
为活化能,R、C为常数,k为平衡常数)。则:
① 脱水生成
脱水生成 的热化学方程式是
的热化学方程式是___________ ,该反应自发进行的条件是___________ (填“较低”、“较高”或“任意”)温度。
②甲醇脱水生成乙烯的温度与平衡常数的实验数据图如图1所示,该反应的正反应的活化能为___________  。
。
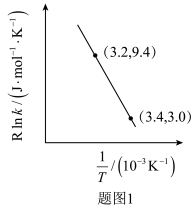
(2)以煤为原料气化产生的原料气可以用来合成 和
和 ,合成气平衡转化率随氢碳比 (
,合成气平衡转化率随氢碳比 (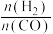 )的变化如图2所示:甲醇制取烃的过程中,会发生多种反应,可以生成
)的变化如图2所示:甲醇制取烃的过程中,会发生多种反应,可以生成 、
、 、
、 等,一定条件下,测得各烃的质量分数、
等,一定条件下,测得各烃的质量分数、 转化率随温度变化情况如图3所示。
转化率随温度变化情况如图3所示。
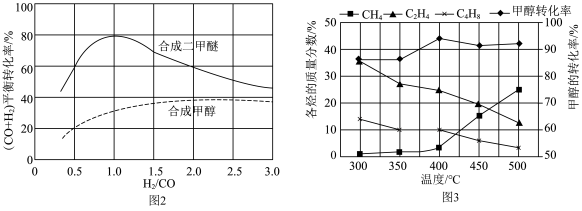
①下列叙述不正确 的是___________ 。
A.合成 的最佳氢碳比为1.0
的最佳氢碳比为1.0
B.甲醇制取烃的过程中,相同条件下,温度越高越有利于 的生成
的生成
C.甲醇制取乙烯的过程中,一般控制在350℃~400℃比较合适
D.甲醇制取烃的过程中, 的平衡转化率随温度升高先增大后减少
的平衡转化率随温度升高先增大后减少
②原料气合成 、
、 过程有如下反应发生:
过程有如下反应发生:
反应Ⅰ
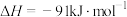
反应Ⅱ

反应Ⅲ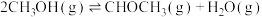

图2中原料气合成 的转化率高于
的转化率高于 的原因
的原因___________ 。
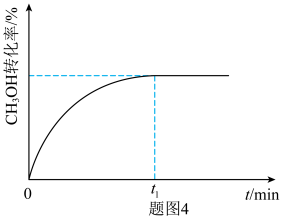
③在350℃,1MPa下,甲醇制取乙烯的转化率随时间的变化曲线如图4所示( 为该条件下的平衡时刻)。画出在相同条件下,向容器中添加氮气作稀释剂时甲醇的转化率随时间的变化曲线。
为该条件下的平衡时刻)。画出在相同条件下,向容器中添加氮气作稀释剂时甲醇的转化率随时间的变化曲线。_________
(1)已知:在25℃和101kPa条件下,甲醇的燃烧热为-726.5
 ,乙烯的燃烧热为-1411
,乙烯的燃烧热为-1411  ,
,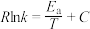 (
( 为活化能,R、C为常数,k为平衡常数)。则:
为活化能,R、C为常数,k为平衡常数)。则:①
 脱水生成
脱水生成 的热化学方程式是
的热化学方程式是②甲醇脱水生成乙烯的温度与平衡常数的实验数据图如图1所示,该反应的正反应的活化能为
 。
。
(2)以煤为原料气化产生的原料气可以用来合成
 和
和 ,合成气平衡转化率随氢碳比 (
,合成气平衡转化率随氢碳比 (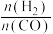 )的变化如图2所示:甲醇制取烃的过程中,会发生多种反应,可以生成
)的变化如图2所示:甲醇制取烃的过程中,会发生多种反应,可以生成 、
、 、
、 等,一定条件下,测得各烃的质量分数、
等,一定条件下,测得各烃的质量分数、 转化率随温度变化情况如图3所示。
转化率随温度变化情况如图3所示。
①下列叙述
A.合成
 的最佳氢碳比为1.0
的最佳氢碳比为1.0B.甲醇制取烃的过程中,相同条件下,温度越高越有利于
 的生成
的生成C.甲醇制取乙烯的过程中,一般控制在350℃~400℃比较合适
D.甲醇制取烃的过程中,
 的平衡转化率随温度升高先增大后减少
的平衡转化率随温度升高先增大后减少②原料气合成
 、
、 过程有如下反应发生:
过程有如下反应发生:反应Ⅰ

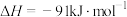
反应Ⅱ


反应Ⅲ
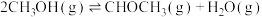

图2中原料气合成
 的转化率高于
的转化率高于 的原因
的原因③在350℃,1MPa下,甲醇制取乙烯的转化率随时间的变化曲线如图4所示(
 为该条件下的平衡时刻)。画出在相同条件下,向容器中添加氮气作稀释剂时甲醇的转化率随时间的变化曲线。
为该条件下的平衡时刻)。画出在相同条件下,向容器中添加氮气作稀释剂时甲醇的转化率随时间的变化曲线。
您最近一年使用:0次
名校
解题方法
2 . 碳达峰是指我国承诺2030年前,二氧化碳的排放不再增长。因此,诸多科学家都在大力研合理利用 和CO以减少碳的排放。
和CO以减少碳的排放。
(1) 可通过以下4种方式转化成有机物,从而有效实现碳循环。
可通过以下4种方式转化成有机物,从而有效实现碳循环。
a.
b.
c.
已知:
以上反应中,最环保节能的是_______ ,原子利用率最高的是_______ 。(填编号)
(2)我国科学家设计出一条仅11步的工业合成路线,实现了 到淀粉的合成。其第一步是把
到淀粉的合成。其第一步是把 还原为甲醇(CH3OH),该方法的化学方程式是:
还原为甲醇(CH3OH),该方法的化学方程式是: 。
。
回答下列问题:
①能说明该反应已达平衡状态的是_______ (填字母)。
A.单位时间内生成 的同时消耗了
的同时消耗了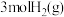
B.在恒温恒容的容器中,混合气体的平均摩尔质量保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,混合气体的密度不再变化
②该反应正逆反应的活化能大小为: (正)
(正)_______  (逆),且该反应在
(逆),且该反应在_______ 自发进行(填“高温”、“低温”“任何温度”或“任何温度都不”)
(3)利用CO高温时与磷石膏(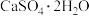 )反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
)反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
①在700℃时,主要的还原产物是一种硫的最低价盐,该物质为_______ 。
②在1150℃时,向盛有足量 的真空恒容密闭容器中充入一定量CO,反应体系起始压强为
的真空恒容密闭容器中充入一定量CO,反应体系起始压强为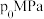 ,主要发生反应:
,主要发生反应: 。该反应达到平衡时,
。该反应达到平衡时,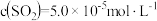 ,CO的转化率为50%,则初始时
,CO的转化率为50%,则初始时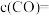
_______ mol/L,该反应的压强平衡常数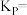
_______ MPa(忽略副反应;气体分压=总压×气体物质的量分数)。
(4)工业上也可用炭粉还原磷石膏,该反应的产物与C/S值(炭粉与 的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、
的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、 和
和 ;当C/S值大于0.7时,反应所得气体中
;当C/S值大于0.7时,反应所得气体中 的体积分数下降,可能的原因是
的体积分数下降,可能的原因是_______ 。

 和CO以减少碳的排放。
和CO以减少碳的排放。(1)
 可通过以下4种方式转化成有机物,从而有效实现碳循环。
可通过以下4种方式转化成有机物,从而有效实现碳循环。a.

b.

c.

已知:

以上反应中,最环保节能的是
(2)我国科学家设计出一条仅11步的工业合成路线,实现了
 到淀粉的合成。其第一步是把
到淀粉的合成。其第一步是把 还原为甲醇(CH3OH),该方法的化学方程式是:
还原为甲醇(CH3OH),该方法的化学方程式是: 。
。回答下列问题:
①能说明该反应已达平衡状态的是
A.单位时间内生成
 的同时消耗了
的同时消耗了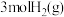
B.在恒温恒容的容器中,混合气体的平均摩尔质量保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,混合气体的密度不再变化
②该反应正逆反应的活化能大小为:
 (正)
(正) (逆),且该反应在
(逆),且该反应在(3)利用CO高温时与磷石膏(
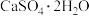 )反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
)反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。①在700℃时,主要的还原产物是一种硫的最低价盐,该物质为
②在1150℃时,向盛有足量
 的真空恒容密闭容器中充入一定量CO,反应体系起始压强为
的真空恒容密闭容器中充入一定量CO,反应体系起始压强为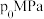 ,主要发生反应:
,主要发生反应: 。该反应达到平衡时,
。该反应达到平衡时,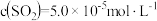 ,CO的转化率为50%,则初始时
,CO的转化率为50%,则初始时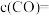
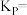
(4)工业上也可用炭粉还原磷石膏,该反应的产物与C/S值(炭粉与
 的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、
的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、 和
和 ;当C/S值大于0.7时,反应所得气体中
;当C/S值大于0.7时,反应所得气体中 的体积分数下降,可能的原因是
的体积分数下降,可能的原因是
您最近一年使用:0次
名校
解题方法
3 . 钌( )为稀有元素,广泛应用于电子、航空航天、化工等领域。某含钌的废渣主要成分为
)为稀有元素,广泛应用于电子、航空航天、化工等领域。某含钌的废渣主要成分为 、
、 、
、 、
、 ,一种从中回收
,一种从中回收 制
制 的工艺流程如下:
的工艺流程如下:
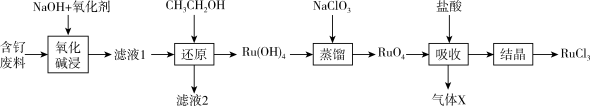
(1)“氧化碱浸”时,两种氧化剂在不同温度对钌浸出率和渣率分别如图1、图2所示,则适宜选择的氧化剂为_______ ;最佳反应温度为_______ 。
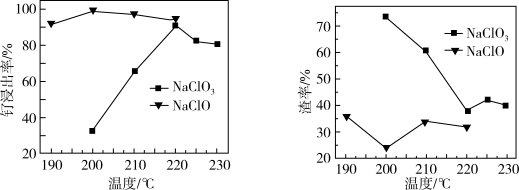
图1 图2
(2)滤液1中溶质主要成分为 、
、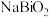 、
、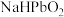 和
和_______ ;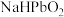 中
中 的化合价为
的化合价为_______ ; 转化为
转化为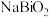 的化学方程式为
的化学方程式为_______ 。
(3)“还原”过程生成 和乙醛,且
和乙醛,且 明显增大,则该过程的离子反应方程式为
明显增大,则该过程的离子反应方程式为_______ 。
(4)“吸收”过程产生的气体X经Y溶液吸收后,经进一步处理可以循环利用,则X和Y的化学式分别为_______ 、_______ 。
(5) 在有机合成中有重要应用,其参与某有机物合成的路线如下图3所示(
在有机合成中有重要应用,其参与某有机物合成的路线如下图3所示( 代表乙酸,
代表乙酸, 代表苯基),则下列说法正确的是_______。
代表苯基),则下列说法正确的是_______。
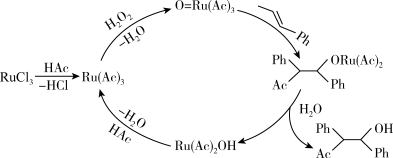
 )为稀有元素,广泛应用于电子、航空航天、化工等领域。某含钌的废渣主要成分为
)为稀有元素,广泛应用于电子、航空航天、化工等领域。某含钌的废渣主要成分为 、
、 、
、 、
、 ,一种从中回收
,一种从中回收 制
制 的工艺流程如下:
的工艺流程如下:
(1)“氧化碱浸”时,两种氧化剂在不同温度对钌浸出率和渣率分别如图1、图2所示,则适宜选择的氧化剂为

图1 图2
(2)滤液1中溶质主要成分为
 、
、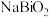 、
、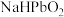 和
和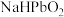 中
中 的化合价为
的化合价为 转化为
转化为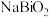 的化学方程式为
的化学方程式为(3)“还原”过程生成
 和乙醛,且
和乙醛,且 明显增大,则该过程的离子反应方程式为
明显增大,则该过程的离子反应方程式为(4)“吸收”过程产生的气体X经Y溶液吸收后,经进一步处理可以循环利用,则X和Y的化学式分别为
(5)
 在有机合成中有重要应用,其参与某有机物合成的路线如下图3所示(
在有机合成中有重要应用,其参与某有机物合成的路线如下图3所示( 代表乙酸,
代表乙酸, 代表苯基),则下列说法正确的是_______。
代表苯基),则下列说法正确的是_______。
A. 为催化剂 为催化剂 | B. 作还原剂 作还原剂 | C. 为中间产物 为中间产物 | D.主要生成物为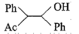 |
您最近一年使用:0次
2022-01-22更新
|
987次组卷
|
3卷引用:广东省茂名市2022届高三第一次综合测试(一模)化学试题
广东省茂名市2022届高三第一次综合测试(一模)化学试题(已下线)押广东卷化学第18题 化学工艺流程题-备战2022年高考化学临考题号押题(广东卷)福建省厦门第一中学2021-2022学年高一下学期5月月考化学试题
解题方法
4 . 费托合成是以合成气为原料,在催化作用下合成液态烃的工艺流程,是我国煤化工的重点发展方向。催化剂的选择性、高稳定性是研究重点,目前主要以纳米铁系催化剂以及钴系催化剂为主,实验室常以固定床或者搅拌釜作为该反应的研究装置,已知该反应的机理如图所示:

已知2CO(g)+4H2(g) C2H4(g)+2H2O(g)△H=-237kJ/mol反应Ⅰ
C2H4(g)+2H2O(g)△H=-237kJ/mol反应Ⅰ
CO(g)+3H2(g) CH4(g)+H2O(g)△H=-178kJ/mol反应Ⅱ
CH4(g)+H2O(g)△H=-178kJ/mol反应Ⅱ
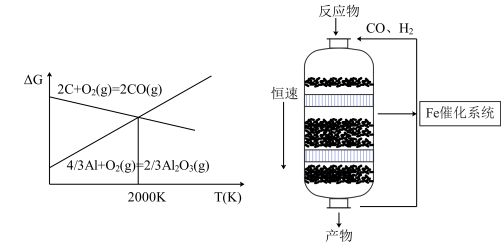
(1)C是一种良好的还原剂,可用来还原各种金属氧化物,如图为C和Al分别和氧气反应的吉布斯自由能变与温度的关系,已知ΔG<0,反应自发,写出C在2000K以上还原Al2O3的化学方程式:__ ,由如图推测2000K以上该反应是反应___ (填“自发”或者“不自发”)。
(2)在固定床反应器中,生产条件为5MPa,200℃~250℃,流速100mL/min,若不考虑其它产物的情况,下列说法错误 的是___ 。
A.采用纳米铁催化剂可以提高催化剂表面积,加快化学反应速率
B.合成气在催化剂表面没有化学键的形成,催化剂改变了化学反应历程
C.固定床反应器中合成气的流速影响产物的转化率和选择性
D.适当升高温度(不考虑催化剂失活)可以提高CO的平衡转化率
E.反应开始前往往先通入H2处理一段时间是为了激活催化剂,去除表面氧化膜
(3)已知固定床反应器中增加装置压强会导致产物中C2H4选择性上升,可能的原因是___ 。
(4)实验中通常也以搅拌釜作为恒容反应容器,在搅拌釜中加入铁系催化剂,再通入10MPa合成气后关闭进气,升温到200℃维持稳定,开启搅拌桨,一直反应到约10~20h后装置内气压不再发生改变(不考虑装置漏气)。在保持其他条件不变的情况下,为了提高C2H4的选择性可以采取的措施是___ 。
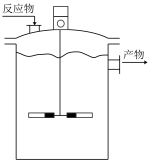
A.适当升高温度 B.改变催化剂 C.适当降低温度 D.加快搅拌速度
(5)搅拌釜反应器中按照投料比 =3:1通入气体,起始压强为8MPa,关闭进气阀,控制反应温度为200℃,反应结束后测得CO的转化率为20%,C2H4的选择性为50%,求该条件下反应Ⅱ的Kp=
=3:1通入气体,起始压强为8MPa,关闭进气阀,控制反应温度为200℃,反应结束后测得CO的转化率为20%,C2H4的选择性为50%,求该条件下反应Ⅱ的Kp=___ (MPa)-2(对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)表示的平衡常数记作Kp)。
(6)某课题小组采用气相色谱研究该反应中C1到C4的各种烃类分布,以N2作为载气(流动相),已知不同气体在同一色谱柱中出峰时间不相同,如图为该产物色谱图中的部分内容,请利用气相色谱设计一种方法判断哪一个峰是乙烯___ 。



已知2CO(g)+4H2(g)
 C2H4(g)+2H2O(g)△H=-237kJ/mol反应Ⅰ
C2H4(g)+2H2O(g)△H=-237kJ/mol反应ⅠCO(g)+3H2(g)
 CH4(g)+H2O(g)△H=-178kJ/mol反应Ⅱ
CH4(g)+H2O(g)△H=-178kJ/mol反应Ⅱ(1)C是一种良好的还原剂,可用来还原各种金属氧化物,如图为C和Al分别和氧气反应的吉布斯自由能变与温度的关系,已知ΔG<0,反应自发,写出C在2000K以上还原Al2O3的化学方程式:

(2)在固定床反应器中,生产条件为5MPa,200℃~250℃,流速100mL/min,若不考虑其它产物的情况,下列说法
A.采用纳米铁催化剂可以提高催化剂表面积,加快化学反应速率
B.合成气在催化剂表面没有化学键的形成,催化剂改变了化学反应历程
C.固定床反应器中合成气的流速影响产物的转化率和选择性
D.适当升高温度(不考虑催化剂失活)可以提高CO的平衡转化率
E.反应开始前往往先通入H2处理一段时间是为了激活催化剂,去除表面氧化膜
(3)已知固定床反应器中增加装置压强会导致产物中C2H4选择性上升,可能的原因是
(4)实验中通常也以搅拌釜作为恒容反应容器,在搅拌釜中加入铁系催化剂,再通入10MPa合成气后关闭进气,升温到200℃维持稳定,开启搅拌桨,一直反应到约10~20h后装置内气压不再发生改变(不考虑装置漏气)。在保持其他条件不变的情况下,为了提高C2H4的选择性可以采取的措施是

A.适当升高温度 B.改变催化剂 C.适当降低温度 D.加快搅拌速度
(5)搅拌釜反应器中按照投料比
 =3:1通入气体,起始压强为8MPa,关闭进气阀,控制反应温度为200℃,反应结束后测得CO的转化率为20%,C2H4的选择性为50%,求该条件下反应Ⅱ的Kp=
=3:1通入气体,起始压强为8MPa,关闭进气阀,控制反应温度为200℃,反应结束后测得CO的转化率为20%,C2H4的选择性为50%,求该条件下反应Ⅱ的Kp=(6)某课题小组采用气相色谱研究该反应中C1到C4的各种烃类分布,以N2作为载气(流动相),已知不同气体在同一色谱柱中出峰时间不相同,如图为该产物色谱图中的部分内容,请利用气相色谱设计一种方法判断哪一个峰是乙烯


您最近一年使用:0次
5 . 环戊二烯是一种重要的有机合成原料,用其制备环戊烯涉及的反应如下:
(1)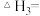
______ (用含“ ”和“
”和“ ”的式子表示),该反应在
”的式子表示),该反应在______ (填“高温”或“低温”)条件下能自发进行。
(2)下列操作中,能提高环戊二烯平衡转化率的是______ (填标号)。
A.增加环戊二烯的用量 B.恒温恒压下通入惰性气体 C.移除环戊烯
(3)保持其他条件不变,在相同时间内,环戊二烯转化率及环戊烯、环戊烷的选择性与温度的关系如下图所示:______ (填标号)。
A.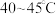 B.
B. C.
C.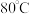 左右
左右
②随着温度的升高,环戊二烯转化率升高而环戊烯选择性降低,其原因是______ 。
(4)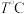 ,向恒容密闭容器中加入
,向恒容密闭容器中加入 环戊二烯
环戊二烯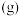 和
和
 ,反应达到平衡时,环戊二烯的转化率为
,反应达到平衡时,环戊二烯的转化率为 ,环戊烷物质的量为
,环戊烷物质的量为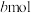 ,则用气体物质的量分数
,则用气体物质的量分数 表示的主反应的平衡常数
表示的主反应的平衡常数
______ (用含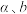 的计算式表示)。
的计算式表示)。
(5)用环戊二烯制备的二茂铁 可用作火箭燃料添加剂、汽油抗爆剂、橡胶熟化剂、紫外线吸收剂等。二茂铁的晶胞结构如图所示(未画出微粒),密度为
可用作火箭燃料添加剂、汽油抗爆剂、橡胶熟化剂、紫外线吸收剂等。二茂铁的晶胞结构如图所示(未画出微粒),密度为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则一个晶胞中含
,则一个晶胞中含 的数目为
的数目为______ 。
主反应: ;
;
副反应1: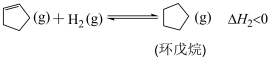 。
。
副反应2:
(1)
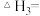
 ”和“
”和“ ”的式子表示),该反应在
”的式子表示),该反应在(2)下列操作中,能提高环戊二烯平衡转化率的是
A.增加环戊二烯的用量 B.恒温恒压下通入惰性气体 C.移除环戊烯
(3)保持其他条件不变,在相同时间内,环戊二烯转化率及环戊烯、环戊烷的选择性与温度的关系如下图所示:
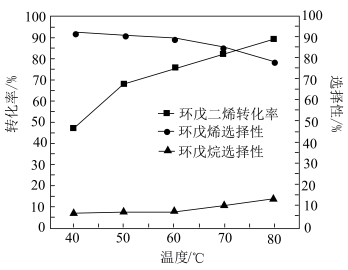
A.
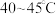 B.
B.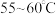 C.
C.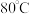 左右
左右②随着温度的升高,环戊二烯转化率升高而环戊烯选择性降低,其原因是
(4)
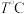 ,向恒容密闭容器中加入
,向恒容密闭容器中加入 环戊二烯
环戊二烯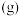 和
和
 ,反应达到平衡时,环戊二烯的转化率为
,反应达到平衡时,环戊二烯的转化率为 ,环戊烷物质的量为
,环戊烷物质的量为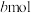 ,则用气体物质的量分数
,则用气体物质的量分数 表示的主反应的平衡常数
表示的主反应的平衡常数
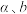 的计算式表示)。
的计算式表示)。(5)用环戊二烯制备的二茂铁
 可用作火箭燃料添加剂、汽油抗爆剂、橡胶熟化剂、紫外线吸收剂等。二茂铁的晶胞结构如图所示(未画出微粒),密度为
可用作火箭燃料添加剂、汽油抗爆剂、橡胶熟化剂、紫外线吸收剂等。二茂铁的晶胞结构如图所示(未画出微粒),密度为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则一个晶胞中含
,则一个晶胞中含 的数目为
的数目为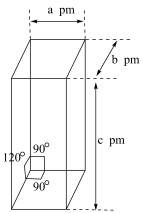
您最近一年使用:0次
名校
解题方法
6 . 尿素是一种很好用的保湿成分,它存在于肌肤的角质层当中,属于肌肤天然保湿因子NMF的主要成分。工业上以氨气和二氧化碳为原料合成尿素,反应分为如下两步:
反应①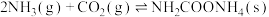
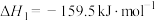
反应②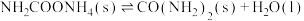

(1)下列反应与反应②的热效应相同的是___________。
(2)下图能表示上述两步反应能量变化的是___________。
(3)恒温恒容时,将2mol 和1mol
和1mol  充入2L反应器中合成尿素,经10min测得反应器内气体压强变为起始的80%(已知此时尿素为固态。水为液态),则从反应开始至10min时,
充入2L反应器中合成尿素,经10min测得反应器内气体压强变为起始的80%(已知此时尿素为固态。水为液态),则从反应开始至10min时, 的平均反应速率
的平均反应速率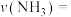
___________ (写出计算过程)。
(4)若将2mol 和1mol
和1mol  充入一容积可变的容器中进行,初始体积固定为V,10min后达到平衡时,
充入一容积可变的容器中进行,初始体积固定为V,10min后达到平衡时, 随时间变化如图所示:
随时间变化如图所示:
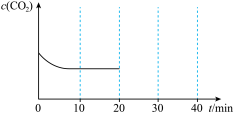
20min时压缩容器,使体积变为0.5V并保持不变,30min时达到新平衡,请在图中大致画出20min~40min内 随时间t变化的曲线
随时间t变化的曲线___________ 。
(5)实际生产中,为节约成本并提高反应②的生产效率,尿素合成工厂通常将反应②的发生场所设置在反应①的发生场所附近,请说明理由:___________ 。
反应①
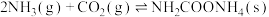
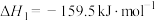
反应②
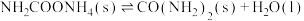

(1)下列反应与反应②的热效应相同的是___________。
| A.木炭与高温水蒸气反应 | B.镁条与稀盐酸反应 |
| C.小苏打与柠檬酸钠反应 | D.氢气与氯气反应 |
(2)下图能表示上述两步反应能量变化的是___________。
A.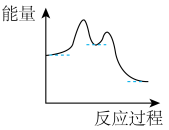 | B.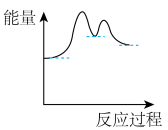 | C. | D.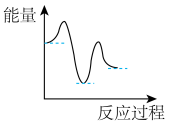 |
(3)恒温恒容时,将2mol
 和1mol
和1mol  充入2L反应器中合成尿素,经10min测得反应器内气体压强变为起始的80%(已知此时尿素为固态。水为液态),则从反应开始至10min时,
充入2L反应器中合成尿素,经10min测得反应器内气体压强变为起始的80%(已知此时尿素为固态。水为液态),则从反应开始至10min时, 的平均反应速率
的平均反应速率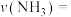
(4)若将2mol
 和1mol
和1mol  充入一容积可变的容器中进行,初始体积固定为V,10min后达到平衡时,
充入一容积可变的容器中进行,初始体积固定为V,10min后达到平衡时, 随时间变化如图所示:
随时间变化如图所示:
20min时压缩容器,使体积变为0.5V并保持不变,30min时达到新平衡,请在图中大致画出20min~40min内
 随时间t变化的曲线
随时间t变化的曲线(5)实际生产中,为节约成本并提高反应②的生产效率,尿素合成工厂通常将反应②的发生场所设置在反应①的发生场所附近,请说明理由:
您最近一年使用:0次
解题方法
7 . 固体燃料是目前我国合成氨生产的主要原料,随着煤气化技术的进步,多煤种均可作为合成氨的原料。以煤为原料的合成氨生产流程由三个基本部分组成:
(1)原料气的制备过程中主要发生反应:
I.
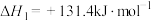
Ⅱ.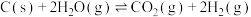
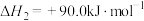
图1为碳与水蒸气反应的平衡常数与温度的关系图,图2表示了氧煤比对气化过程的影响,氧煤比的大小是影响气化炉温度、碳转化率、煤中有效气体(CO+H2)含量高低的重要因素。
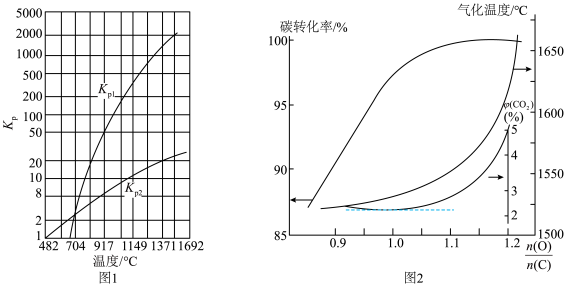
①由图1可知,高温有利于提高___________ 和___________ 的含量。
②试分析原料气制备过程中通入O2的原因:___________ ;由图可知,合适的氧煤比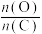 应保证在
应保证在___________ 左右。
(2)原料气的净化过程中,脱碳工序须将CO2去除。N-甲基二乙醇胺(简称MDEA,分子式可简写为R2CH3N)水溶液因其选择性高、溶剂消耗少、对设备腐蚀小、可再生等优点被广泛使用。MDEA吸收CO2的反应可表示为: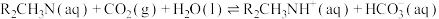
①脱碳工序可防止CO2在低温下固化变为干冰,堵塞设备和管道,还可防止___________ 。
②从结构角度分析MDEA具有碱性的原因:___________ 。
③标准平衡常数 可以表示平衡时各物质的浓度关系:如反应
可以表示平衡时各物质的浓度关系:如反应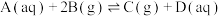 的
的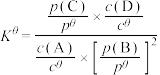 ,其中
,其中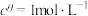 ,
,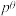 为标准大气压,
为标准大气压, 、
、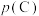 分别为气体的分压,分压=气体物质的量分数×总压。在T℃时的刚性密闭容器中,用20L2.3mol/L的MDEA溶液吸收总压为
分别为气体的分压,分压=气体物质的量分数×总压。在T℃时的刚性密闭容器中,用20L2.3mol/L的MDEA溶液吸收总压为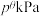 的合成氨原料气(含体积分数分别为30%的N2、55%的H2、15%的CO2),充分吸收后,MDEA浓度降低为2.0mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数
的合成氨原料气(含体积分数分别为30%的N2、55%的H2、15%的CO2),充分吸收后,MDEA浓度降低为2.0mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数
___________ (保留2位有效数字)。
(3)影响合成氨工艺条件的主要因素是空间速度(单位时间内通过单位体积催化剂的气量,简称空速)、反应温度、合成压力和气体组成等。目前30MPa的中压法合成塔,空速一般为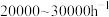 ,原因是
,原因是___________ 。
| 原料气的制备 | → | 原料气的净化 | → | 气体的压缩与氨的合成 |
(1)原料气的制备过程中主要发生反应:
I.

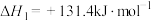
Ⅱ.
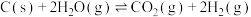
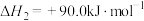
图1为碳与水蒸气反应的平衡常数与温度的关系图,图2表示了氧煤比对气化过程的影响,氧煤比的大小是影响气化炉温度、碳转化率、煤中有效气体(CO+H2)含量高低的重要因素。

①由图1可知,高温有利于提高
②试分析原料气制备过程中通入O2的原因:
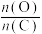 应保证在
应保证在(2)原料气的净化过程中,脱碳工序须将CO2去除。N-甲基二乙醇胺(简称MDEA,分子式可简写为R2CH3N)水溶液因其选择性高、溶剂消耗少、对设备腐蚀小、可再生等优点被广泛使用。MDEA吸收CO2的反应可表示为:
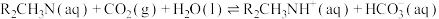
①脱碳工序可防止CO2在低温下固化变为干冰,堵塞设备和管道,还可防止
②从结构角度分析MDEA具有碱性的原因:
③标准平衡常数
 可以表示平衡时各物质的浓度关系:如反应
可以表示平衡时各物质的浓度关系:如反应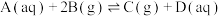 的
的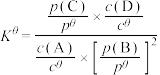 ,其中
,其中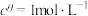 ,
,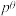 为标准大气压,
为标准大气压, 、
、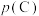 分别为气体的分压,分压=气体物质的量分数×总压。在T℃时的刚性密闭容器中,用20L2.3mol/L的MDEA溶液吸收总压为
分别为气体的分压,分压=气体物质的量分数×总压。在T℃时的刚性密闭容器中,用20L2.3mol/L的MDEA溶液吸收总压为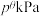 的合成氨原料气(含体积分数分别为30%的N2、55%的H2、15%的CO2),充分吸收后,MDEA浓度降低为2.0mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数
的合成氨原料气(含体积分数分别为30%的N2、55%的H2、15%的CO2),充分吸收后,MDEA浓度降低为2.0mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数
(3)影响合成氨工艺条件的主要因素是空间速度(单位时间内通过单位体积催化剂的气量,简称空速)、反应温度、合成压力和气体组成等。目前30MPa的中压法合成塔,空速一般为
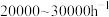 ,原因是
,原因是
您最近一年使用:0次
解题方法
8 . 常温下 是一种无色气体,能溶于浓硫酸、易水解,是有机合成和石油化工广泛应用的一种重要催化剂。工业上以铁硼矿(主要成分有
是一种无色气体,能溶于浓硫酸、易水解,是有机合成和石油化工广泛应用的一种重要催化剂。工业上以铁硼矿(主要成分有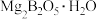 、
、 ,次要成分有
,次要成分有 、
、 、
、 、
、 )和萤石(主要成分为
)和萤石(主要成分为 ,含微量二氧化硅、硫单质)为原料制备
,含微量二氧化硅、硫单质)为原料制备 的流程如图所示:
的流程如图所示:

已知:① 溶液在“热溶浸”中,只能溶解
溶液在“热溶浸”中,只能溶解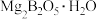 ;
;
②室温下,溶液 时,
时, 的溶解度为
的溶解度为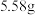 ;
;
③相关金属离子形成氢氧化物沉淀的 范围如下表所示:
范围如下表所示:
回答下列问题:
(1)产生的气体A是______ ;“热溶浸”时,下列措施能提高硼元素浸出率的有______ (填序号)。
a.粉碎矿石 b.适当升高“热溶浸”温度
c.适当缩短“热溶浸”时间 d.加快搅拌速度
(2)已知硼酸在水中的电离方程式为 。室温下,调节过滤1所得滤液的
。室温下,调节过滤1所得滤液的 值为4,析出硼酸固体,则滤液2中
值为4,析出硼酸固体,则滤液2中
_________  。
。
(3)补充完整反应釜中发生主要反应的化学方程式:①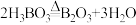 ;②
;②___________ ;过量浓硫酸的作用是___________ (答出2点)。
(4)根据下表,选择反应釜中的最佳反应条件:温度为________ ,硫酸质量分数为________ 。
不同反应条件对 产率的影响
产率的影响
(5)利用离子色谱法可以检测过滤3所得滤液中硫元素的含量,将样品通过检测液,进行色谱分析,得到如图所示结果,出现检测峰1的原因可能是___________ 。

(6)滤渣1通过下图所示操作可逐一分离硅、铝、铁三种元素,试剂①是___________ (填化学式),调节 的范围是
的范围是___________ 。

 是一种无色气体,能溶于浓硫酸、易水解,是有机合成和石油化工广泛应用的一种重要催化剂。工业上以铁硼矿(主要成分有
是一种无色气体,能溶于浓硫酸、易水解,是有机合成和石油化工广泛应用的一种重要催化剂。工业上以铁硼矿(主要成分有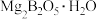 、
、 ,次要成分有
,次要成分有 、
、 、
、 、
、 )和萤石(主要成分为
)和萤石(主要成分为 ,含微量二氧化硅、硫单质)为原料制备
,含微量二氧化硅、硫单质)为原料制备 的流程如图所示:
的流程如图所示:
已知:①
 溶液在“热溶浸”中,只能溶解
溶液在“热溶浸”中,只能溶解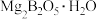 ;
;②室温下,溶液
 时,
时, 的溶解度为
的溶解度为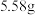 ;
;③相关金属离子形成氢氧化物沉淀的
 范围如下表所示:
范围如下表所示:| 金属离子 |  |  |  |
开始沉淀的 | 1.5 | 6.3 | 3.2 |
沉淀完全的 | 3.2 | 8.3 | 5.0 |
(1)产生的气体A是
a.粉碎矿石 b.适当升高“热溶浸”温度
c.适当缩短“热溶浸”时间 d.加快搅拌速度
(2)已知硼酸在水中的电离方程式为
 。室温下,调节过滤1所得滤液的
。室温下,调节过滤1所得滤液的 值为4,析出硼酸固体,则滤液2中
值为4,析出硼酸固体,则滤液2中
 。
。(3)补充完整反应釜中发生主要反应的化学方程式:①
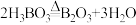 ;②
;②(4)根据下表,选择反应釜中的最佳反应条件:温度为
不同反应条件对
 产率的影响
产率的影响| 反应温度/℃ |  产率/% 产率/% | |
硫酸质量分数 | 硫酸质量分数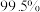 | |
| 60 | 9.5 | 54 |
| 70 | 11 | 62.5 |
| 80 | 37.4 | 78.8 |
| 90 | 47.7 | 82 |
| 100 | 47.1 | 81.4 |
| 110 | 46.5 | 80.5 |
| 120 | 46 | 79 |
(5)利用离子色谱法可以检测过滤3所得滤液中硫元素的含量,将样品通过检测液,进行色谱分析,得到如图所示结果,出现检测峰1的原因可能是

(6)滤渣1通过下图所示操作可逐一分离硅、铝、铁三种元素,试剂①是
 的范围是
的范围是
您最近一年使用:0次
名校
9 . 氨是一种重要的基础化工产品。
(1)合成氨的原料气( 及少量
及少量 的混合气)在进入合成塔前需除去
的混合气)在进入合成塔前需除去 ,原因是
,原因是___________ 。
原料气中的 常用甲烷水蒸气重整反应制备,涉及的主要反应如下:
常用甲烷水蒸气重整反应制备,涉及的主要反应如下:
反应Ⅰ:
反应Ⅱ: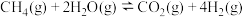
反应Ⅲ:
一定条件下,向体积为V的恒容容器中充入 甲烷和
甲烷和 水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则
水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则 的物质的量为
的物质的量为________  ,写出反应Ⅲ的平衡常数
,写出反应Ⅲ的平衡常数
___________ 。
(2) 与
与 作用分别生成
作用分别生成 的反应均为放热反应。工业尾气中的
的反应均为放热反应。工业尾气中的 可通过催化氧化为
可通过催化氧化为 除去。将一定比例的
除去。将一定比例的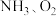 和
和 的混合气体以一定流速经过装有催化剂的反应管,
的混合气体以一定流速经过装有催化剂的反应管, 的转化率、
的转化率、 的选择性[
的选择性[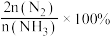 ]与温度的关系如图。
]与温度的关系如图。 范围内升高温度,出口处氮氧化物的量
范围内升高温度,出口处氮氧化物的量________ (填“增大”或“减小), 的平衡转化率
的平衡转化率________ (填“增大”或“减小”)。
②为能更有效除去尾气中的 ,保护环境,应选择的最佳温度为
,保护环境,应选择的最佳温度为________ (填序号)。
A. B.
B. C.
C.
(3)氨气也可与氨的氧化物反应生成氮气,该反应可用于处理氮的氧化物。例如: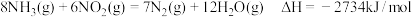 ,将
,将 和
和 以一定的流速,分别通过甲、乙两种催化剂发生上述反应,相同时间内测量逸出气体中
以一定的流速,分别通过甲、乙两种催化剂发生上述反应,相同时间内测量逸出气体中 含量,从而确定
含量,从而确定 的转化率,结果如图所示:
的转化率,结果如图所示:___________ (填“是”或“不是”)平衡状态,原因是___________ 。
(1)合成氨的原料气(
 及少量
及少量 的混合气)在进入合成塔前需除去
的混合气)在进入合成塔前需除去 ,原因是
,原因是原料气中的
 常用甲烷水蒸气重整反应制备,涉及的主要反应如下:
常用甲烷水蒸气重整反应制备,涉及的主要反应如下:反应Ⅰ:

反应Ⅱ:
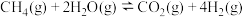
反应Ⅲ:

一定条件下,向体积为V的恒容容器中充入
 甲烷和
甲烷和 水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则
水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则 的物质的量为
的物质的量为 ,写出反应Ⅲ的平衡常数
,写出反应Ⅲ的平衡常数
(2)
 与
与 作用分别生成
作用分别生成 的反应均为放热反应。工业尾气中的
的反应均为放热反应。工业尾气中的 可通过催化氧化为
可通过催化氧化为 除去。将一定比例的
除去。将一定比例的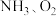 和
和 的混合气体以一定流速经过装有催化剂的反应管,
的混合气体以一定流速经过装有催化剂的反应管, 的转化率、
的转化率、 的选择性[
的选择性[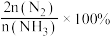 ]与温度的关系如图。
]与温度的关系如图。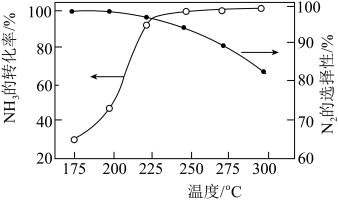
 范围内升高温度,出口处氮氧化物的量
范围内升高温度,出口处氮氧化物的量 的平衡转化率
的平衡转化率②为能更有效除去尾气中的
 ,保护环境,应选择的最佳温度为
,保护环境,应选择的最佳温度为A.
 B.
B. C.
C.
(3)氨气也可与氨的氧化物反应生成氮气,该反应可用于处理氮的氧化物。例如:
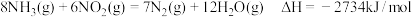 ,将
,将 和
和 以一定的流速,分别通过甲、乙两种催化剂发生上述反应,相同时间内测量逸出气体中
以一定的流速,分别通过甲、乙两种催化剂发生上述反应,相同时间内测量逸出气体中 含量,从而确定
含量,从而确定 的转化率,结果如图所示:
的转化率,结果如图所示: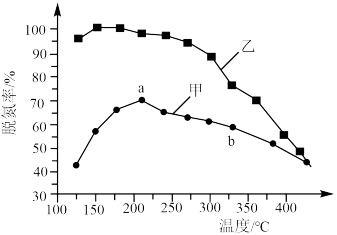
您最近一年使用:0次
2023-10-06更新
|
152次组卷
|
2卷引用:湖北省宜荆荆随2024届高三上学期10月联考化学试题
解题方法
10 . 氟碳铈精矿(主要成分为 )可用于制备铈的氧化物和
)可用于制备铈的氧化物和 。
。

已知: 能与
能与 结合成
结合成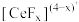 ,也能与
,也能与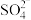 结合成
结合成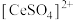 ;
;
(1)氧化焙烧:将氟碳铈精矿置于多膛焙烧炉中进行氧化焙烧,焙烧时把矿料与气体逆向而行进行投料,其目的是___________ 。
(2)酸浸
①酸浸时加入 的目的是提供
的目的是提供___________ (填“氧化剂”或“还原剂”)。
②酸浸时,浸出液中Ce(IV)含量 随盐酸浓度的变化如图所示,盐酸浓度越高,Ce(IV)含量越低的原因是
随盐酸浓度的变化如图所示,盐酸浓度越高,Ce(IV)含量越低的原因是___________ 。

③酸浸时向盐酸中加入少许 ,浸出液中Ce(IV)含量如图所示,Ce(IV)含量随硫酸添加量增大而增大的原因是
,浸出液中Ce(IV)含量如图所示,Ce(IV)含量随硫酸添加量增大而增大的原因是___________ 。

(3)反应:若把 改为氢氧化钠溶液,则反应会生成氢氧化亚铈(III)沉淀,暴露在空气中会变成黄色的氢氧化铈(IV)沉淀,生成氢氧化铈的化学方程式为
改为氢氧化钠溶液,则反应会生成氢氧化亚铈(III)沉淀,暴露在空气中会变成黄色的氢氧化铈(IV)沉淀,生成氢氧化铈的化学方程式为___________ 。
(4)CeO2的制备:以 为原料也可制取CeO2,根据题中所给信息,补充完整实验方案:将一定量的
为原料也可制取CeO2,根据题中所给信息,补充完整实验方案:将一定量的 溶于
溶于 去离子水中,
去离子水中,___________ ,得CeO2固体。
已知: 受热分解时失重率随温度的变化如图所示,实验中须使用的仪器和试剂:
受热分解时失重率随温度的变化如图所示,实验中须使用的仪器和试剂: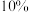 氨水、
氨水、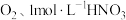 、
、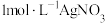 溶液、马弗炉(可用于固体的高温加热)。
溶液、马弗炉(可用于固体的高温加热)。

 )可用于制备铈的氧化物和
)可用于制备铈的氧化物和 。
。
已知:
 能与
能与 结合成
结合成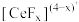 ,也能与
,也能与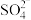 结合成
结合成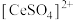 ;
;(1)氧化焙烧:将氟碳铈精矿置于多膛焙烧炉中进行氧化焙烧,焙烧时把矿料与气体逆向而行进行投料,其目的是
(2)酸浸
①酸浸时加入
 的目的是提供
的目的是提供②酸浸时,浸出液中Ce(IV)含量
 随盐酸浓度的变化如图所示,盐酸浓度越高,Ce(IV)含量越低的原因是
随盐酸浓度的变化如图所示,盐酸浓度越高,Ce(IV)含量越低的原因是
③酸浸时向盐酸中加入少许
 ,浸出液中Ce(IV)含量如图所示,Ce(IV)含量随硫酸添加量增大而增大的原因是
,浸出液中Ce(IV)含量如图所示,Ce(IV)含量随硫酸添加量增大而增大的原因是
(3)反应:若把
 改为氢氧化钠溶液,则反应会生成氢氧化亚铈(III)沉淀,暴露在空气中会变成黄色的氢氧化铈(IV)沉淀,生成氢氧化铈的化学方程式为
改为氢氧化钠溶液,则反应会生成氢氧化亚铈(III)沉淀,暴露在空气中会变成黄色的氢氧化铈(IV)沉淀,生成氢氧化铈的化学方程式为(4)CeO2的制备:以
 为原料也可制取CeO2,根据题中所给信息,补充完整实验方案:将一定量的
为原料也可制取CeO2,根据题中所给信息,补充完整实验方案:将一定量的 溶于
溶于 去离子水中,
去离子水中,已知:
 受热分解时失重率随温度的变化如图所示,实验中须使用的仪器和试剂:
受热分解时失重率随温度的变化如图所示,实验中须使用的仪器和试剂: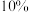 氨水、
氨水、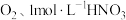 、
、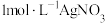 溶液、马弗炉(可用于固体的高温加热)。
溶液、马弗炉(可用于固体的高温加热)。
您最近一年使用:0次



