名校
1 . 氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
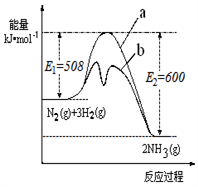
(1)根据下图提供的信息,写出该反应的热化学方程式
_____________________________________________ ,
下图的曲线中____________ (填“a” 或“b”)表示 加入铁触媒(催化剂)的能量变化曲线。
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是_________________ 。
A.3υ(H2)正=2υ(NH3)逆
B.单位时间内生成n mol N2的同时生成2n molNH3
C.容器内气体的密度不随时间的变化而变化
D.容器内压强不随时间的变化而变化
(3)为了寻找合成NH3的适宜条件,某同学设计了三组实验(如下表),请在下表空格处填入相应的实验条件及数据。
(4)合成氨的原料气氢气制备时其中一步反应: H2O(g)+CO(g) CO2(g)+H2(g),在850 ℃时,其平衡常数K=1。若850 ℃时向体积为1 L的恒容密闭容器中,同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2,5.0 mol H2,此时反应向
CO2(g)+H2(g),在850 ℃时,其平衡常数K=1。若850 ℃时向体积为1 L的恒容密闭容器中,同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2,5.0 mol H2,此时反应向____________ (填“正反应”或“逆反应”)方向进行,平衡时CO2的物质的量为______________ 。
(1)根据下图提供的信息,写出该反应的热化学方程式
下图的曲线中

(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是
A.3υ(H2)正=2υ(NH3)逆
B.单位时间内生成n mol N2的同时生成2n molNH3
C.容器内气体的密度不随时间的变化而变化
D.容器内压强不随时间的变化而变化
(3)为了寻找合成NH3的适宜条件,某同学设计了三组实验(如下表),请在下表空格处填入相应的实验条件及数据。
实验编号 | T(℃) | n (N2)/n(H2) | P(MPa) |
ⅰ | 450 | 1/3 | 1 |
ⅱ | 1/3 | 10 | |
ⅲ | 480 | 10 |
(4)合成氨的原料气氢气制备时其中一步反应: H2O(g)+CO(g)
 CO2(g)+H2(g),在850 ℃时,其平衡常数K=1。若850 ℃时向体积为1 L的恒容密闭容器中,同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2,5.0 mol H2,此时反应向
CO2(g)+H2(g),在850 ℃时,其平衡常数K=1。若850 ℃时向体积为1 L的恒容密闭容器中,同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2,5.0 mol H2,此时反应向
您最近一年使用:0次
2 . 20世纪初,德国化学家哈伯首次利用氨气和氢气合成了氨气N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ·mol-1,以氨气为原料可制得各种氮肥,大大提高了粮食产量。下列有关合成氨反应说法正确的是
2NH3(g) ΔH=-92.4kJ·mol-1,以氨气为原料可制得各种氮肥,大大提高了粮食产量。下列有关合成氨反应说法正确的是
 2NH3(g) ΔH=-92.4kJ·mol-1,以氨气为原料可制得各种氮肥,大大提高了粮食产量。下列有关合成氨反应说法正确的是
2NH3(g) ΔH=-92.4kJ·mol-1,以氨气为原料可制得各种氮肥,大大提高了粮食产量。下列有关合成氨反应说法正确的是| A.使用催化剂能改变反应途径,提高反应的活化能 |
| B.及时液化分离出氨气,有利于提高反应物的转化率 |
| C.用E总表示物质能量之和,E总(反应物)<E总(生成物) |
| D.向合成塔中充入1molN2和3molH2,充分反应后放出92.4kJ 的热量 |
您最近一年使用:0次
解题方法
3 . 研究CO和 的应用对构建生态文明型社会具有重要意义。
的应用对构建生态文明型社会具有重要意义。
(1)用CO和 为原料可制取甲醇:
为原料可制取甲醇:
 。恒温时,向如图所示的密闭容器中(活栓已经固定住活塞)充入一定量的CO和
。恒温时,向如图所示的密闭容器中(活栓已经固定住活塞)充入一定量的CO和 。
。
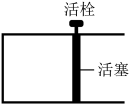
①能够说明反应已经处于平衡状态的是:_________ 。
A.容器内CO的物质的量浓度不变
B.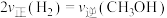
C.容器内气体压强不变
D.混合气体的密度不变
E.容器内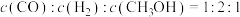
②若其他条件均保持不变,起始时拔去活栓,让活塞自由移动,则平衡时 的体积百分含量将
的体积百分含量将_________ (填“增大”、“减少”或“不变”)
(2)二氧化碳是潜在的碳资源,可以与 合成二甲醚(化学式为
合成二甲醚(化学式为 ),也可以与
),也可以与 直接转化为乙酸。
直接转化为乙酸。
①一种“二甲醚燃料电池”的结构如图所示,以熔融的碳酸钾为电解质,总反应为: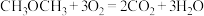 。该电池工作时,负极的电极反应为
。该电池工作时,负极的电极反应为_________ 。

②以二氧化钛表面覆盖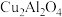 为催化剂,可以将
为催化剂,可以将 和
和 直接转化为乙酸。在不同温度下乙酸的生成速率如图所示。在250~300℃时,温度升高而乙酸的生成速率快速降低,原因可能是:
直接转化为乙酸。在不同温度下乙酸的生成速率如图所示。在250~300℃时,温度升高而乙酸的生成速率快速降低,原因可能是:_________ 。

 的应用对构建生态文明型社会具有重要意义。
的应用对构建生态文明型社会具有重要意义。(1)用CO和
 为原料可制取甲醇:
为原料可制取甲醇:
 。恒温时,向如图所示的密闭容器中(活栓已经固定住活塞)充入一定量的CO和
。恒温时,向如图所示的密闭容器中(活栓已经固定住活塞)充入一定量的CO和 。
。
①能够说明反应已经处于平衡状态的是:
A.容器内CO的物质的量浓度不变
B.
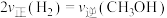
C.容器内气体压强不变
D.混合气体的密度不变
E.容器内
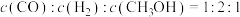
②若其他条件均保持不变,起始时拔去活栓,让活塞自由移动,则平衡时
 的体积百分含量将
的体积百分含量将(2)二氧化碳是潜在的碳资源,可以与
 合成二甲醚(化学式为
合成二甲醚(化学式为 ),也可以与
),也可以与 直接转化为乙酸。
直接转化为乙酸。①一种“二甲醚燃料电池”的结构如图所示,以熔融的碳酸钾为电解质,总反应为:
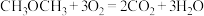 。该电池工作时,负极的电极反应为
。该电池工作时,负极的电极反应为
②以二氧化钛表面覆盖
 为催化剂,可以将
为催化剂,可以将 和
和 直接转化为乙酸。在不同温度下乙酸的生成速率如图所示。在250~300℃时,温度升高而乙酸的生成速率快速降低,原因可能是:
直接转化为乙酸。在不同温度下乙酸的生成速率如图所示。在250~300℃时,温度升高而乙酸的生成速率快速降低,原因可能是:
您最近一年使用:0次
4 . 中国首次实现了利用二氧化碳人工合成淀粉,为全球的“碳达峰”、“碳中和”起到重大的支撑作用。其中最关键的一步是以CO2为原料制CH3OH。在某CO2催化加氢制CH3OH的反应体系中,发生的主要反应有:
I.CO2(g)+H2(g) CO(g)+H2O(g) ΔH1=+41.1kJ·mol-1
CO(g)+H2O(g) ΔH1=+41.1kJ·mol-1
II.CO(g)+2H2(g) CH3OH(g) ΔH2=-90.0kJ·mol-1
CH3OH(g) ΔH2=-90.0kJ·mol-1
(1)CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH=
CH3OH(g)+H2O(g)ΔH=___ 。
(2)5Mpa时,往某密闭容器中按投料比n(H2)∶n(CO2)=3∶1充入H2和CO2。反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图1所示。
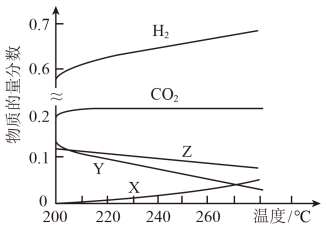
①图中X代表___ 。(填化学式)。
②体系中H2的物质的量分数随温度的增大而升高,试分析原因___ 。
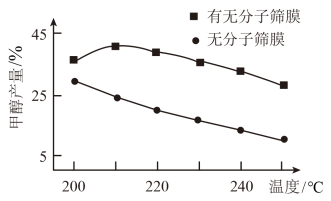
(3)H2和CO2起始物质的量比为3∶1时,该反应在有、无分子筛膜时甲醇的平衡产率随温度的变化如图2所示,其中分子筛膜能选择性分离出H2O。温度低于210℃时,随着温度升高,有分子筛膜的甲醇产率升高的可能原因是___ 。
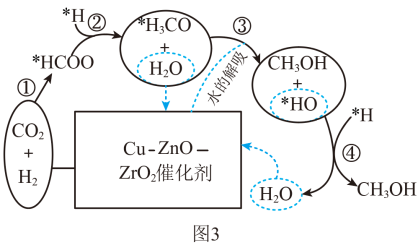
(4)我国科研人员研究出在Cu—ZnO—ZrO2催化剂上CO2氢化合成甲醇的反应历程如图3所示。反应③的化学方程式为___ ;分析在反应气中加入少量的水能够提升甲醇产率的可能原因是___ 。
I.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH1=+41.1kJ·mol-1
CO(g)+H2O(g) ΔH1=+41.1kJ·mol-1II.CO(g)+2H2(g)
 CH3OH(g) ΔH2=-90.0kJ·mol-1
CH3OH(g) ΔH2=-90.0kJ·mol-1(1)CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)ΔH=
CH3OH(g)+H2O(g)ΔH=(2)5Mpa时,往某密闭容器中按投料比n(H2)∶n(CO2)=3∶1充入H2和CO2。反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图1所示。

①图中X代表
②体系中H2的物质的量分数随温度的增大而升高,试分析原因
(3)H2和CO2起始物质的量比为3∶1时,该反应在有、无分子筛膜时甲醇的平衡产率随温度的变化如图2所示,其中分子筛膜能选择性分离出H2O。温度低于210℃时,随着温度升高,有分子筛膜的甲醇产率升高的可能原因是

(4)我国科研人员研究出在Cu—ZnO—ZrO2催化剂上CO2氢化合成甲醇的反应历程如图3所示。反应③的化学方程式为

您最近一年使用:0次
解题方法
5 . 尿素[ ]是目前人类使用量最大的一种氮肥。工业上用氨气和二氧化碳为原料制取尿素。
]是目前人类使用量最大的一种氮肥。工业上用氨气和二氧化碳为原料制取尿素。
(1)合成:氨气加压并预热后与压缩的二氧化碳在合成塔中反应生成尿素。
①氨气加压并预热的作用是___________ 。
②合成尿素的化学方程式是___________ 。该反应属于___________ 反应(填“氧化还原”或“非氧化还原”)。
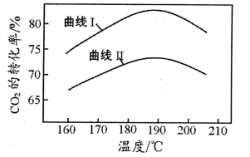
③合成中氨碳比[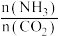 ]分别为3和4时,
]分别为3和4时, 的转化率随温度的变化如图所示。则图中曲线I对应的氨碳比为
的转化率随温度的变化如图所示。则图中曲线I对应的氨碳比为___________ ,反应最适宜温度为___________ 。
(2)分离:尿素水溶液经二段蒸发分离得到尿素。尿素水溶液在加热蒸发过程中会部分水解成碳酸铵或碳酸氢铵。
①尿素熔点132.7℃,沸点196.6℃,尿素晶体属于___________ 晶体。
②尿素水解生成碳酸铵的化学方程式为___________ 。
 ]是目前人类使用量最大的一种氮肥。工业上用氨气和二氧化碳为原料制取尿素。
]是目前人类使用量最大的一种氮肥。工业上用氨气和二氧化碳为原料制取尿素。
(1)合成:氨气加压并预热后与压缩的二氧化碳在合成塔中反应生成尿素。
①氨气加压并预热的作用是
②合成尿素的化学方程式是
③合成中氨碳比[
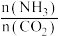 ]分别为3和4时,
]分别为3和4时, 的转化率随温度的变化如图所示。则图中曲线I对应的氨碳比为
的转化率随温度的变化如图所示。则图中曲线I对应的氨碳比为(2)分离:尿素水溶液经二段蒸发分离得到尿素。尿素水溶液在加热蒸发过程中会部分水解成碳酸铵或碳酸氢铵。
①尿素熔点132.7℃,沸点196.6℃,尿素晶体属于
②尿素水解生成碳酸铵的化学方程式为
您最近一年使用:0次
6 . 随着科技的进步,合理利用资源保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g) CH3NH2(g)+H2O(g)ΔH=?已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g)ΔH=?已知该反应中相关化学键的键能数据如下:
则该反应的ΔH=_______ kJ·mol-1。
(2)上述反应中所需的甲醇工业上有多种方法合成。用电解法也可实现CO2加氢制甲醇(稀硫酸作电解质溶液)。电解时,阴极上的电极反应为_______ 。
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,则每生成3molPbI2的反应中,转移电子的物质的量为_______ 。
(4)分解HI曲线和液相法制备HI反应曲线分别如下图1和图2所示:
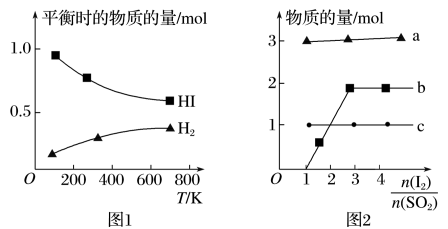
①反应H2(g)+I2(g) 2HI(g)的ΔH
2HI(g)的ΔH_______ 0(填“大于”或“小于”)。
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O=3H++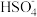 +2I-,I2+I-
+2I-,I2+I-
 ,图2中曲线c代表的微粒是
,图2中曲线c代表的微粒是_______ (填微粒符号),由图2可知,要提高碘的还原率,除控制温度外,还可以采取的措施是_______ 。
(1)制取甲胺的反应为CH3OH(g)+NH3(g)
 CH3NH2(g)+H2O(g)ΔH=?已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g)ΔH=?已知该反应中相关化学键的键能数据如下:共价键 | C-O | H-O | N-H | C-N |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 |
(2)上述反应中所需的甲醇工业上有多种方法合成。用电解法也可实现CO2加氢制甲醇(稀硫酸作电解质溶液)。电解时,阴极上的电极反应为
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,则每生成3molPbI2的反应中,转移电子的物质的量为
(4)分解HI曲线和液相法制备HI反应曲线分别如下图1和图2所示:

①反应H2(g)+I2(g)
 2HI(g)的ΔH
2HI(g)的ΔH②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O=3H++
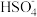 +2I-,I2+I-
+2I-,I2+I-
 ,图2中曲线c代表的微粒是
,图2中曲线c代表的微粒是
您最近一年使用:0次



