18-19高二上·湖北宜昌·期末
名校
1 . 硝酸是一种重要的化工原料,工业上生产硝酸的过程如下:
(1)以氮气、氢气为原料合成氨
①下列措施可以提高H2的转化率是(填选项序号)___________ 。
a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3 d.升高温度
②一定温度下,在密闭容器中充入1molN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,容器内的压强是原来的 15/16,则N2的转化率a1=_____________ ;若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2______ a1(填“>”、“<”或“=”)
(2)以氨气、空气为主要原料制硝酸。在容积恒定的密闭容器中进行反应2NO(g)+O2(g) 2NO2(g) △H>0,该反应的反应速率(v)随时间(t)变化的关系如下图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)
2NO2(g) △H>0,该反应的反应速率(v)随时间(t)变化的关系如下图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)_____________ 。
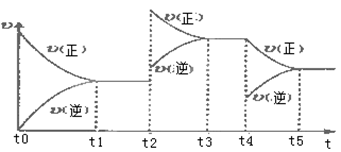
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时值的最大
(3)硝酸工厂用H2将NO2还原为N2
已知:2H2(g)+O2(g)=2H2O(g) △H=-483.5kJ/mol
N2(g)+2O2(g)=2NO2(g) △H=+133kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是___________________
(1)以氮气、氢气为原料合成氨
①下列措施可以提高H2的转化率是(填选项序号)
a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3 d.升高温度
②一定温度下,在密闭容器中充入1molN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,容器内的压强是原来的 15/16,则N2的转化率a1=
(2)以氨气、空气为主要原料制硝酸。在容积恒定的密闭容器中进行反应2NO(g)+O2(g)
 2NO2(g) △H>0,该反应的反应速率(v)随时间(t)变化的关系如下图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)
2NO2(g) △H>0,该反应的反应速率(v)随时间(t)变化的关系如下图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时值的最大
(3)硝酸工厂用H2将NO2还原为N2
已知:2H2(g)+O2(g)=2H2O(g) △H=-483.5kJ/mol
N2(g)+2O2(g)=2NO2(g) △H=+133kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是
您最近一年使用:0次
名校
2 . 以黄铜矿(主要成分二硫化亚铁铜CuFeS2)为原料,用Fe2(SO4)3溶液作浸取剂提取铜,总反应的离子方程式是CuFeS2+4Fe3+ Cu2++5Fe2++2S。
Cu2++5Fe2++2S。
(1)该反应中,Fe3+体现________ 性。
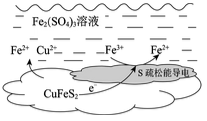
(2)上述总反应的原理如图所示。
负极的电极反应式是________ 。
(3)一定温度下,控制浸取剂pH=1,取三份相同质量黄铜矿粉末分别进行如下实验:
①对比实验I、II,通入空气,Cu2+浸出率提高的原因是________ 。
②由实验III推测,在浸取Cu2+过程中Ag+作催化剂,催化原理是:
ⅰ.CuFeS2+4Ag+=Fe2++Cu2++2Ag2S
ⅱ.Ag2S+2Fe3+=2Ag++2Fe2++S
为证明该催化原理,进行如下实验:
a.取少量黄铜矿粉末,加入少量0.0005mol·L-1Ag2SO4溶液,充分混合后静置。取上层清液,加入稀盐酸,观察到溶液中________ ,证明发生反应i。
b.取少量Ag2S粉末,加入________ 溶液,充分混合后静置。取上层清液,加入稀盐酸,有白色沉淀,证明发生反应ii。
(4)用实验II的浸取液电解提取铜的原理如图所示:
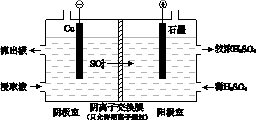
①电解初期,阴极没有铜析出。用电极反应式解释原因是_______________ 。
②将阴极室的流出液送入阳极室,可使浸取剂再生,再生的原理是_____________________ 。
 Cu2++5Fe2++2S。
Cu2++5Fe2++2S。(1)该反应中,Fe3+体现

(2)上述总反应的原理如图所示。
负极的电极反应式是
(3)一定温度下,控制浸取剂pH=1,取三份相同质量黄铜矿粉末分别进行如下实验:
| 实验 | 操作 | 2小时后Cu2+浸出率/% |
| I | 加入足量0.10mol·L-1Fe2(SO4)3溶液 | 78.2 |
| II | 加入足量0.10mol·L-1Fe2(SO4)3溶液,通入空气 | 90.8 |
| III | 加入足量0.10mol·L-1Fe2(SO4)3溶液,再加入少量0.0005mol·L-1Ag2SO4溶液 | 98.0 |
②由实验III推测,在浸取Cu2+过程中Ag+作催化剂,催化原理是:
ⅰ.CuFeS2+4Ag+=Fe2++Cu2++2Ag2S
ⅱ.Ag2S+2Fe3+=2Ag++2Fe2++S
为证明该催化原理,进行如下实验:
a.取少量黄铜矿粉末,加入少量0.0005mol·L-1Ag2SO4溶液,充分混合后静置。取上层清液,加入稀盐酸,观察到溶液中
b.取少量Ag2S粉末,加入
(4)用实验II的浸取液电解提取铜的原理如图所示:

①电解初期,阴极没有铜析出。用电极反应式解释原因是
②将阴极室的流出液送入阳极室,可使浸取剂再生,再生的原理是
您最近一年使用:0次
2017-05-20更新
|
348次组卷
|
5卷引用:湖北省宜昌市第一中学2018届高三年级适应性训练(二)理综化学试题
湖北省宜昌市第一中学2018届高三年级适应性训练(二)理综化学试题宁夏六盘山高级中学2017届高三第四次模拟考试理科综合化学试题(已下线)《2020年新高考政策解读与配套资源》模拟试题08-2020年北京新高考化学模拟试题安徽省定远县育才学校2019-2020学年高二下学期期末考试化学试题北京理工大学附属中学2022-2023学年高三上学期12月月考化学试题



