名校
解题方法
1 . 一定条件下,某可逆反应在密闭容器中建立化学平衡,在t1时刻改变某一个条件,建立新的平衡,其v-t图像如下:
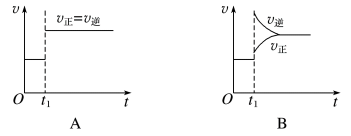
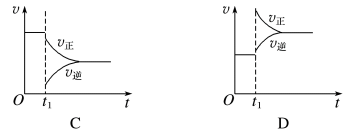
(1)对于反应:2SO2(g)+O2(g)⇌2SO3(g),t1时刻增大压强,其图像为___________ ,平衡___________ (填“向正反应方向”“向逆反应方向”或“不”,下同)移动。
(2)对于反应2NH3(g)⇌N2(g)+3H2(g),t1时刻增大容器体积,其图像为___________ ,平衡___________ 移动。
(3)对于反应N2(g)+3H2(g)⇌2NH3(g) ΔH=-92kJ·mol-1,达到平衡t1时刻其图像为B,则改变的反应条件是___________
(4)对于反应H2(g)+I2(g)⇌2HI(g),t1时刻缩小容器体积,其图像为___________ ,平衡___________ 移动。


(1)对于反应:2SO2(g)+O2(g)⇌2SO3(g),t1时刻增大压强,其图像为
(2)对于反应2NH3(g)⇌N2(g)+3H2(g),t1时刻增大容器体积,其图像为
(3)对于反应N2(g)+3H2(g)⇌2NH3(g) ΔH=-92kJ·mol-1,达到平衡t1时刻其图像为B,则改变的反应条件是
(4)对于反应H2(g)+I2(g)⇌2HI(g),t1时刻缩小容器体积,其图像为
您最近半年使用:0次
名校
2 . 定条件下,发生反应A(g)+B(g) C(g) △H>0,达到平衡后根据下列图像判断:
C(g) △H>0,达到平衡后根据下列图像判断:
A.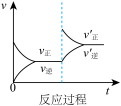 B.
B.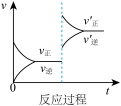 C.
C. D.
D.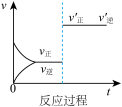 E.
E.
(1)表示升高温度,达到新平衡的是图______ (填“A”、“B”、“C”、“D”或“E”,下同),新平衡中C的质量分数______ (填“增大”、“减小”或“不变”,下同)。
(2)表示降低压强,达到新平衡的是图______ ,A的转化率______ 。
(3)表示减少C的浓度,达到新平衡的是图______ ,表示使用催化剂,达新平衡的是图。
(4)增加A的浓度,达到新平衡的是图______ ,达到平衡后A的转化率______ 。
 C(g) △H>0,达到平衡后根据下列图像判断:
C(g) △H>0,达到平衡后根据下列图像判断:A.
 B.
B. C.
C. D.
D. E.
E.
(1)表示升高温度,达到新平衡的是图
(2)表示降低压强,达到新平衡的是图
(3)表示减少C的浓度,达到新平衡的是图
(4)增加A的浓度,达到新平衡的是图
您最近半年使用:0次
2023-04-24更新
|
263次组卷
|
2卷引用:宁夏青铜峡市宁朔中学2023-2024学年高二上学期期中考试化学试题
名校
3 . 以下是关于“外界因素对化学平衡影响的实验研究”的课题,请回答下列问题。
(1)研究的思路与方法。
①研究对象的选择,现有以下可逆反应:A. 2NO2(g) N2O4(g) ΔH<0 B. FeCl3+3KSCN
N2O4(g) ΔH<0 B. FeCl3+3KSCN Fe(SCN)3+3KCl
Fe(SCN)3+3KCl
其中,A适合于研究___ 对平衡的影响,B适合于研究___ 对平衡的影响。(填字母)
a. 浓度 b. 温度 c. 压强
②研究方法:采用控制其他因素不变,改变其中一个因素的方法,进行对比实验。
(2)单一因素对化学平衡影响的实验研究。
①浓度:将FeCl3与KSCN反应后所得的混合液分为四等份,分别加入FeCl3浓溶液、KSCN浓溶液和NaOH固体、KCl固体观察现象。
现象:加入FeCl3浓溶液后的混合溶液红色___ ;加入KSCN浓溶液后的混合溶液红色___ ;加入NaOH固体后,混合溶液红色___ ;加入KCl固体混合溶液红色___ 。
②温度:将密封并相互连通的盛有NO2的两个玻璃球,一个放入热水中,另一个放入冷水中。现象:放入热水中的球内红棕色___ ;放入冷水中的球内红棕色___ 。
(3)综合(2)中研究结果,请总结外界因素对化学平衡的影响规律__ 。
(1)研究的思路与方法。
①研究对象的选择,现有以下可逆反应:A. 2NO2(g)
 N2O4(g) ΔH<0 B. FeCl3+3KSCN
N2O4(g) ΔH<0 B. FeCl3+3KSCN Fe(SCN)3+3KCl
Fe(SCN)3+3KCl其中,A适合于研究
a. 浓度 b. 温度 c. 压强
②研究方法:采用控制其他因素不变,改变其中一个因素的方法,进行对比实验。
(2)单一因素对化学平衡影响的实验研究。
①浓度:将FeCl3与KSCN反应后所得的混合液分为四等份,分别加入FeCl3浓溶液、KSCN浓溶液和NaOH固体、KCl固体观察现象。
现象:加入FeCl3浓溶液后的混合溶液红色
②温度:将密封并相互连通的盛有NO2的两个玻璃球,一个放入热水中,另一个放入冷水中。现象:放入热水中的球内红棕色
(3)综合(2)中研究结果,请总结外界因素对化学平衡的影响规律
您最近半年使用:0次
名校
4 . (1)对于下列反应:2SO2 + O2 2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为
2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为___________ ,用O2浓度变化来表示的反应速率为___________ 。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为___________ 。
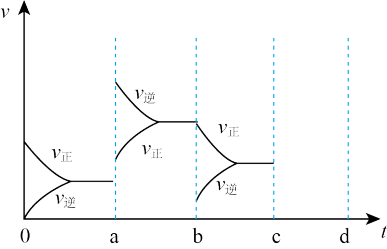
(2)如图表示在密闭容器中反应:2SO2+O2 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是__________ ;b c过程中改变的条件可能是__________ ;若增大压强时,反应速度变化情况画在cd处__________ 。
 2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为
2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为(2)如图表示在密闭容器中反应:2SO2+O2
 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是
您最近半年使用:0次
2020-12-10更新
|
123次组卷
|
8卷引用:宁夏育才中学2017-2018学年高二9月月考化学试题
名校
5 . (1)K2Cr2O7是橙红色晶体,K2CrO4是黄色晶体,若将K2Cr2O7配成一定浓度的溶液,当达到平衡时,溶液的颜色在橙色和黄色之间,试回答:
①写出有关的离子方程式____ 。
②向盛有2mL的上述K2Cr2O7溶液的试管中滴入10滴2mol·L-1的NaOH溶液,试管中溶液呈___ 色。
③向已加入NaOH溶液的②溶液中再加入过量稀H2SO4,则溶液呈___ 色。
④向原溶液中逐渐加入足量Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡____ (填“向左移动”或“向右移动”),溶液颜色将___ 。
(2)现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
①升高温度时,平衡向___ 反应方向移动,正反应为____ (填“吸热”或“放热”)反应,平衡时B、C的浓度之比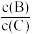 将
将____ 。(填“增大”“减小”或“不变”,下同)。
②减小压强时平衡向___ 反应方向移动, A的质量分数___ ,且m+n__ p(填“>”或“<”)。
③若容积不变加入B,则B的转化率____ ,A的转化率____ 。
④若加入催化剂,平衡时气体混合物的总物质的量____ 。
⑤恒温恒容时,通入氦气,A的质量分数____ 。
①写出有关的离子方程式
②向盛有2mL的上述K2Cr2O7溶液的试管中滴入10滴2mol·L-1的NaOH溶液,试管中溶液呈
③向已加入NaOH溶液的②溶液中再加入过量稀H2SO4,则溶液呈
④向原溶液中逐渐加入足量Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡
(2)现有反应:mA(g)+nB(g)
 pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:①升高温度时,平衡向
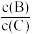 将
将②减小压强时平衡向
③若容积不变加入B,则B的转化率
④若加入催化剂,平衡时气体混合物的总物质的量
⑤恒温恒容时,通入氦气,A的质量分数
您最近半年使用:0次
2019-10-21更新
|
93次组卷
|
2卷引用:宁夏长庆高级中学2019-2020学年高二上学期第一次月考化学试题
名校
6 . (NH4)2Cr2O7用于有机合成催化剂,媒染剂,显影液等。某化学兴趣小组对(NH4)2Cr2O7的部分性质及组成进行探究。已知:Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+。回答下列问题:
2CrO42-(黄色)+2H+。回答下列问题:
(1)在试管中加入少量(NH4)2Cr2O7固体,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是固体溶解、__________ 、__________ 。
(2)为探究(NH4)2Cr2O7 (摩尔质量252g/mol)的分解产物,按下图连接好装置,在A中加入5.040g样品进行实验。
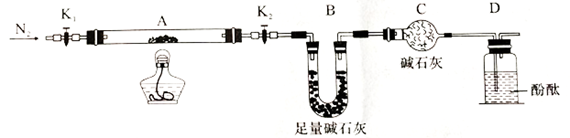
①仪器B的名称是__________ 。
②加热A至恒重,观察到D中溶液不变色,同时测得A、B中质量变化分别为2.00g、1.44g,写出重铬酸铵加热分解反应的化学方程式____________________ 。
③C的作用是__________ 。
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数,其反应原理为:2Ba2++Cr2O72-+H2O=2BaCrO4↓+2H+、 4NH4++6HCHO =3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],然后用NaOH标准溶液滴定反应生成的酸。
实验步骤:称取样品2.800g,配成250mL溶液,移取25.00mL样品溶液于250mL锥形瓶中,用氯化钡溶液使Cr2O72-完全沉淀后,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用0.200 mol·L-1 NaOH标准溶液滴定至终点。重复上述操作3次。
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则滴定时用去NaOH标准溶液的体积__________ (填“偏大”、“偏小”或“无影响”);滴定时边滴边摇动锥形瓶,眼睛应观察__________ 。
②滴定结果如下表所示

该样品中氮的质量分数为__________ 。
 2CrO42-(黄色)+2H+。回答下列问题:
2CrO42-(黄色)+2H+。回答下列问题:(1)在试管中加入少量(NH4)2Cr2O7固体,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是固体溶解、
(2)为探究(NH4)2Cr2O7 (摩尔质量252g/mol)的分解产物,按下图连接好装置,在A中加入5.040g样品进行实验。

①仪器B的名称是
②加热A至恒重,观察到D中溶液不变色,同时测得A、B中质量变化分别为2.00g、1.44g,写出重铬酸铵加热分解反应的化学方程式
③C的作用是
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数,其反应原理为:2Ba2++Cr2O72-+H2O=2BaCrO4↓+2H+、 4NH4++6HCHO =3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],然后用NaOH标准溶液滴定反应生成的酸。
实验步骤:称取样品2.800g,配成250mL溶液,移取25.00mL样品溶液于250mL锥形瓶中,用氯化钡溶液使Cr2O72-完全沉淀后,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用0.200 mol·L-1 NaOH标准溶液滴定至终点。重复上述操作3次。
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则滴定时用去NaOH标准溶液的体积
②滴定结果如下表所示

该样品中氮的质量分数为
您最近半年使用:0次
2019-01-13更新
|
828次组卷
|
3卷引用:宁夏回族自治区银川一中2021届高三上学期第一次月考理综化学试题
名校
7 . 以黄铜矿(主要成分二硫化亚铁铜CuFeS2)为原料,用Fe2(SO4)3溶液作浸取剂提取铜,总反应的离子方程式是CuFeS2+4Fe3+ Cu2++5Fe2++2S。
Cu2++5Fe2++2S。
(1)该反应中,Fe3+体现________ 性。
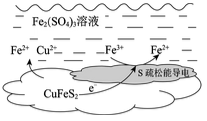
(2)上述总反应的原理如图所示。
负极的电极反应式是________ 。
(3)一定温度下,控制浸取剂pH=1,取三份相同质量黄铜矿粉末分别进行如下实验:
①对比实验I、II,通入空气,Cu2+浸出率提高的原因是________ 。
②由实验III推测,在浸取Cu2+过程中Ag+作催化剂,催化原理是:
ⅰ.CuFeS2+4Ag+=Fe2++Cu2++2Ag2S
ⅱ.Ag2S+2Fe3+=2Ag++2Fe2++S
为证明该催化原理,进行如下实验:
a.取少量黄铜矿粉末,加入少量0.0005mol·L-1Ag2SO4溶液,充分混合后静置。取上层清液,加入稀盐酸,观察到溶液中________ ,证明发生反应i。
b.取少量Ag2S粉末,加入________ 溶液,充分混合后静置。取上层清液,加入稀盐酸,有白色沉淀,证明发生反应ii。
(4)用实验II的浸取液电解提取铜的原理如图所示:
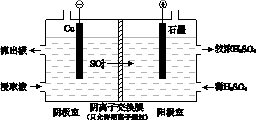
①电解初期,阴极没有铜析出。用电极反应式解释原因是_______________ 。
②将阴极室的流出液送入阳极室,可使浸取剂再生,再生的原理是_____________________ 。
 Cu2++5Fe2++2S。
Cu2++5Fe2++2S。(1)该反应中,Fe3+体现

(2)上述总反应的原理如图所示。
负极的电极反应式是
(3)一定温度下,控制浸取剂pH=1,取三份相同质量黄铜矿粉末分别进行如下实验:
| 实验 | 操作 | 2小时后Cu2+浸出率/% |
| I | 加入足量0.10mol·L-1Fe2(SO4)3溶液 | 78.2 |
| II | 加入足量0.10mol·L-1Fe2(SO4)3溶液,通入空气 | 90.8 |
| III | 加入足量0.10mol·L-1Fe2(SO4)3溶液,再加入少量0.0005mol·L-1Ag2SO4溶液 | 98.0 |
②由实验III推测,在浸取Cu2+过程中Ag+作催化剂,催化原理是:
ⅰ.CuFeS2+4Ag+=Fe2++Cu2++2Ag2S
ⅱ.Ag2S+2Fe3+=2Ag++2Fe2++S
为证明该催化原理,进行如下实验:
a.取少量黄铜矿粉末,加入少量0.0005mol·L-1Ag2SO4溶液,充分混合后静置。取上层清液,加入稀盐酸,观察到溶液中
b.取少量Ag2S粉末,加入
(4)用实验II的浸取液电解提取铜的原理如图所示:

①电解初期,阴极没有铜析出。用电极反应式解释原因是
②将阴极室的流出液送入阳极室,可使浸取剂再生,再生的原理是
您最近半年使用:0次
2017-05-20更新
|
348次组卷
|
5卷引用:宁夏六盘山高级中学2017届高三第四次模拟考试理科综合化学试题
宁夏六盘山高级中学2017届高三第四次模拟考试理科综合化学试题湖北省宜昌市第一中学2018届高三年级适应性训练(二)理综化学试题(已下线)《2020年新高考政策解读与配套资源》模拟试题08-2020年北京新高考化学模拟试题安徽省定远县育才学校2019-2020学年高二下学期期末考试化学试题北京理工大学附属中学2022-2023学年高三上学期12月月考化学试题



