(1)K2Cr2O7是橙红色晶体,K2CrO4是黄色晶体,若将K2Cr2O7配成一定浓度的溶液,当达到平衡时,溶液的颜色在橙色和黄色之间,试回答:
①写出有关的离子方程式____ 。
②向盛有2mL的上述K2Cr2O7溶液的试管中滴入10滴2mol·L-1的NaOH溶液,试管中溶液呈___ 色。
③向已加入NaOH溶液的②溶液中再加入过量稀H2SO4,则溶液呈___ 色。
④向原溶液中逐渐加入足量Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡____ (填“向左移动”或“向右移动”),溶液颜色将___ 。
(2)现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
①升高温度时,平衡向___ 反应方向移动,正反应为____ (填“吸热”或“放热”)反应,平衡时B、C的浓度之比 将
将____ 。(填“增大”“减小”或“不变”,下同)。
②减小压强时平衡向___ 反应方向移动, A的质量分数___ ,且m+n__ p(填“>”或“<”)。
③若容积不变加入B,则B的转化率____ ,A的转化率____ 。
④若加入催化剂,平衡时气体混合物的总物质的量____ 。
⑤恒温恒容时,通入氦气,A的质量分数____ 。
①写出有关的离子方程式
②向盛有2mL的上述K2Cr2O7溶液的试管中滴入10滴2mol·L-1的NaOH溶液,试管中溶液呈
③向已加入NaOH溶液的②溶液中再加入过量稀H2SO4,则溶液呈
④向原溶液中逐渐加入足量Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡
(2)现有反应:mA(g)+nB(g)
 pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:①升高温度时,平衡向
 将
将②减小压强时平衡向
③若容积不变加入B,则B的转化率
④若加入催化剂,平衡时气体混合物的总物质的量
⑤恒温恒容时,通入氦气,A的质量分数
更新时间:2019-10-21 18:37:42
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】在密闭容器中,使2molN2和6molH2混合发生下列反应: N2(g)+3H2(g)=2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时,N2和H2的浓度比是_______ ;N2和H2的转化率比是_________ 。
(2)升高平衡体系的温度(保持体积不变),混和气体的平均相对分子质量_______ ,密度________ 。(填“变大”、“变小”或“不变” )
(3)当达到平衡时,将C(N2)、C(H2)、C(NH3)同时减小一倍,平衡将向______ 移动。
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将向_________ 移动。
(5)若容器恒容,绝热、加热使容器内温度迅速升至原来的2倍,平衡将_______
(填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度_______ (填“大于”“小于”或“等于”)原来的2倍。
(1)当反应达到平衡时,N2和H2的浓度比是
(2)升高平衡体系的温度(保持体积不变),混和气体的平均相对分子质量
(3)当达到平衡时,将C(N2)、C(H2)、C(NH3)同时减小一倍,平衡将向
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将向
(5)若容器恒容,绝热、加热使容器内温度迅速升至原来的2倍,平衡将
(填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4−(绿色)、Cr2O72−(橙红色)、CrO42−(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(2)CrO42−和Cr2O72−在溶液中可相互转化。室温下,初始浓度为1.0 mol·L−1的Na2CrO4溶液中c(Cr2O72−)随c(H+)的变化如图所示。
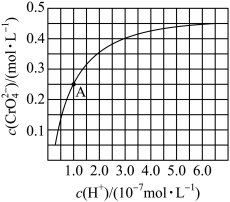
①离子方程式表示Na2CrO4溶液中的转化反应____________ 。
②由图可知,溶液酸性增大,CrO42−的平衡转化率__________ (填“增大“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________ 。
③升高温度,溶液中CrO42−的平衡转化率减小,则该反应的ΔH_________ (填“大于”“小于”或“等于”)。
(2)CrO42−和Cr2O72−在溶液中可相互转化。室温下,初始浓度为1.0 mol·L−1的Na2CrO4溶液中c(Cr2O72−)随c(H+)的变化如图所示。

①离子方程式表示Na2CrO4溶液中的转化反应
②由图可知,溶液酸性增大,CrO42−的平衡转化率
③升高温度,溶液中CrO42−的平衡转化率减小,则该反应的ΔH
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】升高温度,绝大多数的化学反应速率增大,但是2NO(g)+O2(g)=2NO2(g)的化学反应速率却随着温度的升高而减小。科学研究表明,反应2NO(g)+O2(g)=2NO2(g)分为以下两步:
反应Ⅰ:2NO(g) N2O2(g) ΔH1<0 v1正=k1正c2(NO),v1逆=k1逆c(N2O2)
N2O2(g) ΔH1<0 v1正=k1正c2(NO),v1逆=k1逆c(N2O2)
反应Ⅱ:N2O2(g)+O2(g) 2NO2(g) ΔH2<0,v2正=k2正c(N2O2)·c(O2),v2逆=k2逆c2(NO2)
2NO2(g) ΔH2<0,v2正=k2正c(N2O2)·c(O2),v2逆=k2逆c2(NO2)
其反应历程如图1所示

决定2NO(g)+O2(g)=2NO2(g)反应速率的是___________ (填“反应Ⅰ”或“反应Ⅱ”),其理由是___________ ,根据反应速率与浓度的关系式分析,升高温度该反应速率减小的原因是___________
反应Ⅰ:2NO(g)
 N2O2(g) ΔH1<0 v1正=k1正c2(NO),v1逆=k1逆c(N2O2)
N2O2(g) ΔH1<0 v1正=k1正c2(NO),v1逆=k1逆c(N2O2)反应Ⅱ:N2O2(g)+O2(g)
 2NO2(g) ΔH2<0,v2正=k2正c(N2O2)·c(O2),v2逆=k2逆c2(NO2)
2NO2(g) ΔH2<0,v2正=k2正c(N2O2)·c(O2),v2逆=k2逆c2(NO2)其反应历程如图1所示

决定2NO(g)+O2(g)=2NO2(g)反应速率的是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】Ⅰ.在水溶液中橙红色的Cr2O72—与黄色的CrO42—有下列平衡关系:Cr2O72—+H2O 2CrO42—+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液是橙色。
2CrO42—+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液是橙色。
(1)向上述溶液中加入NaOH溶液,溶液呈___________ 色,因为___________ 。
(2)向已加入NaOH溶液的(1)溶液中再加入过量稀H2SO4,则溶液呈___________ 色,因为_______________ 。
Ⅱ.将CoCl2溶于浓盐酸中能形成CoCl42—。溶液中存在如下平衡:CoCl42-(蓝色) + 6H2O Co(H2O)62+(粉红色)+ 4Cl-
Co(H2O)62+(粉红色)+ 4Cl-
(3)一般情况下,CoCl2溶液呈紫色,将盛有CoCl2溶液的试管放在热水中溶液逐渐变成蓝色,则正反应方向为___________ 反应(填“吸热”或“放热”)。
(4)该反应平衡常数表达式为______________________ ,加水稀释平衡向____________ 方向(填“正”或“逆”)移动。
(5)向溶液中加入少量AgNO3固体,溶液颜色变为_______ 色。
 2CrO42—+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液是橙色。
2CrO42—+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液是橙色。(1)向上述溶液中加入NaOH溶液,溶液呈
(2)向已加入NaOH溶液的(1)溶液中再加入过量稀H2SO4,则溶液呈
Ⅱ.将CoCl2溶于浓盐酸中能形成CoCl42—。溶液中存在如下平衡:CoCl42-(蓝色) + 6H2O
 Co(H2O)62+(粉红色)+ 4Cl-
Co(H2O)62+(粉红色)+ 4Cl-(3)一般情况下,CoCl2溶液呈紫色,将盛有CoCl2溶液的试管放在热水中溶液逐渐变成蓝色,则正反应方向为
(4)该反应平衡常数表达式为
(5)向溶液中加入少量AgNO3固体,溶液颜色变为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】合成氨工业与硫酸工业的生产工艺流程大致如图1、2所示。回答下列问题:

(1)合成塔和接触室中的化学反应为_______ 、_____ 。
(2)合成氨中,进入合成塔的气体需要净化,原因是_______ ,将B中出来的 、
、 通入合成塔的目的是
通入合成塔的目的是_______ 。
(3)压强及温度对 转化率的影响如表所示。
转化率的影响如表所示。
工业上,二氧化硫催化氧化过程采用的是常压而不是高压,主要原因是_______ 。分析表数据可知,二氧化硫的催化氧化是放热反应,理由是_______ 。
(4)工业生产中常用氨—酸法进行尾气脱硫,以达到消除污染、废物利用的目的。硫酸工业尾气中的 经处理可以得到一种化肥,该肥料的化学式是
经处理可以得到一种化肥,该肥料的化学式是_______ 。

(1)合成塔和接触室中的化学反应为
(2)合成氨中,进入合成塔的气体需要净化,原因是
 、
、 通入合成塔的目的是
通入合成塔的目的是(3)压强及温度对
 转化率的影响如表所示。
转化率的影响如表所示。温度/ | 不同压强下 的转化率/% 的转化率/% | |||
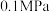 | 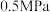 | 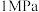 | 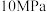 | |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
工业上,二氧化硫催化氧化过程采用的是常压而不是高压,主要原因是
(4)工业生产中常用氨—酸法进行尾气脱硫,以达到消除污染、废物利用的目的。硫酸工业尾气中的
 经处理可以得到一种化肥,该肥料的化学式是
经处理可以得到一种化肥,该肥料的化学式是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ•mol-1。
2NH3(g) △H=-92.4kJ•mol-1。
(1)在密闭容器中,投入1molN2和3molH2在催化剂作用下发生反应,测得反应放出的热量_______ 92.4kJ(填“小于”、“大于”或“等于”)。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量_______ (填“变大”、“变小”或“不变”)。
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将_______ (填“正向”、“逆向”或“不移动”)。
(4)若容器恒容绝热,加热使容器内温度迅速升至原来的2倍,平衡将_______ (填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________ (填“大于”、“小于”或“等于”)原来的2倍。
(5)若该反应在一密闭容器中发生,如图是某一时间段反应速率与反应进程的关系曲线图。
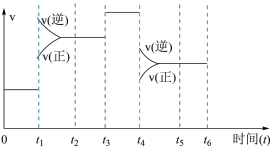
t1、t3、t4时刻体系中反应条件分别发生了什么变化?
t1:________ 。
t3:________ 。
t4:________ 。
 2NH3(g) △H=-92.4kJ•mol-1。
2NH3(g) △H=-92.4kJ•mol-1。(1)在密闭容器中,投入1molN2和3molH2在催化剂作用下发生反应,测得反应放出的热量
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将
(4)若容器恒容绝热,加热使容器内温度迅速升至原来的2倍,平衡将
(5)若该反应在一密闭容器中发生,如图是某一时间段反应速率与反应进程的关系曲线图。

t1、t3、t4时刻体系中反应条件分别发生了什么变化?
t1:
t3:
t4:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】在密闭容器中,使2 mol A和4 mol B混合发生下列反应:
A(g)+2B(g) 2C(g) ΔH<0。
2C(g) ΔH<0。
(1)当反应达到平衡时,A和B的浓度比是_______ ;A和B的转化率比是_______ 。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量_________ ,密度_________ 。(填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将________ (填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________ (填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度______ (填“大于”、“小于”或“等于”)原来的2倍。
A(g)+2B(g)
 2C(g) ΔH<0。
2C(g) ΔH<0。(1)当反应达到平衡时,A和B的浓度比是
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】现有反应:mA(g) + nB(g)⇌pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为________ 热反应,且m+n_____ p(填>、=、<)。
(2)若加入B(体积不变),则A的转化率_________ ,B的转化率_________ 。(填增大、减小或不变)
(3)若升高温度,则平衡时B、C的浓度之比将_________ 。(填增大、减小或不变)
(4) 若加入催化剂,平衡时气体混合物的总物质的量_________ 。(填增大、减小或不变)
(5)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______ ,而维持容器内压强不变,充入氖气时,混合物颜色_______ (填变深、变浅或不变)。
(1)该反应的逆反应为
(2)若加入B(体积不变),则A的转化率
(3)若升高温度,则平衡时B、C的浓度之比将
(4) 若加入催化剂,平衡时气体混合物的总物质的量
(5)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色
您最近一年使用:0次

 溶液中滴加几滴
溶液中滴加几滴 溶液,溶液变为红色。若向上述溶液中滴加较浓的
溶液,溶液变为红色。若向上述溶液中滴加较浓的

