1 . 回答下列问题:
(1)影响化学平衡移动的因素有________ 、_______ 、_______ 。
(2)温度对反应速率的影响(提高了反应物分子的能量),升高温度,反应速率变_______ ,降低温度,反应速率变_______ 。
(3)化学反应中化学键断裂_______ 热,化学键生成______ 热(吸、放)。
(4)化学反应速率的数学表达式为v=________ 。
(5)浓度变化对化学平衡移动的影响规律:
增大反应物浓度或减小生成物浓度,平衡向________ 方向移动。
减小反应物浓度或增大生成物浓度,平衡向_______ 方向移动。
(1)影响化学平衡移动的因素有
(2)温度对反应速率的影响(提高了反应物分子的能量),升高温度,反应速率变
(3)化学反应中化学键断裂
(4)化学反应速率的数学表达式为v=
(5)浓度变化对化学平衡移动的影响规律:
增大反应物浓度或减小生成物浓度,平衡向
减小反应物浓度或增大生成物浓度,平衡向
您最近半年使用:0次
名校
2 . 定条件下,发生反应A(g)+B(g) C(g) △H>0,达到平衡后根据下列图像判断:
C(g) △H>0,达到平衡后根据下列图像判断:
A.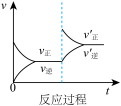 B.
B.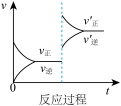 C.
C. D.
D.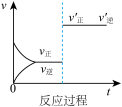 E.
E.
(1)表示升高温度,达到新平衡的是图______ (填“A”、“B”、“C”、“D”或“E”,下同),新平衡中C的质量分数______ (填“增大”、“减小”或“不变”,下同)。
(2)表示降低压强,达到新平衡的是图______ ,A的转化率______ 。
(3)表示减少C的浓度,达到新平衡的是图______ ,表示使用催化剂,达新平衡的是图。
(4)增加A的浓度,达到新平衡的是图______ ,达到平衡后A的转化率______ 。
 C(g) △H>0,达到平衡后根据下列图像判断:
C(g) △H>0,达到平衡后根据下列图像判断:A.
 B.
B. C.
C. D.
D. E.
E.
(1)表示升高温度,达到新平衡的是图
(2)表示降低压强,达到新平衡的是图
(3)表示减少C的浓度,达到新平衡的是图
(4)增加A的浓度,达到新平衡的是图
您最近半年使用:0次
2023-04-24更新
|
263次组卷
|
2卷引用:新疆兵团第三师图木舒克市鸿德实验学校2022-2023学年高二下学期期中考试化学试题
名校
3 . 按要求填空
(1)某反应A(g)+B(g)= C(g)+D(g)过程中的能量变化如图所示,回答问题。
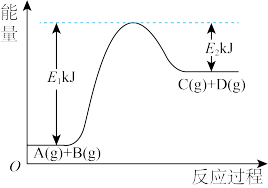
该反应是_______ (填“吸热”或“放热”)反应,该反应过程中,断裂旧化学键吸收的总能量_______ (填“>”“ <”或“=”)形成新化学键释放的总能量。
(2)由金红石(TiO2)制取单质Ti的步骤为:

已知:Ⅰ.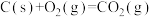

Ⅱ.
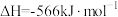
Ⅲ.
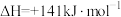
①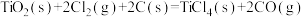 的
的
_______ kJ/mol。
②若已知2H2(g)+O2(g)=2H2O(g) ΔH1=-Q1
2H2(g)+O2(g)=2H2O(l) ΔH2=-Q2
则Q1_______ Q2(填“>”、“<”或“=”)。
(3)在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g) 2NO2(g) ΔH<0体系中,各成分浓度随时间的变化如图所示。
2NO2(g) ΔH<0体系中,各成分浓度随时间的变化如图所示。
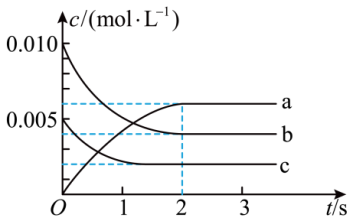
①用O2表示0~2 s内该反应的平均速率v =_______ mol/(L·s)。
②能使该反应的反应速率增大,且平衡向正反应方向移动的是_______ 。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
③达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a时改变的条件可能是_______ 。
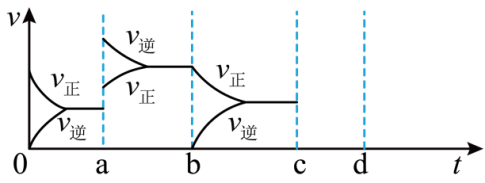
A.升温 B.增大压强 C.加入生成物 D.加入催化剂
(4)已知:①C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
现有0.2 mol木炭粉和氢气组成的悬浮气,在氧气中完全燃烧,共放出67.93 kJ的热量,则混合物中C与H2的物质的量之比为
A.1∶2 B.1∶1 C.2∶3 D.3∶2
(1)某反应A(g)+B(g)= C(g)+D(g)过程中的能量变化如图所示,回答问题。

该反应是
(2)由金红石(TiO2)制取单质Ti的步骤为:

已知:Ⅰ.

Ⅱ.

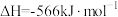
Ⅲ.

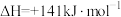
①
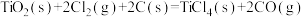 的
的
②若已知2H2(g)+O2(g)=2H2O(g) ΔH1=-Q1
2H2(g)+O2(g)=2H2O(l) ΔH2=-Q2
则Q1
(3)在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g)
 2NO2(g) ΔH<0体系中,各成分浓度随时间的变化如图所示。
2NO2(g) ΔH<0体系中,各成分浓度随时间的变化如图所示。
①用O2表示0~2 s内该反应的平均速率v =
②能使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
③达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a时改变的条件可能是

A.升温 B.增大压强 C.加入生成物 D.加入催化剂
(4)已知:①C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
现有0.2 mol木炭粉和氢气组成的悬浮气,在氧气中完全燃烧,共放出67.93 kJ的热量,则混合物中C与H2的物质的量之比为
A.1∶2 B.1∶1 C.2∶3 D.3∶2
您最近半年使用:0次
4 . 已知在橙色K2Cr2O7水溶液中存在橙色的Cr2O 与黄色的CrO
与黄色的CrO 有下列平衡关系: Cr2O
有下列平衡关系: Cr2O + H2O
+ H2O CrO
CrO + 2H+
+ 2H+
(1)向上述溶液中加入浓硫酸溶液,溶液颜色将___________ ,平衡向___________ 方向移动;
(2)向原溶液中加入NaOH溶液,溶液颜色将___________ , 平衡向___________ 方向移动。
 与黄色的CrO
与黄色的CrO 有下列平衡关系: Cr2O
有下列平衡关系: Cr2O + H2O
+ H2O CrO
CrO + 2H+
+ 2H+(1)向上述溶液中加入浓硫酸溶液,溶液颜色将
(2)向原溶液中加入NaOH溶液,溶液颜色将
您最近半年使用:0次
2021-11-09更新
|
183次组卷
|
3卷引用:新疆博乐市第七中学2021-2022学年高二上学期期末考试化学试题
5 . 在密闭容器中发生如下反应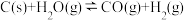
 ;达到平衡后,改变下列条件,判断平衡移动的方向(向正反应方向、向逆反应方向、不移动)
;达到平衡后,改变下列条件,判断平衡移动的方向(向正反应方向、向逆反应方向、不移动)
(1)升高温度,平衡_______ 移动;
(2)增大压强,平衡_______ 移动:
(3)增大H2(g)浓度,平衡_______ 移动:加入C,平衡_______ 移动;
(4)加入催化剂,平衡_______ 移动。
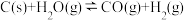
 ;达到平衡后,改变下列条件,判断平衡移动的方向(向正反应方向、向逆反应方向、不移动)
;达到平衡后,改变下列条件,判断平衡移动的方向(向正反应方向、向逆反应方向、不移动)(1)升高温度,平衡
(2)增大压强,平衡
(3)增大H2(g)浓度,平衡
(4)加入催化剂,平衡
您最近半年使用:0次
2021-05-04更新
|
853次组卷
|
4卷引用:新疆喀什巴楚县第一中学2020-2021学年高二下学期期中考试化学试题
新疆喀什巴楚县第一中学2020-2021学年高二下学期期中考试化学试题课前-2.4 化学反应的调控-课前、课中、课后(人教版2019选择性必修1)(已下线)2.2.3 浓度、压强对化学平衡的影响-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)(已下线)第10讲 影响化学平衡的因素(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)
6 . 工业废水中常含有一定量的Cr2O 和CrO
和CrO ,它们会对人类及生态系统产生很大的危害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
,它们会对人类及生态系统产生很大的危害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:

其中第①步存在平衡:2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O
(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显____ 色;
(2)能说明第①步反应达平衡状态的是____ ;
a.溶液的颜色不变
b.2v(CrO )=v(Cr2O
)=v(Cr2O )
)
c. Cr2O 和CrO
和CrO 的浓度相同
的浓度相同
(3)第②步中,还原1mol Cr2O 离子,需要
离子,需要___ mol的FeSO4·7H2O。
 和CrO
和CrO ,它们会对人类及生态系统产生很大的危害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
,它们会对人类及生态系统产生很大的危害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
其中第①步存在平衡:2CrO
 (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O
(橙色)+H2O(1)若平衡体系的pH=2,则溶液显
(2)能说明第①步反应达平衡状态的是
a.溶液的颜色不变
b.2v(CrO
 )=v(Cr2O
)=v(Cr2O )
)c. Cr2O
 和CrO
和CrO 的浓度相同
的浓度相同(3)第②步中,还原1mol Cr2O
 离子,需要
离子,需要
您最近半年使用:0次
名校
解题方法
7 . 高炉炼铁过程中发生的主要反应为 Fe2O3+CO(g)⇌
Fe2O3+CO(g)⇌ Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
请回答下列问题:
(1)该反应正反应是____ 热反应(填“吸”或“放”);
(2)欲提高反应中CO的平衡转化率,可采取的措施是______ ;
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2 D.加入合适的催化剂 E.增大容器的容积
(3)在一个容积为1L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各2.0mol,反应经过5min后达到平衡.求该时间范围内反应的平均反应速率:v(CO2)=_______ 、CO的平衡转化率=_______ 。如果此时向密闭容器中加入CO和CO2各2mol,平衡_______ (填“向正方向”、“向逆方向”、“不”)移动。
(4)在恒温恒容下,下列各项可作为该反应达到平衡状态的标志的是_________ 。
A.压强不再变化
B.气体密度不再变化
C.CO的消耗速率与CO2的消耗速率之比为1:1
D.气体平均摩尔质量不再变化
E.CO与CO2的浓度相等
 Fe2O3+CO(g)⇌
Fe2O3+CO(g)⇌ Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应正反应是
(2)欲提高反应中CO的平衡转化率,可采取的措施是
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2 D.加入合适的催化剂 E.增大容器的容积
(3)在一个容积为1L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各2.0mol,反应经过5min后达到平衡.求该时间范围内反应的平均反应速率:v(CO2)=
(4)在恒温恒容下,下列各项可作为该反应达到平衡状态的标志的是
A.压强不再变化
B.气体密度不再变化
C.CO的消耗速率与CO2的消耗速率之比为1:1
D.气体平均摩尔质量不再变化
E.CO与CO2的浓度相等
您最近半年使用:0次
2020-10-18更新
|
211次组卷
|
2卷引用:新疆吾尔自治区石河子第二中学2020-2021学年高二上学期第一次月考化学试题
8 . 在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应H2(g)+I2(g)  2HI(g) △H<0。改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
2HI(g) △H<0。改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
(1)升高温度____________ ;
(2)容积不变,充入更多的H2______ ;
(3)扩大容器的体积_______ 。
 2HI(g) △H<0。改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
2HI(g) △H<0。改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)(1)升高温度
(2)容积不变,充入更多的H2
(3)扩大容器的体积
您最近半年使用:0次
9 . 可逆反应:FeCl3+3KSCN Fe(SCN)3+3KCl,离子方程式为:Fe3++3SCN-
Fe(SCN)3+3KCl,离子方程式为:Fe3++3SCN- Fe(SCN)3,达到平衡后,进行下列操作,平衡怎样移动?
Fe(SCN)3,达到平衡后,进行下列操作,平衡怎样移动?
(1)加入少量FeCl3固体:平衡向____________ 移动;
(2)加入少量KSCN固体:平衡向____________ 移动;
(3)加入少量KCl固体:平衡____________ 移动,其理由是____________ 。
 Fe(SCN)3+3KCl,离子方程式为:Fe3++3SCN-
Fe(SCN)3+3KCl,离子方程式为:Fe3++3SCN- Fe(SCN)3,达到平衡后,进行下列操作,平衡怎样移动?
Fe(SCN)3,达到平衡后,进行下列操作,平衡怎样移动?(1)加入少量FeCl3固体:平衡向
(2)加入少量KSCN固体:平衡向
(3)加入少量KCl固体:平衡
您最近半年使用:0次
2019-09-27更新
|
85次组卷
|
3卷引用:新疆昌吉回族自治州玛纳斯县第一中学2019-2020学年高二上学期期中考试化学试题
名校
10 . 现有反应aA(g)+bB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应是________ 热反应,且a+b________ p(填“>”“<”或“=”)。
(2)减压时,A的质量分数________ (填“增大”“减小”或“不变”,下同),正反应速率________ 。
(3)若加入B(体积不变),则A的转化率________ ,B的转化率________ 。
(4)若升高温度,则平衡时,B、C的浓度之比c(B)/c(C) 将________ 。
(5)若加入催化剂,平衡时气体混合物的总物质的量________ 。
(6)若B是有色物质, A、C均为无色物质,则加入C(体积不变)时混合物的颜色________ ,而维持容器内气体的压强不变,充入氖气时,混合物的颜色________ 。(填“变浅”“变深”或“不变”)
 pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:(1)该反应的逆反应是
(2)减压时,A的质量分数
(3)若加入B(体积不变),则A的转化率
(4)若升高温度,则平衡时,B、C的浓度之比c(B)/c(C) 将
(5)若加入催化剂,平衡时气体混合物的总物质的量
(6)若B是有色物质, A、C均为无色物质,则加入C(体积不变)时混合物的颜色
您最近半年使用:0次
2018-11-30更新
|
234次组卷
|
4卷引用:新疆昌吉回族自治州玛纳斯县第一中学2019-2020学年高二上学期期中考试化学试题



