1 . 回答下列问题:
(1)影响化学平衡移动的因素有________ 、_______ 、_______ 。
(2)温度对反应速率的影响(提高了反应物分子的能量),升高温度,反应速率变_______ ,降低温度,反应速率变_______ 。
(3)化学反应中化学键断裂_______ 热,化学键生成______ 热(吸、放)。
(4)化学反应速率的数学表达式为v=________ 。
(5)浓度变化对化学平衡移动的影响规律:
增大反应物浓度或减小生成物浓度,平衡向________ 方向移动。
减小反应物浓度或增大生成物浓度,平衡向_______ 方向移动。
(1)影响化学平衡移动的因素有
(2)温度对反应速率的影响(提高了反应物分子的能量),升高温度,反应速率变
(3)化学反应中化学键断裂
(4)化学反应速率的数学表达式为v=
(5)浓度变化对化学平衡移动的影响规律:
增大反应物浓度或减小生成物浓度,平衡向
减小反应物浓度或增大生成物浓度,平衡向
您最近一年使用:0次
名校
2 . 按要求填空
(1)某反应A(g)+B(g)= C(g)+D(g)过程中的能量变化如图所示,回答问题。
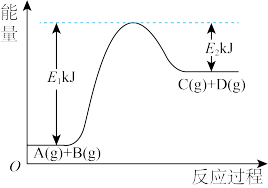
该反应是_______ (填“吸热”或“放热”)反应,该反应过程中,断裂旧化学键吸收的总能量_______ (填“>”“ <”或“=”)形成新化学键释放的总能量。
(2)由金红石(TiO2)制取单质Ti的步骤为:

已知:Ⅰ.

Ⅱ.
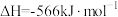
Ⅲ.
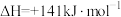
①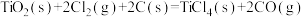 的
的
_______ kJ/mol。
②若已知2H2(g)+O2(g)=2H2O(g) ΔH1=-Q1
2H2(g)+O2(g)=2H2O(l) ΔH2=-Q2
则Q1_______ Q2(填“>”、“<”或“=”)。
(3)在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g) 2NO2(g) ΔH<0体系中,各成分浓度随时间的变化如图所示。
2NO2(g) ΔH<0体系中,各成分浓度随时间的变化如图所示。
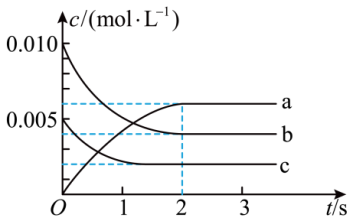
①用O2表示0~2 s内该反应的平均速率v =_______ mol/(L·s)。
②能使该反应的反应速率增大,且平衡向正反应方向移动的是_______ 。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
③达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a时改变的条件可能是_______ 。
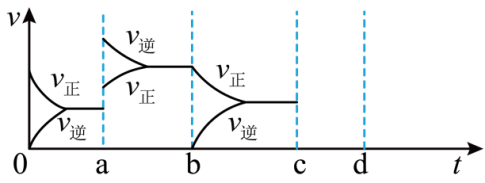
A.升温 B.增大压强 C.加入生成物 D.加入催化剂
(4)已知:①C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
现有0.2 mol木炭粉和氢气组成的悬浮气,在氧气中完全燃烧,共放出67.93 kJ的热量,则混合物中C与H2的物质的量之比为
A.1∶2 B.1∶1 C.2∶3 D.3∶2
(1)某反应A(g)+B(g)= C(g)+D(g)过程中的能量变化如图所示,回答问题。

该反应是
(2)由金红石(TiO2)制取单质Ti的步骤为:

已知:Ⅰ.


Ⅱ.

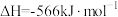
Ⅲ.

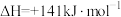
①
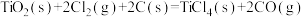 的
的
②若已知2H2(g)+O2(g)=2H2O(g) ΔH1=-Q1
2H2(g)+O2(g)=2H2O(l) ΔH2=-Q2
则Q1
(3)在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g)
 2NO2(g) ΔH<0体系中,各成分浓度随时间的变化如图所示。
2NO2(g) ΔH<0体系中,各成分浓度随时间的变化如图所示。
①用O2表示0~2 s内该反应的平均速率v =
②能使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
③达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a时改变的条件可能是

A.升温 B.增大压强 C.加入生成物 D.加入催化剂
(4)已知:①C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
现有0.2 mol木炭粉和氢气组成的悬浮气,在氧气中完全燃烧,共放出67.93 kJ的热量,则混合物中C与H2的物质的量之比为
A.1∶2 B.1∶1 C.2∶3 D.3∶2
您最近一年使用:0次
名校
解题方法
3 . 高炉炼铁过程中发生的主要反应为 Fe2O3+CO(g)⇌
Fe2O3+CO(g)⇌ Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
请回答下列问题:
(1)该反应正反应是____ 热反应(填“吸”或“放”);
(2)欲提高反应中CO的平衡转化率,可采取的措施是______ ;
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2 D.加入合适的催化剂 E.增大容器的容积
(3)在一个容积为1L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各2.0mol,反应经过5min后达到平衡.求该时间范围内反应的平均反应速率:v(CO2)=_______ 、CO的平衡转化率=_______ 。如果此时向密闭容器中加入CO和CO2各2mol,平衡_______ (填“向正方向”、“向逆方向”、“不”)移动。
(4)在恒温恒容下,下列各项可作为该反应达到平衡状态的标志的是_________ 。
A.压强不再变化
B.气体密度不再变化
C.CO的消耗速率与CO2的消耗速率之比为1:1
D.气体平均摩尔质量不再变化
E.CO与CO2的浓度相等
 Fe2O3+CO(g)⇌
Fe2O3+CO(g)⇌ Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应正反应是
(2)欲提高反应中CO的平衡转化率,可采取的措施是
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2 D.加入合适的催化剂 E.增大容器的容积
(3)在一个容积为1L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各2.0mol,反应经过5min后达到平衡.求该时间范围内反应的平均反应速率:v(CO2)=
(4)在恒温恒容下,下列各项可作为该反应达到平衡状态的标志的是
A.压强不再变化
B.气体密度不再变化
C.CO的消耗速率与CO2的消耗速率之比为1:1
D.气体平均摩尔质量不再变化
E.CO与CO2的浓度相等
您最近一年使用:0次
2020-10-18更新
|
212次组卷
|
2卷引用:新疆吾尔自治区石河子第二中学2020-2021学年高二上学期第一次月考化学试题
4 . 可逆反应:FeCl3+3KSCN Fe(SCN)3+3KCl,离子方程式为:Fe3++3SCN-
Fe(SCN)3+3KCl,离子方程式为:Fe3++3SCN- Fe(SCN)3,达到平衡后,进行下列操作,平衡怎样移动?
Fe(SCN)3,达到平衡后,进行下列操作,平衡怎样移动?
(1)加入少量FeCl3固体:平衡向____________ 移动;
(2)加入少量KSCN固体:平衡向____________ 移动;
(3)加入少量KCl固体:平衡____________ 移动,其理由是____________ 。
 Fe(SCN)3+3KCl,离子方程式为:Fe3++3SCN-
Fe(SCN)3+3KCl,离子方程式为:Fe3++3SCN- Fe(SCN)3,达到平衡后,进行下列操作,平衡怎样移动?
Fe(SCN)3,达到平衡后,进行下列操作,平衡怎样移动?(1)加入少量FeCl3固体:平衡向
(2)加入少量KSCN固体:平衡向
(3)加入少量KCl固体:平衡
您最近一年使用:0次
2019-09-27更新
|
85次组卷
|
3卷引用:新疆昌吉回族自治州玛纳斯县第一中学2019-2020学年高二上学期期中考试化学试题
名校
5 . 现有反应aA(g)+bB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应是________ 热反应,且a+b________ p(填“>”“<”或“=”)。
(2)减压时,A的质量分数________ (填“增大”“减小”或“不变”,下同),正反应速率________ 。
(3)若加入B(体积不变),则A的转化率________ ,B的转化率________ 。
(4)若升高温度,则平衡时,B、C的浓度之比c(B)/c(C) 将________ 。
(5)若加入催化剂,平衡时气体混合物的总物质的量________ 。
(6)若B是有色物质, A、C均为无色物质,则加入C(体积不变)时混合物的颜色________ ,而维持容器内气体的压强不变,充入氖气时,混合物的颜色________ 。(填“变浅”“变深”或“不变”)
 pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:(1)该反应的逆反应是
(2)减压时,A的质量分数
(3)若加入B(体积不变),则A的转化率
(4)若升高温度,则平衡时,B、C的浓度之比c(B)/c(C) 将
(5)若加入催化剂,平衡时气体混合物的总物质的量
(6)若B是有色物质, A、C均为无色物质,则加入C(体积不变)时混合物的颜色
您最近一年使用:0次
2018-11-30更新
|
234次组卷
|
4卷引用:新疆昌吉回族自治州玛纳斯县第一中学2019-2020学年高二上学期期中考试化学试题
名校
6 . 根据所学内容填空:
Ⅰ.化学反应 2A+B⇌2C;△H<0达到化学平衡时,根据以下条件改变填空:
(1)若A、B、C都是气体,且C为有色气体.
①使密闭容器体积增大,A的转化率_______ ;(填增大、减小、不变)
②如果升高温度,平衡混合物的颜色______ ;(填加深、变浅、不变)
(2)若A、C为气体,B为固体;
①加压,则A的体积分数________ ;(填增大、减小、不变)
②增加B的量,A的转化率_______ .(填增大、减小、不变)
Ⅱ.(1)H2S溶于水的电离方程式为________________________ 。向H2S溶液中加入NaOH固体时,c(H+)_________ ,c(S2-)__________ 。(填增大、减小或不变)
(2) 下列物质能导电且属于电解质的是________ (填序号)。
A.铁 B.盐酸 C.氯化钠晶体 D.熔融氢氧化钠
(3)23g C2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出683.4 kJ热量,写出该反应的热化学方程式_________________ 。
Ⅰ.化学反应 2A+B⇌2C;△H<0达到化学平衡时,根据以下条件改变填空:
(1)若A、B、C都是气体,且C为有色气体.
①使密闭容器体积增大,A的转化率
②如果升高温度,平衡混合物的颜色
(2)若A、C为气体,B为固体;
①加压,则A的体积分数
②增加B的量,A的转化率
Ⅱ.(1)H2S溶于水的电离方程式为
(2) 下列物质能导电且属于电解质的是
A.铁 B.盐酸 C.氯化钠晶体 D.熔融氢氧化钠
(3)23g C2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出683.4 kJ热量,写出该反应的热化学方程式
您最近一年使用:0次
2017-02-28更新
|
314次组卷
|
2卷引用:2016-2017学年新疆兵团第二师华山中学高二上学期期末考试化学试卷



