1 . 反应SO2(g)+NO2(g)  SO3(g)+NO(g),若在一定温度下,将物质的量浓度均为2 mol·L-1的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%。则在该温度下:
SO3(g)+NO(g),若在一定温度下,将物质的量浓度均为2 mol·L-1的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%。则在该温度下:
(1)该反应达到平衡状态的标志是___________
A.SO3(g)的生成速率等于SO2(g)的消耗速率
B.混合物的物质的量不再发生变化
C.混合气体的平均摩尔质量不再发生变化
D.混合气体的压强不再发生变化
E.各组分的物质的量分数不再发生变化
(2)此反应在该温度下的平衡常数为___________ 。
(3)在上述温度下,若SO2(g)的初始浓度增大到3 mol·L-1,NO2(g)的初始浓度仍为2 mol·L-1,达到化学平衡状态时,计算下列各物质的平衡浓度及SO2和NO2的平衡转化率。
①c(SO3) =___________ mol·L-1,c(SO2)=___________ mol·L-1。
②SO2的转化率为___________ , NO2的转化率为___________ 。
(4)反应SO2(g)+NO2(g) NO(g)+SO3(g)在一定条件下建立平衡,再加入一定量的O2,下列说法正确的是 ___________ 。
NO(g)+SO3(g)在一定条件下建立平衡,再加入一定量的O2,下列说法正确的是 ___________ 。
①平衡左移,容器内压强不一定增大 ②平衡右移,平衡时容器内压强不一定增大 ③平衡不一定移动,容器内压强一定增大 ④平衡右移,SO2转化率提高
 SO3(g)+NO(g),若在一定温度下,将物质的量浓度均为2 mol·L-1的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%。则在该温度下:
SO3(g)+NO(g),若在一定温度下,将物质的量浓度均为2 mol·L-1的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%。则在该温度下:(1)该反应达到平衡状态的标志是
A.SO3(g)的生成速率等于SO2(g)的消耗速率
B.混合物的物质的量不再发生变化
C.混合气体的平均摩尔质量不再发生变化
D.混合气体的压强不再发生变化
E.各组分的物质的量分数不再发生变化
(2)此反应在该温度下的平衡常数为
(3)在上述温度下,若SO2(g)的初始浓度增大到3 mol·L-1,NO2(g)的初始浓度仍为2 mol·L-1,达到化学平衡状态时,计算下列各物质的平衡浓度及SO2和NO2的平衡转化率。
①c(SO3) =
②SO2的转化率为
(4)反应SO2(g)+NO2(g)
 NO(g)+SO3(g)在一定条件下建立平衡,再加入一定量的O2,下列说法正确的是 ___________ 。
NO(g)+SO3(g)在一定条件下建立平衡,再加入一定量的O2,下列说法正确的是 ___________ 。①平衡左移,容器内压强不一定增大 ②平衡右移,平衡时容器内压强不一定增大 ③平衡不一定移动,容器内压强一定增大 ④平衡右移,SO2转化率提高
| A.①② | B.②③ | C.③④ | D.②④ |
您最近一年使用:0次
名校
2 . 研究化学反应的速率与平衡是科研工作者的重要课题。回答下列问题:
(1)在1L恒容密闭容器中,加入0.5molCaCO3,发生反应: ,CO2的平衡浓度与温度的关系如图所示。
,CO2的平衡浓度与温度的关系如图所示。
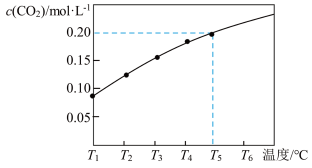
①该反应正反应方向为_______ (填“吸”或“放”)热反应。
②T5℃下达到平衡后(平衡状态Ⅰ),保持温度不变,向容器内通入1molCO2,此时,上述平衡将_______ (填“向右”“向左”或“不”)移动。一段时间后再次达到平衡(平衡状态Ⅱ),平衡状态Ⅰ容器内的压强_______ (填“>”“<”或“=”)平衡状态Ⅰ容器内的压强。
③写出一种能加快该化学反应速率并能增加该反应限度的措施:_______ 。
(2) ℃下,向1L密闭容器中通入1molHI(g),发生反应
℃下,向1L密闭容器中通入1molHI(g),发生反应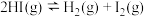 ,一段时间后达到平衡状态。
,一段时间后达到平衡状态。
①恒温恒容时,若起始通入2molHI(g),则下列物理量为原来的2倍的是_______ (填字母)。
A.平衡常数 B.HI的平衡浓度
C.达到平衡的时间 D.平衡时H2的体积分数
②上述反应中,正反应速率为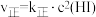 ,逆反应速率为
,逆反应速率为 。其中
。其中 、
、 为速率常数。若
为速率常数。若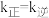 ,则T℃下,该反应的平衡常数K=
,则T℃下,该反应的平衡常数K=_______ 。
(3)氢气用于工业合成甲烷的反应为 △H<0。一定温度下,在容积恒定的密闭容器中,一定量的CO和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示:
△H<0。一定温度下,在容积恒定的密闭容器中,一定量的CO和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示:
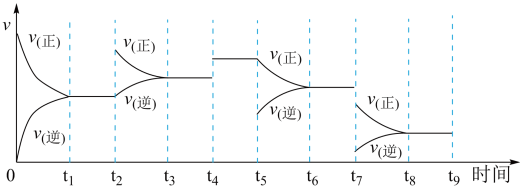
①t5时刻所对应的实验改变的条件是_______ 。
②平衡常数最大的时间段是_______ 。
A. B.
B.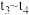 C.
C.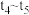 D.
D. E.
E.
(1)在1L恒容密闭容器中,加入0.5molCaCO3,发生反应:
 ,CO2的平衡浓度与温度的关系如图所示。
,CO2的平衡浓度与温度的关系如图所示。
①该反应正反应方向为
②T5℃下达到平衡后(平衡状态Ⅰ),保持温度不变,向容器内通入1molCO2,此时,上述平衡将
③写出一种能加快该化学反应速率并能增加该反应限度的措施:
(2)
 ℃下,向1L密闭容器中通入1molHI(g),发生反应
℃下,向1L密闭容器中通入1molHI(g),发生反应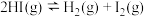 ,一段时间后达到平衡状态。
,一段时间后达到平衡状态。①恒温恒容时,若起始通入2molHI(g),则下列物理量为原来的2倍的是
A.平衡常数 B.HI的平衡浓度
C.达到平衡的时间 D.平衡时H2的体积分数
②上述反应中,正反应速率为
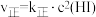 ,逆反应速率为
,逆反应速率为 。其中
。其中 、
、 为速率常数。若
为速率常数。若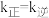 ,则T℃下,该反应的平衡常数K=
,则T℃下,该反应的平衡常数K=(3)氢气用于工业合成甲烷的反应为
 △H<0。一定温度下,在容积恒定的密闭容器中,一定量的CO和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示:
△H<0。一定温度下,在容积恒定的密闭容器中,一定量的CO和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示:
①t5时刻所对应的实验改变的条件是
②平衡常数最大的时间段是
A.
 B.
B.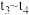 C.
C.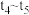 D.
D. E.
E.
您最近一年使用:0次
3 . 在0.1 mol·L-1的氨水中,存在如下电离平衡:NH3·H2O 
 +OH- (正反应为吸热反应)。在此平衡体系中,若按下列情况变动,请将变化情况(增大用“↑”,减小用“↓”,向左用“←”,向右用“→”)填入下表。
+OH- (正反应为吸热反应)。在此平衡体系中,若按下列情况变动,请将变化情况(增大用“↑”,减小用“↓”,向左用“←”,向右用“→”)填入下表。

 +OH- (正反应为吸热反应)。在此平衡体系中,若按下列情况变动,请将变化情况(增大用“↑”,减小用“↓”,向左用“←”,向右用“→”)填入下表。
+OH- (正反应为吸热反应)。在此平衡体系中,若按下列情况变动,请将变化情况(增大用“↑”,减小用“↓”,向左用“←”,向右用“→”)填入下表。| 条件的变化 | 升温 | 通氨气 | 加水 | 加NaOH(s) | 加NH4Cl(s) |
| 电离平衡移动的方向 | |||||
| n(OH- ) | |||||
| c(NH3·H2O) | |||||
| 导电能力 |
您最近一年使用:0次
解题方法
4 . 氮氧化物超标排放是水体富营养化的重要原因,可以用以下流程处理:

请回答下列问题:
(1)请用平衡移动原理解释过程I的原理为___________ 。
(2)过程II每转化1 mol NH ,转移电子的物质的量为
,转移电子的物质的量为___________ 。
(3)过程III的产物为两种无污染气体和生活中一种常见的液体,则该过程发生反应的化学方程式为___________ 。

请回答下列问题:
(1)请用平衡移动原理解释过程I的原理为
(2)过程II每转化1 mol NH
 ,转移电子的物质的量为
,转移电子的物质的量为(3)过程III的产物为两种无污染气体和生活中一种常见的液体,则该过程发生反应的化学方程式为
您最近一年使用:0次
2020-12-10更新
|
64次组卷
|
2卷引用:河南省名校联盟2020-2021学年高二上学期期中考试化学试题
名校
5 . 盐溶液受盐的水解影响,导致性质具有一定的复杂性.在0.1mol•L﹣1的重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2O +H2O⇌2HCrO
+H2O⇌2HCrO ⇌2CrO
⇌2CrO +2H+
+2H+
(1)重铬酸钾溶液呈________ 性,在强碱溶液中,铬元素的主要存在形式为________ (填离子符号),向重铬酸钾溶液中加入适量稀硫酸,溶液中c(Cr2O )/c(CrO
)/c(CrO )将
)将________ (填“增大”、“减小”或“不变”).
(2)向(K2Cr2O7)溶液中加入AgNO3溶液,发生离子互换反应,生成砖红色沉淀且溶液PH减小,则生成的砖红色沉淀的化学式为________ .
 +H2O⇌2HCrO
+H2O⇌2HCrO ⇌2CrO
⇌2CrO +2H+
+2H+(1)重铬酸钾溶液呈
 )/c(CrO
)/c(CrO )将
)将(2)向(K2Cr2O7)溶液中加入AgNO3溶液,发生离子互换反应,生成砖红色沉淀且溶液PH减小,则生成的砖红色沉淀的化学式为
您最近一年使用:0次
名校
解题方法
6 . 在一固定容积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表:
试回答下列问题:
(1)能判断该反应是否达到化学平衡状态的依据是________ 。
A.容器中气体压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(2)800 ℃时,向固定容积的密闭容器中放入混合物,起始浓度分别为c(CO)=0.01 mol·L-1,c(H2O)=0.03 mol·L-1,c(CO2)=0.01 mol·L-1,c(H2)=0.05 mol·L-1,则反应开始时,H2O的消耗速率比生成速率________ (填“大”“小”或“不确定”)。
(3) 和
和 在溶液中可相互转化。室温下,初始浓度为
在溶液中可相互转化。室温下,初始浓度为 的
的 溶液中
溶液中 随
随 的变化如图所示(线上每一个点均为平衡时的关系)。
的变化如图所示(线上每一个点均为平衡时的关系)。

① 用离子方程式表示 溶液中的转化反应
溶液中的转化反应______ 。
② 由图可知,溶液酸性增大, 的平衡转化率
的平衡转化率_________ (填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为___________ 。
| T/℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)能判断该反应是否达到化学平衡状态的依据是
A.容器中气体压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(2)800 ℃时,向固定容积的密闭容器中放入混合物,起始浓度分别为c(CO)=0.01 mol·L-1,c(H2O)=0.03 mol·L-1,c(CO2)=0.01 mol·L-1,c(H2)=0.05 mol·L-1,则反应开始时,H2O的消耗速率比生成速率
(3)
 和
和 在溶液中可相互转化。室温下,初始浓度为
在溶液中可相互转化。室温下,初始浓度为 的
的 溶液中
溶液中 随
随 的变化如图所示(线上每一个点均为平衡时的关系)。
的变化如图所示(线上每一个点均为平衡时的关系)。
① 用离子方程式表示
 溶液中的转化反应
溶液中的转化反应② 由图可知,溶液酸性增大,
 的平衡转化率
的平衡转化率
您最近一年使用:0次
7 . 甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应,CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。__ PB(填“>、<、=”)。
②A、B、C三点的平衡常数KA,KB,KC的大小关系是__ 。
③下列叙述能说明上述反应能达到化学平衡状态的是__ (填代号)。
a.H2的消耗速率是CH3OH消耗速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
(2)在P1压强、T1℃时,该反应的平衡常数K=__ ,再加入1.0molCO后重新到达平衡,则CO的转化率__ (填“增大,不变或减小”)。
(3)T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下,CO:0.1mol、H2:0.2mol、CH3OH:0.2mol,此时v(正)__ v(逆)(填“>、<或=”)。
(1)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应,CO(g)+2H2(g)
 CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。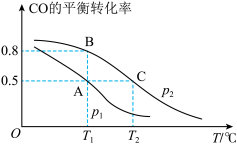
②A、B、C三点的平衡常数KA,KB,KC的大小关系是
③下列叙述能说明上述反应能达到化学平衡状态的是
a.H2的消耗速率是CH3OH消耗速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
(2)在P1压强、T1℃时,该反应的平衡常数K=
(3)T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下,CO:0.1mol、H2:0.2mol、CH3OH:0.2mol,此时v(正)
您最近一年使用:0次
2020-10-19更新
|
185次组卷
|
21卷引用:河南省濮阳市2023-2024学年高二上学期9月月考化学试题
河南省濮阳市2023-2024学年高二上学期9月月考化学试题【校级联考】福建省福州市八县(市)协作校2018-2019学年高二上学期期末联考化学试题黑龙江省双鸭山市第一中学2019-2020学年高二上学期第一次月考化学试题陕西省宝鸡市金台区2019-2020学年高二上学期期中检测化学试题湖北省随州市曾都一中2020-2021学年高二上学期9月月考化学试题河北省邯郸市大名县第一中学2020-2021学年高二上学期10月月考化学(实验班)试题内蒙古包头市第一中学2020-2021学年高二上学期第一次月考化学试题山东省惠民县第二中学致远部2020-2021学年高二上学期10月月考化学试题内蒙古通辽市开鲁县第一中学2021届高三上学期第二次阶段性考试化学试题重庆市铁路中学校2020-2021学年高二上学期11月月考化学试题重庆育才中学2021-2022学年高二上学期第四次定时练习化学试题湖南师范大学附属中学2022-2023学年高二上学期期中考试化学试题四川省广安代市中学校2021-2022学年高二上学期9月考化学试题湖南省怀化市第三中学2022-2023学年高二上学期期中考试化学试题江西省永修县第一中学2023-2024学年高二上学期开学考试化学试题江西省宜春市宜丰中学2023-2024学年高二上学期开学考试化学试题陕西省西安市长安区2023-2024学年高二上学期10月份月考化学试题四川省仁寿第一中学校(北校区)2023-2024学年高二上学期10月月考化学试题海南省琼海市嘉积中学2023-2024学年高二上学期第一次月考化学试题四川省泸州市泸县第四中学2023-2024学年高二上学期12月月考化学试题重庆十八中两江实验中学校2022-2023学年高二上学期第一次月考化学试题
8 . 为了减轻汽车尾气造成的大气污染,人们开始探索利用 NO 和 CO 在一定条件下 转化为 两种无毒气体E和F的方法(已知该反应△H<0). 在2L密闭容器中加入一定量 NO和CO,当温度分别在 T1和 T2时,测得各物质平衡时物质的量如下表:
(1)请结合上表数据,写出 NO 与 CO 反应的化学方程式_________________________________ 。
(2)根据表中数据判断,温度T1和T2的关系是(填序号)__________ 。
A.T1>T2 B. T1<T2 C. T1=T2 D.无法比较
(3)已知:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g) ΔH=- 1266.8 kJ/mol,N2(g) + O2(g) = 2NO(g) ΔH = + 180.5kJ/mol,则氨催化氧化的热化学方程式为:________________________ 。
(4)500℃下,在 A、B 两个容器中均发生合成氨的反应。隔板Ⅰ固定不动,活塞Ⅱ可自由移动。

当合成氨在容器 B 中达平衡时,测得其中含有 1.0molN2,0.4molH2,0.4molNH3,此时容积为2.0L。则此条件下的平衡常数为_______________ ;保持温度和体积不变,向此容器中通入0.36molN2,平衡将__________________ (填“正向”、“逆向”或“不”)移动。
| n(mol) | NO | CO | E | F |
| 初始 | 0.100 | 0.100 | 0 | 0 |
| T1 | 0.020 | 0.020 | 0.080 | 0.040 |
| T2 | 0.010 | 0.010 | 0.090 | 0.045 |
(1)请结合上表数据,写出 NO 与 CO 反应的化学方程式
(2)根据表中数据判断,温度T1和T2的关系是(填序号)
A.T1>T2 B. T1<T2 C. T1=T2 D.无法比较
(3)已知:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g) ΔH=- 1266.8 kJ/mol,N2(g) + O2(g) = 2NO(g) ΔH = + 180.5kJ/mol,则氨催化氧化的热化学方程式为:
(4)500℃下,在 A、B 两个容器中均发生合成氨的反应。隔板Ⅰ固定不动,活塞Ⅱ可自由移动。

当合成氨在容器 B 中达平衡时,测得其中含有 1.0molN2,0.4molH2,0.4molNH3,此时容积为2.0L。则此条件下的平衡常数为
您最近一年使用:0次
名校
9 . 现有反应:mA(g)+nB(g) pC(g)
pC(g)
(I)若达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为___ 热反应,且m+n__ p(填“>”、“=”或“<”)。
(2)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色___ ;而维持容器内压强不变,充入氖气时,混合物颜色___ 。(填“变深”、“变浅”或“不变”)。
(II)若在容积可变的密闭容器中发生反应,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如表
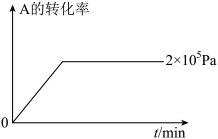
(1)当压强从2×105Pa增加到5×105Pa时,平衡___ 移动(填:向左,向右,不)。
(2)维持压强为2×105Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入b molB,当重新达到平衡时,体系中气体总物质的量是___ mol。
(3)当压强为1×106Pa时,此反应的平衡常数表达式:___ 。
(4)其他条件相同时,在上述三个压强下分别发生该反应。2×105Pa时,A的转化率随时间变化如图,请在图中补充画出压强分别为5×105Pa和1×106Pa时,A的转化率随时间的变化曲线(请在图线上标出压强)。____
 pC(g)
pC(g)(I)若达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为
(2)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色
(II)若在容积可变的密闭容器中发生反应,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
(2)维持压强为2×105Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入b molB,当重新达到平衡时,体系中气体总物质的量是
(3)当压强为1×106Pa时,此反应的平衡常数表达式:
(4)其他条件相同时,在上述三个压强下分别发生该反应。2×105Pa时,A的转化率随时间变化如图,请在图中补充画出压强分别为5×105Pa和1×106Pa时,A的转化率随时间的变化曲线(请在图线上标出压强)。

您最近一年使用:0次
名校
10 . 现有反应:mA(g)+nB(g)  pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为______ (填“吸热”或“放热”)反应,且m+n______ (填“>”“=”或“<”)p。
(2)减压使容器体积增大时,A的质量分数________ 。(填“增大”“减小”或“不变”,下同)
(3)若容积不变加入B,则A的转化率__________ ,B的转化率________ 。
(4)若升高温度,则平衡时B、C的浓度之比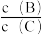 将
将________ 。
(5)若加入催化剂,平衡时气体混合物的总物质的量______________________ 。
 pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:(1)该反应的逆反应为
(2)减压使容器体积增大时,A的质量分数
(3)若容积不变加入B,则A的转化率
(4)若升高温度,则平衡时B、C的浓度之比
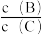 将
将(5)若加入催化剂,平衡时气体混合物的总物质的量
您最近一年使用:0次
2019-07-25更新
|
239次组卷
|
7卷引用:河南省兰考县第二高级中学2021-2022学年高二上学期期中考试化学试题
河南省兰考县第二高级中学2021-2022学年高二上学期期中考试化学试题内蒙古集宁一中(西校区)2018-2019学年高一下学期期末考试化学试题湖北省黄石市育英高中2020-2021学年高二上学期第一次月考化学试题山西省太原市山西英才学校2021-2022学年高二上学期月考化学试题(已下线)2.3.2 温度变化对化学平衡的影响(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)江西省永修县第一中学2023-2024学年高二上学期开学考试化学试题(已下线)专题05 影响化学平衡的因素【考题猜想】(6大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)



