名校
1 . 草酸钴在化学中应用广泛,可用于制备催化剂等。以钻矿[主要成分为 、
、 、
、 ,含少量的
,含少量的 、
、 、
、 、
、 、
、 等]为原料制取草酸钴晶体
等]为原料制取草酸钴晶体 的工艺流程如图所示。
的工艺流程如图所示。
(1) 位于元素周期表中第
位于元素周期表中第___________ 周期第___________ 族。
(2)浸出渣的主要成分是___________ (填化学式)。“浸取”时 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
(3)“氧化”过程中消耗 的量明显偏高的原因是
的量明显偏高的原因是___________ (用化学方程式表示)。
(4)取“调节 ”后所得滤液,将
”后所得滤液,将 调至9.4,可得到
调至9.4,可得到 沉淀,在空气中
沉淀,在空气中 煅烧该沉淀得到
煅烧该沉淀得到 的化学方程式为
的化学方程式为___________ 。
(5)“提纯”分为萃取和反萃取两步进行。向除杂后的溶液中加入某有机酸萃取剂 发生反应
发生反应 当溶液
当溶液 处于一定范围内时,测得
处于一定范围内时,测得 萃取率随溶液
萃取率随溶液 的增大而增大,其原因是
的增大而增大,其原因是___________ 。反萃取时,应加入___________ 。
(6)取 草酸钴晶体,在空气中加热至恒重,得到
草酸钴晶体,在空气中加热至恒重,得到 和
和 的混合物
的混合物 ,则该混合物中
,则该混合物中 的质量为
的质量为___________  。
。
 、
、 、
、 ,含少量的
,含少量的 、
、 、
、 、
、 、
、 等]为原料制取草酸钴晶体
等]为原料制取草酸钴晶体 的工艺流程如图所示。
的工艺流程如图所示。
(1)
 位于元素周期表中第
位于元素周期表中第(2)浸出渣的主要成分是
 发生反应的化学方程式为
发生反应的化学方程式为(3)“氧化”过程中消耗
 的量明显偏高的原因是
的量明显偏高的原因是(4)取“调节
 ”后所得滤液,将
”后所得滤液,将 调至9.4,可得到
调至9.4,可得到 沉淀,在空气中
沉淀,在空气中 煅烧该沉淀得到
煅烧该沉淀得到 的化学方程式为
的化学方程式为(5)“提纯”分为萃取和反萃取两步进行。向除杂后的溶液中加入某有机酸萃取剂
 发生反应
发生反应 当溶液
当溶液 处于一定范围内时,测得
处于一定范围内时,测得 萃取率随溶液
萃取率随溶液 的增大而增大,其原因是
的增大而增大,其原因是(6)取
 草酸钴晶体,在空气中加热至恒重,得到
草酸钴晶体,在空气中加热至恒重,得到 和
和 的混合物
的混合物 ,则该混合物中
,则该混合物中 的质量为
的质量为 。
。
您最近一年使用:0次
名校
2 . Ⅰ.甲醇是一种重要的化工原料,具有开发和应用的广阔前景。工业上使用水煤气(CO与H2的混合气体)转化成甲醇,反应为CO(g)+2H2(g) CH3OH(g)。CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。CO的平衡转化率与温度、压强的关系如图所示。
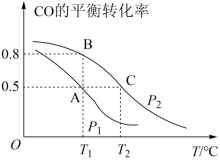
(1)在T2℃、p2压强时,往一容积为2L的密闭容器内,充入0.3molCO与0.4molH2发生反应。平衡时H2的体积分数是___________ ;平衡常数K=___________ 。平衡后再加入1.0molCO后重新到达平衡,则CO的转化率___________ (填“增大”、“不变”成“减小”),CO与CH3OH的浓度比
___________ (填“增大”、“不变”或“减小”)。
(2)若以不同比例投料,测得某时刻各物质的物质的量如下,CO:0.1mol、H2:0.2mol、CH3OH:0.2mol,此时v(正)___________ v(逆)(填“>”、“<”或“=”)。
(3)若p2压强恒定为p,则平衡常数Kp=___________ (Kp用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,整理出含p的最简表达式)。
Ⅱ.在真空1L密闭容器内加入amolPH4I固体,在一定温度下发生如下反应:
①PH4I(s) PH3(g)+HI(g)
PH3(g)+HI(g)
②4PH3(g) P4(g)+6H2(g)
P4(g)+6H2(g)
③2HI(g) H2(g)+I2(g)
H2(g)+I2(g)
以上三个反应建立平衡后,测得HI为bmol,I2为cmol,H2为dmol。
(4)平衡后,增大压强,容器内n(I2)将___________ (填“增加”、“减小”或“不变”)。
(5)平衡后容器内P4(g)的物质的量___________ 。
(6)求反应①的K___________ 。
 CH3OH(g)。CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。CO的平衡转化率与温度、压强的关系如图所示。
(1)在T2℃、p2压强时,往一容积为2L的密闭容器内,充入0.3molCO与0.4molH2发生反应。平衡时H2的体积分数是

(2)若以不同比例投料,测得某时刻各物质的物质的量如下,CO:0.1mol、H2:0.2mol、CH3OH:0.2mol,此时v(正)
(3)若p2压强恒定为p,则平衡常数Kp=
Ⅱ.在真空1L密闭容器内加入amolPH4I固体,在一定温度下发生如下反应:
①PH4I(s)
 PH3(g)+HI(g)
PH3(g)+HI(g) ②4PH3(g)
 P4(g)+6H2(g)
P4(g)+6H2(g) ③2HI(g)
 H2(g)+I2(g)
H2(g)+I2(g)以上三个反应建立平衡后,测得HI为bmol,I2为cmol,H2为dmol。
(4)平衡后,增大压强,容器内n(I2)将
(5)平衡后容器内P4(g)的物质的量
(6)求反应①的K
您最近一年使用:0次
名校
解题方法
3 . 含氮、含硫化合物在工业、农业生产中应用广泛,氮、硫的氧化物对环境不友好经常采用碱液吸收法消除氮、硫的氧化物。
(1)硫酸肼(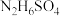 )是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与
)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与 类似,写出硫酸肼第一步水解反应的离子方程式:
类似,写出硫酸肼第一步水解反应的离子方程式:___________ 。
(2)利用氢氧化钠溶液吸收 。吸收
。吸收 的过程中,溶液中
的过程中,溶液中 、
、 、
、 三者所占物质的量分数(a)随pH变化的关系如图所示:
三者所占物质的量分数(a)随pH变化的关系如图所示:
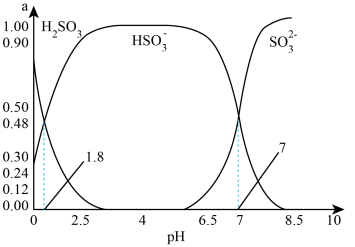
①图中 时,溶液中离子浓度关系正确的是
时,溶液中离子浓度关系正确的是___________ (填字母)。
A.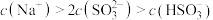
B.
C.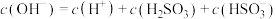
D.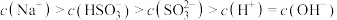
②利用图中数据,求反应 的平衡常数的数值
的平衡常数的数值___________ 。
③用NaOH吸收 ,并用CaO使NaOH再生:
,并用CaO使NaOH再生: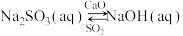 。CaO在水中存在如下转化:
。CaO在水中存在如下转化: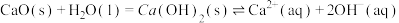 从平衡移动的角度,简述NaOH再生的原理:
从平衡移动的角度,简述NaOH再生的原理:___________ 。
(3)利用氢氧化钠溶液吸收 ,反应为
,反应为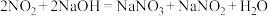 。已知25℃电离常数
。已知25℃电离常数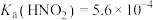 、
、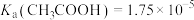 ,现有:溶液A:含0.2molNaOH的水溶液与0.2mol
,现有:溶液A:含0.2molNaOH的水溶液与0.2mol 恰好完全反应得1L溶液;溶液B:
恰好完全反应得1L溶液;溶液B: 溶液。两份溶液中
溶液。两份溶液中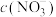 、
、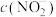 和
和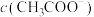 由大到小的顺序为
由大到小的顺序为___________ 。
(1)硫酸肼(
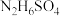 )是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与
)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与 类似,写出硫酸肼第一步水解反应的离子方程式:
类似,写出硫酸肼第一步水解反应的离子方程式:(2)利用氢氧化钠溶液吸收
 。吸收
。吸收 的过程中,溶液中
的过程中,溶液中 、
、 、
、 三者所占物质的量分数(a)随pH变化的关系如图所示:
三者所占物质的量分数(a)随pH变化的关系如图所示:
①图中
 时,溶液中离子浓度关系正确的是
时,溶液中离子浓度关系正确的是A.
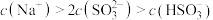
B.

C.
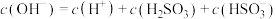
D.
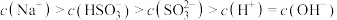
②利用图中数据,求反应
 的平衡常数的数值
的平衡常数的数值③用NaOH吸收
 ,并用CaO使NaOH再生:
,并用CaO使NaOH再生: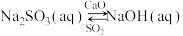 。CaO在水中存在如下转化:
。CaO在水中存在如下转化: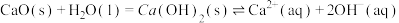 从平衡移动的角度,简述NaOH再生的原理:
从平衡移动的角度,简述NaOH再生的原理:(3)利用氢氧化钠溶液吸收
 ,反应为
,反应为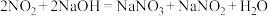 。已知25℃电离常数
。已知25℃电离常数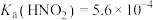 、
、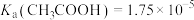 ,现有:溶液A:含0.2molNaOH的水溶液与0.2mol
,现有:溶液A:含0.2molNaOH的水溶液与0.2mol 恰好完全反应得1L溶液;溶液B:
恰好完全反应得1L溶液;溶液B: 溶液。两份溶液中
溶液。两份溶液中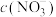 、
、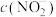 和
和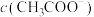 由大到小的顺序为
由大到小的顺序为
您最近一年使用:0次
名校
解题方法
4 . 丙烯是一种重要的化工原料,在催化剂作用下,可以由丙烷直接脱氢或氧化脱氢制备。
反应Ⅰ(直接脱氢):

反应Ⅱ(氧化脱氢):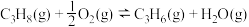

反应Ⅲ(氢气燃烧):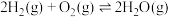
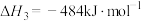
(1)
_____ kJ/mol。
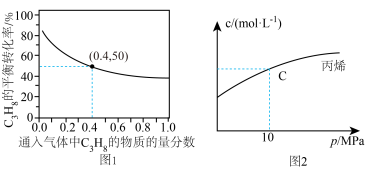
(2)对于反应Ⅰ,总压恒定为100kPa,在密闭容器中通入 和Ar的混合气体。在温度为
和Ar的混合气体。在温度为 时,
时, 的平衡转化率与通入气体中
的平衡转化率与通入气体中 的物质的量分数的关系如图1
的物质的量分数的关系如图1
①结合图1,从平衡移动的角度分析,“通入Ar”的作用是_____ 。
②若要将 的平衡转化率提高到60%,则
的平衡转化率提高到60%,则
_____ 。
(3)恒温条件下,测得反应Ⅰ平衡时 的物质的量浓度与平衡总压的关系如图2.请在图上画出平衡时
的物质的量浓度与平衡总压的关系如图2.请在图上画出平衡时 的物质的量浓度随平衡总压变化的曲线
的物质的量浓度随平衡总压变化的曲线_____ 。(在图中C点平衡总压为10Mpa时,丙烷和丙烯的物质的浓度相等)。
(4)①关于反应Ⅲ,下列说法正确的是_____ 。
A.该反应在任何温度下都能自发进行
B.升高温度,反应Ⅱ的平衡常数增大
C.通入的氧气越多,越有利于丙烷的氧化脱氢
D.将水液化分离出来,既可以加快反应速率,又能提高 的转化率
的转化率
②与直接脱氢反应相比,氧化脱氢制备丙烯的优点是_____ 。
(5)研究表明, 可催化氧化
可催化氧化 脱氢制丙烯。在p=0.1MPa,
脱氢制丙烯。在p=0.1MPa, ,催化剂X的催化下,气体按一定流速通过反应器,丙烷转化率和产物选择性(丙烯的选择性=丙烯的产率÷丙烷的转化率×100%)随温度变化如下表:
,催化剂X的催化下,气体按一定流速通过反应器,丙烷转化率和产物选择性(丙烯的选择性=丙烯的产率÷丙烷的转化率×100%)随温度变化如下表:
下列说法不正确的是_____。
反应Ⅰ(直接脱氢):


反应Ⅱ(氧化脱氢):
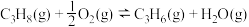

反应Ⅲ(氢气燃烧):
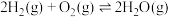
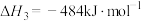
(1)

(2)对于反应Ⅰ,总压恒定为100kPa,在密闭容器中通入
 和Ar的混合气体。在温度为
和Ar的混合气体。在温度为 时,
时, 的平衡转化率与通入气体中
的平衡转化率与通入气体中 的物质的量分数的关系如图1
的物质的量分数的关系如图1①结合图1,从平衡移动的角度分析,“通入Ar”的作用是
②若要将
 的平衡转化率提高到60%,则
的平衡转化率提高到60%,则
(3)恒温条件下,测得反应Ⅰ平衡时
 的物质的量浓度与平衡总压的关系如图2.请在图上画出平衡时
的物质的量浓度与平衡总压的关系如图2.请在图上画出平衡时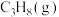 的物质的量浓度随平衡总压变化的曲线
的物质的量浓度随平衡总压变化的曲线(4)①关于反应Ⅲ,下列说法正确的是
A.该反应在任何温度下都能自发进行
B.升高温度,反应Ⅱ的平衡常数增大
C.通入的氧气越多,越有利于丙烷的氧化脱氢
D.将水液化分离出来,既可以加快反应速率,又能提高
 的转化率
的转化率②与直接脱氢反应相比,氧化脱氢制备丙烯的优点是
(5)研究表明,
 可催化氧化
可催化氧化 脱氢制丙烯。在p=0.1MPa,
脱氢制丙烯。在p=0.1MPa, ,催化剂X的催化下,气体按一定流速通过反应器,丙烷转化率和产物选择性(丙烯的选择性=丙烯的产率÷丙烷的转化率×100%)随温度变化如下表:
,催化剂X的催化下,气体按一定流速通过反应器,丙烷转化率和产物选择性(丙烯的选择性=丙烯的产率÷丙烷的转化率×100%)随温度变化如下表:| t℃ | 丙烷转化率 | 产物的选择性 | ||
 |  | CO | ||
| 400 | 4.06 | 93.12 | 2.20 | 4.68 |
| 500 | 12.32 | 91.23 | 3.16 | 5.61 |
| 600 | 35.22 | 85.44 | 7.73 | 6.83 |
| A.在较高温度下,催化剂X可提高产生丙烯反应的速率 |
B. 催化氧化 催化氧化 脱氢制丙烯的反应是放热反应 脱氢制丙烯的反应是放热反应 |
| C.相同条件下,使用不同的催化剂,丙烷的平衡转化率相同 |
| D.温度升高,催化剂X的活性下降,丙烯的产率降低 |
您最近一年使用:0次
2023-12-05更新
|
221次组卷
|
4卷引用:河南省焦作市博爱县第一中学2023-2024学年高二上学期1月期末化学试题
河南省焦作市博爱县第一中学2023-2024学年高二上学期1月期末化学试题浙江省稽阳联谊学校2023-2024学年高三上学期联考化学试题浙江省宁波市2023-2024学年高二上学期九校联考化学试题(已下线)专题10 化学反应原理综合题(浙江专用)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)
5 . 碘(紫黑色固体,微溶于水)及其化合物广泛用于医药染料等方面。回答下列问题:
(1) 的一种制备方法如图所示:
的一种制备方法如图所示:

已知: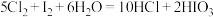 。
。
①加入Fe粉进行转化反应的离子方程式为___________ ,生成的沉淀与硝酸反应,生成___________ (填名称)后可循环使用。
②通入 的过程中,若氧化产物只有一种,则
的过程中,若氧化产物只有一种,则
___________ ;当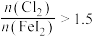 后,单质碘的收率会降低,原因是
后,单质碘的收率会降低,原因是___________ 。
(2)以 为原料制备
为原料制备 的方法是:先向
的方法是:先向 溶液中加入过量的
溶液中加入过量的 ,生成碘化物;再向混合溶液中加入
,生成碘化物;再向混合溶液中加入 溶液,反应得到
溶液,反应得到 。上述制备
。上述制备 的总反应的离子方程式为
的总反应的离子方程式为___________ 。
(3)KI溶液和 溶液混合可生成
溶液混合可生成 沉淀和
沉淀和 ,若生成
,若生成 ,消耗的KI至少为
,消耗的KI至少为___________ mol。 在KI溶液中可发生反应:
在KI溶液中可发生反应: 。实验室中使用过量的KI与
。实验室中使用过量的KI与 溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量KI的原因是
溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量KI的原因是___________ 。
(1)
 的一种制备方法如图所示:
的一种制备方法如图所示:
已知:
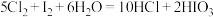 。
。①加入Fe粉进行转化反应的离子方程式为
②通入
 的过程中,若氧化产物只有一种,则
的过程中,若氧化产物只有一种,则
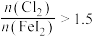 后,单质碘的收率会降低,原因是
后,单质碘的收率会降低,原因是(2)以
 为原料制备
为原料制备 的方法是:先向
的方法是:先向 溶液中加入过量的
溶液中加入过量的 ,生成碘化物;再向混合溶液中加入
,生成碘化物;再向混合溶液中加入 溶液,反应得到
溶液,反应得到 。上述制备
。上述制备 的总反应的离子方程式为
的总反应的离子方程式为(3)KI溶液和
 溶液混合可生成
溶液混合可生成 沉淀和
沉淀和 ,若生成
,若生成 ,消耗的KI至少为
,消耗的KI至少为 在KI溶液中可发生反应:
在KI溶液中可发生反应: 。实验室中使用过量的KI与
。实验室中使用过量的KI与 溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量KI的原因是
溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量KI的原因是
您最近一年使用:0次
6 . 重铬酸钾(K2Cr2O7)又名红矾钾,是化学实验室中的一种重要分析试剂,在工业上用途广泛。已知水溶液中存在平衡:( )。请回答下列问题:
)。请回答下列问题:
(1)复分解法制备重铬酸钾
以Na2CrO4溶液为原料,步骤如下:
①先向Na2CrO4溶液中加入酸调节溶液pH,其目的是___________ 。
②再向①的溶液中加入适量KCl,搅拌溶解、蒸发浓缩、冷却结晶,抽滤得到K2Cr2O7粗产品。则相同温度时的溶解度:Na2Cr2O7___________ K2Cr2O7 (填“﹥”“﹤”或“=”)。
(2)电化学法制备重铬酸钾
以净化后的铬酸钾(K2CrO4)为原料,用电化学法制备重铬酸钾的实验装置如图所示。
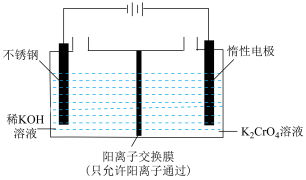
①不锈钢电极的电极反应式为___________ 。
②阳极区能得到重铬酸钾溶液的原因是___________ 。
(3)工业上常用钡盐沉淀法处理含有K2Cr2O7的废水,达到含铬废水达标排放、六价铬[Cr(Ⅵ)]回收利用、保护环境和节约资源的目的。已知 具体流程如下图所示:
具体流程如下图所示:

①从步骤i→Ⅱ生成沉淀2的总反应离子方程式为___________ 。
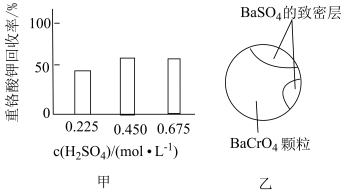
②向沉淀2中加入硫酸,回收Cr(Ⅵ)。加入不同浓度硫酸,每次均搅拌10小时,硫酸浓度对重铬酸的回收率如图甲所示。但当硫酸浓度高于 时,重铬酸的回收率没有明显变化,结合图乙分析其原因是
时,重铬酸的回收率没有明显变化,结合图乙分析其原因是___________ 。
 )。请回答下列问题:
)。请回答下列问题:(1)复分解法制备重铬酸钾
以Na2CrO4溶液为原料,步骤如下:
①先向Na2CrO4溶液中加入酸调节溶液pH,其目的是
②再向①的溶液中加入适量KCl,搅拌溶解、蒸发浓缩、冷却结晶,抽滤得到K2Cr2O7粗产品。则相同温度时的溶解度:Na2Cr2O7
(2)电化学法制备重铬酸钾
以净化后的铬酸钾(K2CrO4)为原料,用电化学法制备重铬酸钾的实验装置如图所示。

①不锈钢电极的电极反应式为
②阳极区能得到重铬酸钾溶液的原因是
(3)工业上常用钡盐沉淀法处理含有K2Cr2O7的废水,达到含铬废水达标排放、六价铬[Cr(Ⅵ)]回收利用、保护环境和节约资源的目的。已知
 具体流程如下图所示:
具体流程如下图所示:
①从步骤i→Ⅱ生成沉淀2的总反应离子方程式为
②向沉淀2中加入硫酸,回收Cr(Ⅵ)。加入不同浓度硫酸,每次均搅拌10小时,硫酸浓度对重铬酸的回收率如图甲所示。但当硫酸浓度高于
 时,重铬酸的回收率没有明显变化,结合图乙分析其原因是
时,重铬酸的回收率没有明显变化,结合图乙分析其原因是
您最近一年使用:0次
解题方法
7 . 工业上硫酸锰( )常作合成脂肪酸的催化剂。以软锰矿(主要成分为
)常作合成脂肪酸的催化剂。以软锰矿(主要成分为 ,还含有
,还含有 、
、 、CaO、
、CaO、 等)与废铁屑为原料制取硫酸锰的工艺流程如图所示,回答下列问题:
等)与废铁屑为原料制取硫酸锰的工艺流程如图所示,回答下列问题:

(1)“酸浸”前需要将软锰矿粉碎,理由是______ ,废铁屑先与稀硫酸反应生成 ,生成的
,生成的 再与
再与 反应,该过程中每生成
反应,该过程中每生成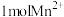 ,至少要消耗
,至少要消耗_______ 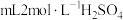 溶液。
溶液。
(2)“滤渣1”的主要成分是______ (填化学式,下同),“滤渣3”的主要成分是_______ 。
(3)“滤渣2”的主要成分为 和
和 ,从化学平衡的角度分析:加
,从化学平衡的角度分析:加 生成“滤渣2”的原因是
生成“滤渣2”的原因是___________ (用离子方程式结合文字表述)。
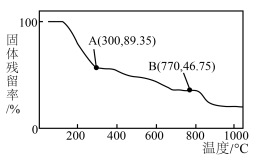
(4)在空气中加热 ,固体残留率随温度的变化如图所示。A点对应固体的成分为
,固体残留率随温度的变化如图所示。A点对应固体的成分为___________ (填化学式,下同),B点对应固体的成分为___________ 。
(5)工业上,常用惰性电极电解硫酸酸化的 溶液制取
溶液制取 。若外电路转移
。若外电路转移 (
( 为阿佛伽德罗常数的值)个电子,则理论上阳极获得
为阿佛伽德罗常数的值)个电子,则理论上阳极获得___________ 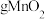 。
。
 )常作合成脂肪酸的催化剂。以软锰矿(主要成分为
)常作合成脂肪酸的催化剂。以软锰矿(主要成分为 ,还含有
,还含有 、
、 、CaO、
、CaO、 等)与废铁屑为原料制取硫酸锰的工艺流程如图所示,回答下列问题:
等)与废铁屑为原料制取硫酸锰的工艺流程如图所示,回答下列问题:
(1)“酸浸”前需要将软锰矿粉碎,理由是
 ,生成的
,生成的 再与
再与 反应,该过程中每生成
反应,该过程中每生成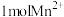 ,至少要消耗
,至少要消耗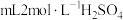 溶液。
溶液。(2)“滤渣1”的主要成分是
(3)“滤渣2”的主要成分为
 和
和 ,从化学平衡的角度分析:加
,从化学平衡的角度分析:加 生成“滤渣2”的原因是
生成“滤渣2”的原因是(4)在空气中加热
 ,固体残留率随温度的变化如图所示。A点对应固体的成分为
,固体残留率随温度的变化如图所示。A点对应固体的成分为
(5)工业上,常用惰性电极电解硫酸酸化的
 溶液制取
溶液制取 。若外电路转移
。若外电路转移 (
( 为阿佛伽德罗常数的值)个电子,则理论上阳极获得
为阿佛伽德罗常数的值)个电子,则理论上阳极获得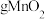 。
。
您最近一年使用:0次
名校
8 . 请回答下列问题:
(1)利用原电池装置可以验证 与
与 氧化性相对强弱,如图所示。写出该氧化还原反应的离子方程式:
氧化性相对强弱,如图所示。写出该氧化还原反应的离子方程式:___________ 。该装置中的负极材料是___________ (填化学式),正极反应式是___________ 。

(2)某研究性学习小组为证明 为可逆反应,设计如下两种方案(已知:酸性溶液中
为可逆反应,设计如下两种方案(已知:酸性溶液中 易被空气氧化为
易被空气氧化为 )。
)。

方案一:取 溶液,滴加
溶液,滴加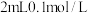 的
的 溶液,滴入5滴稀盐酸,再继续加入
溶液,滴入5滴稀盐酸,再继续加入 ,充分振荡、静置、分层,下层为紫红色,取上层清液,滴加
,充分振荡、静置、分层,下层为紫红色,取上层清液,滴加 溶液,现象是
溶液,现象是___________ ,即可证明该反应为可逆反应。你认为此方案___________ (“不严密”或“严密”),理由是___________ (用离子方程式表示)。
方案二:设计如图原电池装置,接通灵敏电流计,指针向右偏转,随着反应时间进行,电流计读数逐渐变小,最后读数变为零。当指针读数变零后,在右边的池子中加入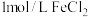 溶液,若灵敏电流计出现
溶液,若灵敏电流计出现___________ (答现象),即可证明该反应为可逆反应。你认为灵敏电流计“读数变为零”的原因是___________ 。
(1)利用原电池装置可以验证
 与
与 氧化性相对强弱,如图所示。写出该氧化还原反应的离子方程式:
氧化性相对强弱,如图所示。写出该氧化还原反应的离子方程式:
(2)某研究性学习小组为证明
 为可逆反应,设计如下两种方案(已知:酸性溶液中
为可逆反应,设计如下两种方案(已知:酸性溶液中 易被空气氧化为
易被空气氧化为 )。
)。
方案一:取
 溶液,滴加
溶液,滴加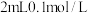 的
的 溶液,滴入5滴稀盐酸,再继续加入
溶液,滴入5滴稀盐酸,再继续加入 ,充分振荡、静置、分层,下层为紫红色,取上层清液,滴加
,充分振荡、静置、分层,下层为紫红色,取上层清液,滴加 溶液,现象是
溶液,现象是方案二:设计如图原电池装置,接通灵敏电流计,指针向右偏转,随着反应时间进行,电流计读数逐渐变小,最后读数变为零。当指针读数变零后,在右边的池子中加入
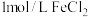 溶液,若灵敏电流计出现
溶液,若灵敏电流计出现
您最近一年使用:0次
名校
9 . 金属钴广泛应用于航空航天、电器制造等领域,是一种重要的战略金属,我国钴资源匮乏,绝大多数属于伴生矿。一种以进口水钴矿(主要成分为 ,杂质中
,杂质中 含量较高,还有少量
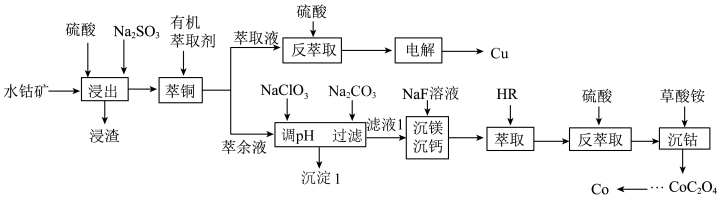
含量较高,还有少量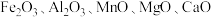 等)为原料提取钴和铜的工艺流程如图所示。
等)为原料提取钴和铜的工艺流程如图所示。
已知:①
卒铜原理: (
(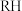 为有机萃取剂)
为有机萃取剂)
②部分阳离子以氢氧化物形式完全沉淀时溶液的 :
:
回答下列问题:
(1) 在元素周期表中的位置为
在元素周期表中的位置为___________ 。
(2)电解 溶液提取铜剩余的电解贫液(
溶液提取铜剩余的电解贫液( 稀溶液)可返回到
稀溶液)可返回到___________ 工序中。
(3) 仅用硫酸很难浸出,加入
仅用硫酸很难浸出,加入 后发生“还原浸出”,该反应的离子方程式为
后发生“还原浸出”,该反应的离子方程式为_____ 。
(4)沉淀1的主要成分有___________ ,用 调溶液的
调溶液的 范围是
范围是___________ 。
(5) 的作用是将溶液中的
的作用是将溶液中的 转化为
转化为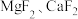 沉淀,若过滤后“滤液1”中
沉淀,若过滤后“滤液1”中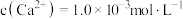 ,当除钙率达到
,当除钙率达到 时,溶液中
时,溶液中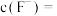
___________  。
。
(6) 萃取的反应原理为
萃取的反应原理为 ,向有机萃取剂中加入
,向有机萃取剂中加入 能进行反萃取的原因是
能进行反萃取的原因是___________ (结合平衡移动原理解释)。
 ,杂质中
,杂质中 含量较高,还有少量
含量较高,还有少量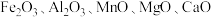 等)为原料提取钴和铜的工艺流程如图所示。
等)为原料提取钴和铜的工艺流程如图所示。
已知:①

卒铜原理:
 (
(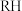 为有机萃取剂)
为有机萃取剂)②部分阳离子以氢氧化物形式完全沉淀时溶液的
 :
:| 金属离子 |  |  |  |  |  |
开始沉淀的 | 2.3 | 7.5 | 7.6 | 3.4 | 7.6 |
完全沉淀的 | 2.8 | 8.3 | 9.2 | 5.2 | 9.8 |
(1)
 在元素周期表中的位置为
在元素周期表中的位置为(2)电解
 溶液提取铜剩余的电解贫液(
溶液提取铜剩余的电解贫液( 稀溶液)可返回到
稀溶液)可返回到(3)
 仅用硫酸很难浸出,加入
仅用硫酸很难浸出,加入 后发生“还原浸出”,该反应的离子方程式为
后发生“还原浸出”,该反应的离子方程式为(4)沉淀1的主要成分有
 调溶液的
调溶液的 范围是
范围是(5)
 的作用是将溶液中的
的作用是将溶液中的 转化为
转化为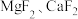 沉淀,若过滤后“滤液1”中
沉淀,若过滤后“滤液1”中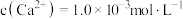 ,当除钙率达到
,当除钙率达到 时,溶液中
时,溶液中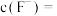
 。
。(6)
 萃取的反应原理为
萃取的反应原理为 ,向有机萃取剂中加入
,向有机萃取剂中加入 能进行反萃取的原因是
能进行反萃取的原因是
您最近一年使用:0次
10 . 乙酸乙酯是极好的工业溶剂,现用如图所示装置进行制备。
已知:I.由羧酸和醇反应生成酯的机理如下:
 (成质子化)
(成质子化)
II.乙醇可与CaCl2结合形成CaCl2·6C2H5OH难溶物。
(1)实验中乙醇要过量的目的是___________ 。
(2)实验中三颈烧瓶适合的容积为___________(填字母)。
(3)实验温度为80℃时产率最高,此时需要观察温度计___________ ( 填“a”或“b”)的读数,另一只温度计在___________ 操作中使用。
(4)选用FeCl3·6H2O作为催化剂,可不加入碎瓷片,原因是___________ 。根据羧酸和醇生成酯的反应机理推测,下列物质中可用作制备乙酸乙酯催化剂的是___________ (填字母)。
A.NaOH B.BaCl2 C.FeSO4 D.HIO4 (固体)
(5)对得到的粗产品提纯:
①向粗产品中加入碳酸钠粉末,至无___________ 气体逸出。
②向其中加入饱和氯化钙溶液,以除去___________
③向所得有机层中加入无水硫酸钠,以除去___________ ,过滤后再蒸馏,收集77℃左右的馏分。

已知:I.由羧酸和醇反应生成酯的机理如下:
 (成质子化)
(成质子化)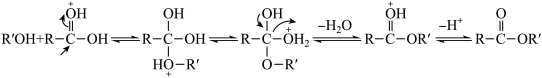
II.乙醇可与CaCl2结合形成CaCl2·6C2H5OH难溶物。
(1)实验中乙醇要过量的目的是
(2)实验中三颈烧瓶适合的容积为___________(填字母)。
| A.50mL | B.100 mL | C.250 mL | D.500 mL |
(4)选用FeCl3·6H2O作为催化剂,可不加入碎瓷片,原因是
A.NaOH B.BaCl2 C.FeSO4 D.HIO4 (固体)
(5)对得到的粗产品提纯:
①向粗产品中加入碳酸钠粉末,至无
②向其中加入饱和氯化钙溶液,以除去
③向所得有机层中加入无水硫酸钠,以除去
您最近一年使用:0次



