1 . 在FeCl3(aq)+3KSCN(aq) Fe(SCN)3(aq)+3KCl(aq)的平衡体系中,回答下列问题:(填“正向”、“逆向”、“不”)
Fe(SCN)3(aq)+3KCl(aq)的平衡体系中,回答下列问题:(填“正向”、“逆向”、“不”)
(1)在溶液中加入少量的KSCN固体,平衡_______ 移动。
(2)在溶液中加入少量的KCl固体,平衡_______ 移动。
(3)在溶液中加入少量的NaOH固体,平衡_______ 移动,理由是:_______ 。
 Fe(SCN)3(aq)+3KCl(aq)的平衡体系中,回答下列问题:(填“正向”、“逆向”、“不”)
Fe(SCN)3(aq)+3KCl(aq)的平衡体系中,回答下列问题:(填“正向”、“逆向”、“不”)(1)在溶液中加入少量的KSCN固体,平衡
(2)在溶液中加入少量的KCl固体,平衡
(3)在溶液中加入少量的NaOH固体,平衡
您最近一年使用:0次
2021-06-08更新
|
199次组卷
|
3卷引用:河南省许昌市鄢陵县职业教育中心2021-2022学年高二上学期第一次月考化学试题
河南省许昌市鄢陵县职业教育中心2021-2022学年高二上学期第一次月考化学试题云南省丽江市玉龙纳西族自治县田家炳民族中学2020-2021学年高二下学期第一次月考化学试题(已下线)第二章 第三节化学平衡(第2课时 化学平衡的影响因素)(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)(原卷版)
名校
2 . 工业中采用适当的催化剂利用反应CO(g)+2H2(g) CH3OH(g)来制取甲醇。温度为T℃时,在体积为2.0L的封闭容器内充入0.6molCO和0.4molH2,达到平衡时含有0.15molCH3OH(g),则该反应平衡常数K=
CH3OH(g)来制取甲醇。温度为T℃时,在体积为2.0L的封闭容器内充入0.6molCO和0.4molH2,达到平衡时含有0.15molCH3OH(g),则该反应平衡常数K=__ (保留两位小数),此时向容器中再通入0.7molCO气体,则此平衡将__ (填“正向”、“不”或“逆向”)移动。
 CH3OH(g)来制取甲醇。温度为T℃时,在体积为2.0L的封闭容器内充入0.6molCO和0.4molH2,达到平衡时含有0.15molCH3OH(g),则该反应平衡常数K=
CH3OH(g)来制取甲醇。温度为T℃时,在体积为2.0L的封闭容器内充入0.6molCO和0.4molH2,达到平衡时含有0.15molCH3OH(g),则该反应平衡常数K=
您最近一年使用:0次
3 . 燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)。污染跟冬季燃煤密切相关,SO2.CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)工业上可用CO2和H2反应合成甲醇。已知25°C、101 kPa下:
H2(g)+1/2O2(g)=H2O (g) △H1=-242kJ/mol
CH3OH+3/2O2(g) =CO2(g)+2H2O △H2=-676kJ/mol
写出CO2与H2反应生成CH3OH(g)与H2O (g)的热化学方程式_________________ 。
(2)工业上还可以通过下列反应制备甲醇:CO (g) +2H2 (g) CH3OH (g)。在一容积可变的密闭容器中充入l0molCO和20molH2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
CH3OH (g)。在一容积可变的密闭容器中充入l0molCO和20molH2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
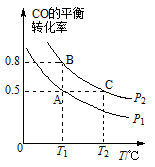
①下列说法不能判断该反应达到化学平衡状态的是____ (填字母)。
a. H2的消耗速率等于CH3OH的生成速率的2倍
b.H2的体积分数不再改变
c.体系中H2的转化率和CO的转化率相等
d.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA____ PB(填“>”“<”或“=”)。
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10 mol CO和20molH2,则在平衡状态B时容器的体积V(B)=________ L。
(3)SO2在一定条件下可与氧气构成原电池。下图是利用该电池在铁表面镀铜的装置示意图: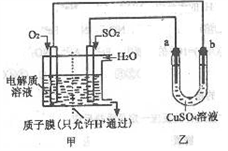
①该电池的负极反应:___________________ ;
②当甲中消耗2.24LO2(标准状况)时,乙中a极增重____ g。
(1)工业上可用CO2和H2反应合成甲醇。已知25°C、101 kPa下:
H2(g)+1/2O2(g)=H2O (g) △H1=-242kJ/mol
CH3OH+3/2O2(g) =CO2(g)+2H2O △H2=-676kJ/mol
写出CO2与H2反应生成CH3OH(g)与H2O (g)的热化学方程式
(2)工业上还可以通过下列反应制备甲醇:CO (g) +2H2 (g)
 CH3OH (g)。在一容积可变的密闭容器中充入l0molCO和20molH2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
CH3OH (g)。在一容积可变的密闭容器中充入l0molCO和20molH2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
①下列说法不能判断该反应达到化学平衡状态的是
a. H2的消耗速率等于CH3OH的生成速率的2倍
b.H2的体积分数不再改变
c.体系中H2的转化率和CO的转化率相等
d.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10 mol CO和20molH2,则在平衡状态B时容器的体积V(B)=
(3)SO2在一定条件下可与氧气构成原电池。下图是利用该电池在铁表面镀铜的装置示意图:

①该电池的负极反应:
②当甲中消耗2.24LO2(标准状况)时,乙中a极增重
您最近一年使用:0次



