硝酸是一种重要的化工原料,工业上生产硝酸的过程如下:
(1)以氮气、氢气为原料合成氨
①下列措施可以提高H2的转化率是(填选项序号)___________ 。
a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3 d.升高温度
②一定温度下,在密闭容器中充入1molN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,容器内的压强是原来的 15/16,则N2的转化率a1=_____________ ;若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2______ a1(填“>”、“<”或“=”)
(2)以氨气、空气为主要原料制硝酸。在容积恒定的密闭容器中进行反应2NO(g)+O2(g) 2NO2(g) △H>0,该反应的反应速率(v)随时间(t)变化的关系如下图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)
2NO2(g) △H>0,该反应的反应速率(v)随时间(t)变化的关系如下图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)_____________ 。
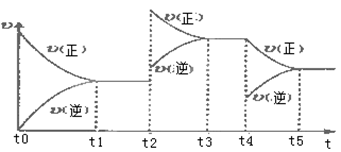
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时值的最大
(3)硝酸工厂用H2将NO2还原为N2
已知:2H2(g)+O2(g)=2H2O(g) △H=-483.5kJ/mol
N2(g)+2O2(g)=2NO2(g) △H=+133kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是___________________
(1)以氮气、氢气为原料合成氨
①下列措施可以提高H2的转化率是(填选项序号)
a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3 d.升高温度
②一定温度下,在密闭容器中充入1molN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,容器内的压强是原来的 15/16,则N2的转化率a1=
(2)以氨气、空气为主要原料制硝酸。在容积恒定的密闭容器中进行反应2NO(g)+O2(g)
 2NO2(g) △H>0,该反应的反应速率(v)随时间(t)变化的关系如下图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)
2NO2(g) △H>0,该反应的反应速率(v)随时间(t)变化的关系如下图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时值的最大
(3)硝酸工厂用H2将NO2还原为N2
已知:2H2(g)+O2(g)=2H2O(g) △H=-483.5kJ/mol
N2(g)+2O2(g)=2NO2(g) △H=+133kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是
18-19高二上·湖北宜昌·期末 查看更多[1]
(已下线)湖北省宜昌市葛洲坝中学2018-2019学年高二上学期期末考试化学试题
更新时间:2019-02-02 18:39:09
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】化学在能源开发与利用中起着十分关键的作用。
(1)下列制氢气方法中最节能的是___________(填序号)。
(2)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体。甲烷气体氧化和水汽化的热化学方程式分别为:
①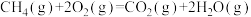
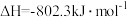
②
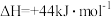
则3.2kg“可燃冰”(分子式为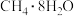 )释放的甲烷气体完全氧化生成二氧化碳气体和液态水时放出的热量为
)释放的甲烷气体完全氧化生成二氧化碳气体和液态水时放出的热量为___________ 。
(3)家用液化气的主要成分之一是丁烷(C4H10)。常温常压条件下,1g丁烷完全燃烧生成CO2气体和液态水时放出热量50kJ,则表示丁烷摩尔燃烧焓的热化学方程式为___________ 。(摩尔燃烧焓指在一定反应温度和压强下,1mol纯物质完全氧化为同温下的指定产物时的焓变)
(4)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中氧化生成固态三氧化二硼和液态水时放出649.5kJ热量,其热化学方程式为___________ 。
(5)标准摩尔生成焓是指在25℃和101kPa时,最稳定的单质生成1mol化合物的焓变。已知25℃和101kPa时下列反应:
①

②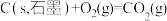

③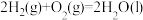

写出乙烷标准摩尔生成焓的焓变 =
=___________ (用含 、
、 、
、 的式子表示)。
的式子表示)。
(1)下列制氢气方法中最节能的是___________(填序号)。
A.电解水制氢气: |
B.高温使水分解制氢气: |
C.太阳光催化分解水制氢气: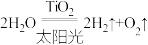 |
D.天然气制氢气: |
①
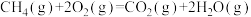
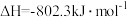
②

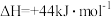
则3.2kg“可燃冰”(分子式为
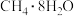 )释放的甲烷气体完全氧化生成二氧化碳气体和液态水时放出的热量为
)释放的甲烷气体完全氧化生成二氧化碳气体和液态水时放出的热量为(3)家用液化气的主要成分之一是丁烷(C4H10)。常温常压条件下,1g丁烷完全燃烧生成CO2气体和液态水时放出热量50kJ,则表示丁烷摩尔燃烧焓的热化学方程式为
(4)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中氧化生成固态三氧化二硼和液态水时放出649.5kJ热量,其热化学方程式为
(5)标准摩尔生成焓是指在25℃和101kPa时,最稳定的单质生成1mol化合物的焓变。已知25℃和101kPa时下列反应:
①


②
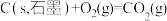

③
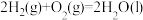

写出乙烷标准摩尔生成焓的焓变
 =
= 、
、 、
、 的式子表示)。
的式子表示)。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】回答下列问题
(1)为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
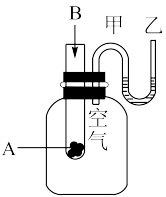
①该反应为___________ 反应(填“放热”或“吸热”)。
②A和B的总能量比C和D的总能量___________ (填“高”或“低”)。
(2)完成下列反应的热化学方程式。
已知:
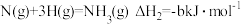
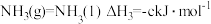
写出 和
和 反应生成液氨的热化学方程式
反应生成液氨的热化学方程式___________ 。
(3)写出 在水溶液中的电离方程式
在水溶液中的电离方程式___________ 。
(4)写出 的水解方程式
的水解方程式___________ 。
(1)为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:

①该反应为
②A和B的总能量比C和D的总能量
(2)完成下列反应的热化学方程式。
已知:

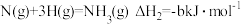
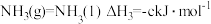
写出
 和
和 反应生成液氨的热化学方程式
反应生成液氨的热化学方程式(3)写出
 在水溶液中的电离方程式
在水溶液中的电离方程式(4)写出
 的水解方程式
的水解方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】(Ⅰ)已知工业上生产H2的过程中有如下反应: CO (g) + H2O (g) CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
(1)若增大H2O (g)的浓度,则CO的转化率_________ (填“增大”或“减小”)。
(2)若升高温度能使化学平衡向正反应方向移动,则正反应是____________ (填“放热”或“吸热”)反应。
(Ⅱ)煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的化学方程式为:
a.C(s)+O2(g) ═ CO2(g);△H═ E1 ①
b.C(s)+H2O(g) ═ CO(g)+H2(g);△H═ E2 ②
H2(g)+1/2 O2(g) ═H2O(g);△H═ E3 ③
CO(g)+1/2 O2(g) ═CO2(g);△H═ E4 ④
请回答:
⑴与途径a相比,途径b有较多的优点,即____________ 。
⑵上述四个热化学方程式中哪个反应的△H>0 ?_____________ 。
⑶等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是( )
A.a比b多 B.a比b少 C.a与b在理论上相同
⑷根据能量守恒定律,E1 、E2、 E3、E4之间的关系为________________________ 。
 CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:(1)若增大H2O (g)的浓度,则CO的转化率
(2)若升高温度能使化学平衡向正反应方向移动,则正反应是
(Ⅱ)煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的化学方程式为:
a.C(s)+O2(g) ═ CO2(g);△H═ E1 ①
b.C(s)+H2O(g) ═ CO(g)+H2(g);△H═ E2 ②
H2(g)+1/2 O2(g) ═H2O(g);△H═ E3 ③
CO(g)+1/2 O2(g) ═CO2(g);△H═ E4 ④
请回答:
⑴与途径a相比,途径b有较多的优点,即
⑵上述四个热化学方程式中哪个反应的△H>0 ?
⑶等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是
A.a比b多 B.a比b少 C.a与b在理论上相同
⑷根据能量守恒定律,E1 、E2、 E3、E4之间的关系为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g) 2C(g)+2D(g) ΔH,2 min末达到平衡,生成0.8 mol D。
2C(g)+2D(g) ΔH,2 min末达到平衡,生成0.8 mol D。
(1)300 ℃时,该反应的平衡常数表达式为:K=___________________ 。已知K300℃>K350℃,则ΔH______ 0(填“<”或“>”)
(2)在2 min末时,B的平衡浓度为________ ,D的平均反应速率为________ 。
(3)若温度不变,缩小容器容积,则A的转化率______ (填“增大”“减小”或“不变”),原因是_____________________________________________________________ 。
(4)如果在相同的条件下,上述反应从逆反应方向进行,开始时加入C、D各4/3mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B______ mol。
 2C(g)+2D(g) ΔH,2 min末达到平衡,生成0.8 mol D。
2C(g)+2D(g) ΔH,2 min末达到平衡,生成0.8 mol D。(1)300 ℃时,该反应的平衡常数表达式为:K=
(2)在2 min末时,B的平衡浓度为
(3)若温度不变,缩小容器容积,则A的转化率
(4)如果在相同的条件下,上述反应从逆反应方向进行,开始时加入C、D各4/3mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】接触法制硫酸工艺中,主反应在450℃并有催化剂存在下进行:
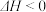
(1)恒温恒容条件下,下列能说明此反应已达平衡的是________ 。
①
②容器中气体的平均摩尔质量不随时间而变化
③容器中气体的密度不随时间而变化
④容器中气体分子总数不随时间而变化
(2)下列有关该反应速率的叙述中,正确的是_________ 。
a. 升高温度可以增大活化分子百分数,加快反应速率
b. 使用催化剂提高二氧化硫的转化率
c. 使用催化剂可以使反应物分子平均能量升高,加快反应速率
d. 缩小容器体积增大压强不能增大活化分子百分数,但可以加快反应速率
(3)下图表示将 和
和 置于2L密闭容器中,当其他条件一定时,
置于2L密闭容器中,当其他条件一定时, 的平衡转化率a随X的变化关系,
的平衡转化率a随X的变化关系, 代表压强或温度。X代表的物理量是
代表压强或温度。X代表的物理量是___________ 。A对应条件下平衡常数K=___________ 。

(4)一定温度下,在容积不变的密闭容器中充入 和
和 ,达平衡时
,达平衡时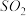 的体积分数为a%,其他条件不变时,若按下列四种配比作为起始物质,平衡后
的体积分数为a%,其他条件不变时,若按下列四种配比作为起始物质,平衡后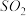 的体积分数仍为a%的是
的体积分数仍为a%的是__________ 。
a. b.
b. 
c. d.
d. 
(5)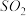 与
与 反应生成
反应生成 ,
, 电离方程式为
电离方程式为___________ ,向 溶液中加入
溶液中加入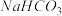 固体,则电离平衡往
固体,则电离平衡往__________ 反应方向移动。

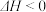
(1)恒温恒容条件下,下列能说明此反应已达平衡的是
①

②容器中气体的平均摩尔质量不随时间而变化
③容器中气体的密度不随时间而变化
④容器中气体分子总数不随时间而变化
(2)下列有关该反应速率的叙述中,正确的是
a. 升高温度可以增大活化分子百分数,加快反应速率
b. 使用催化剂提高二氧化硫的转化率
c. 使用催化剂可以使反应物分子平均能量升高,加快反应速率
d. 缩小容器体积增大压强不能增大活化分子百分数,但可以加快反应速率
(3)下图表示将
 和
和 置于2L密闭容器中,当其他条件一定时,
置于2L密闭容器中,当其他条件一定时, 的平衡转化率a随X的变化关系,
的平衡转化率a随X的变化关系, 代表压强或温度。X代表的物理量是
代表压强或温度。X代表的物理量是
(4)一定温度下,在容积不变的密闭容器中充入
 和
和 ,达平衡时
,达平衡时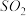 的体积分数为a%,其他条件不变时,若按下列四种配比作为起始物质,平衡后
的体积分数为a%,其他条件不变时,若按下列四种配比作为起始物质,平衡后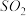 的体积分数仍为a%的是
的体积分数仍为a%的是a.
 b.
b. 
c.
 d.
d. 
(5)
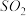 与
与 反应生成
反应生成 ,
, 电离方程式为
电离方程式为 溶液中加入
溶液中加入 固体,则电离平衡往
固体,则电离平衡往
您最近一年使用:0次
【推荐3】一定条件下,CO2和CO可以互相转化
(1)某温度下,在容积为2L的密闭容器按甲、乙两种方式投入反应物发生反应:CO2(g)+H2(g) CO(g)+H2O(g)。
CO(g)+H2O(g)。
甲容器15min后达到平衡,此时CO2的转化率为75%,则0-15min内平均反应速率 (H2)=
(H2)=______ ,此条件下该反应的平衡常数K=______ 。欲使平衡后乙与甲中相同组分气体的体积分数相等,则w、x、y、z需满足的关系是________________ ,且________________ (用含y的等式表示)。
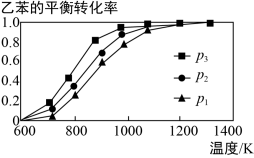
(2)研究表明,温度、压强对反应C6H5CH2CH3(g)+CO2(g) C6H5CH=CH2(g)+CO(g)+H2O(g) ΔH中乙苯的平衡转化率影响如下图所示:则ΔH
C6H5CH=CH2(g)+CO(g)+H2O(g) ΔH中乙苯的平衡转化率影响如下图所示:则ΔH ______ 0(填“>”“< ” 或“=”),压强p1、p2、p3从大到小的顺序是________________ 。
(3)CO可被NO2氧化CO+NO2 CO2+NO。当温度高于225℃时,反应速率
CO2+NO。当温度高于225℃时,反应速率 正=k正·c(CO) ·c(NO2)、
正=k正·c(CO) ·c(NO2)、 逆= k逆·c(CO2) ·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为
逆= k逆·c(CO2) ·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为______ 。
(1)某温度下,在容积为2L的密闭容器按甲、乙两种方式投入反应物发生反应:CO2(g)+H2(g)
 CO(g)+H2O(g)。
CO(g)+H2O(g)。| 容器 | 反应物 |
| 甲 | 8molCO2(g)、16molH2(g) |
| 乙 | wmolCO2(g)、xmolH2(g)、ymolCO(g)、zmolH2O(g) |
甲容器15min后达到平衡,此时CO2的转化率为75%,则0-15min内平均反应速率
 (H2)=
(H2)=
(2)研究表明,温度、压强对反应C6H5CH2CH3(g)+CO2(g)
 C6H5CH=CH2(g)+CO(g)+H2O(g) ΔH中乙苯的平衡转化率影响如下图所示:则ΔH
C6H5CH=CH2(g)+CO(g)+H2O(g) ΔH中乙苯的平衡转化率影响如下图所示:则ΔH (3)CO可被NO2氧化CO+NO2
 CO2+NO。当温度高于225℃时,反应速率
CO2+NO。当温度高于225℃时,反应速率 正=k正·c(CO) ·c(NO2)、
正=k正·c(CO) ·c(NO2)、 逆= k逆·c(CO2) ·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为
逆= k逆·c(CO2) ·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】知反应mA(g)+nB(g) pC(g) ΔH<0,m+n<p,当反应达到平衡后,有关物质的浓度发生改变,其反应速率的变化曲线分别如下图所示:
pC(g) ΔH<0,m+n<p,当反应达到平衡后,有关物质的浓度发生改变,其反应速率的变化曲线分别如下图所示:


回答下列问题:
(1)表示反应物浓度增大的图象是________ ,表示反应物浓度减小的图象是________ ,表示生成物浓度增大的图象是________ ,表示生成物浓度减小的图象是________ 。
(2)表示平衡正向移动的图象是________ ,表示平衡逆向移动的图象是________ 。
 pC(g) ΔH<0,m+n<p,当反应达到平衡后,有关物质的浓度发生改变,其反应速率的变化曲线分别如下图所示:
pC(g) ΔH<0,m+n<p,当反应达到平衡后,有关物质的浓度发生改变,其反应速率的变化曲线分别如下图所示:

回答下列问题:
(1)表示反应物浓度增大的图象是
(2)表示平衡正向移动的图象是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】在2 L的密闭容器中发生反应后各物质的物质的量随时间变化的曲线如图所示。

回答下列问题:
(1)该反应的反应物和生成物分别是_______________ ,反应方程式为_______ 。
(2)0~10 s的平均反应速率v(H2)=________ v(HI)=____________________ 。
(3)根据上述反应速率数值,分析用不同物质表示同一化学反应在同一时间内,化学反应速率值是否必须相同?_________________________________________ 。
(4)能否用I2(s)表达该反应的反应速率,为什么?__________________________ 。

回答下列问题:
(1)该反应的反应物和生成物分别是
(2)0~10 s的平均反应速率v(H2)=
(3)根据上述反应速率数值,分析用不同物质表示同一化学反应在同一时间内,化学反应速率值是否必须相同?
(4)能否用I2(s)表达该反应的反应速率,为什么?
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】Ⅰ、一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g) + 2 H2(g)  CH3OH(g)
CH3OH(g)
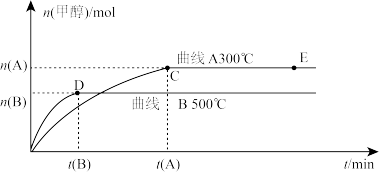
不同温度时甲醇的物质的量随时间变化曲线如上图所示。根据题意完成下列各题:
(1)反应达到平衡时,升高温度,化学平衡常数K值____________ (填“增大”、“减小”或“不变”)。
(2)在其他条件不变的情况下,将E点的体系体积压缩到原来的 ,下列有关该体系的说法正确的是
,下列有关该体系的说法正确的是___________
a 氢气的浓度减小 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时n(H2)/n(CH3OH)增大 e 平衡常数K增大
Ⅱ、在1 L的密闭容器中,进行反应到:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
(3)将0.1 mol CO与0.1 mol H2O混合加热到800℃,一段时间后该反应达到平衡,测得CO2的物质的量为0.053 mol,若将混合气体加热至830℃,平衡时CO2的物质的量_____ (填“大于”、“等于”或“小于”)0.053 mol。
(4)800℃时,放入CO、H2O、CO2、H2,其物质的量分别为:0.01、0.01、0.01、0.01mol。则反应CO2(g)+H2(g) CO(g)+H2O(g)向
CO(g)+H2O(g)向_________ (填“正反应”或“逆反应”)方向进行。
 CH3OH(g)
CH3OH(g)
不同温度时甲醇的物质的量随时间变化曲线如上图所示。根据题意完成下列各题:
(1)反应达到平衡时,升高温度,化学平衡常数K值
(2)在其他条件不变的情况下,将E点的体系体积压缩到原来的
 ,下列有关该体系的说法正确的是
,下列有关该体系的说法正确的是a 氢气的浓度减小 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时n(H2)/n(CH3OH)增大 e 平衡常数K增大
Ⅱ、在1 L的密闭容器中,进行反应到:CO2(g)+H2(g)
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:| T(℃) | 700 | 800 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.7 | 2.6 |
(4)800℃时,放入CO、H2O、CO2、H2,其物质的量分别为:0.01、0.01、0.01、0.01mol。则反应CO2(g)+H2(g)
 CO(g)+H2O(g)向
CO(g)+H2O(g)向
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】对于可逆反应2A(?)+B(g) 2C(g);下图是其它条件一定时反应中C的百分含量与压强的关系曲线。回答下列问题:
2C(g);下图是其它条件一定时反应中C的百分含量与压强的关系曲线。回答下列问题:

(1)物质A的状态是_________ (填“气体”、“液体”或“固体”);
(2)图-1中a、b、c、d四点中表示未达到平衡状态且v正<v逆 的点是_____ ;
(3)v(a)、v(b)、v(c)按由大到小排序_________________ ;
(4)对于2SO2(g)+O2(g) 2SO3(g);ΔH=-198 kJ/mol。在实际生产过程中,原料气中SO2为7%(体积分数)、O2为11%,常压下进行,控制温度在450℃左右。
2SO3(g);ΔH=-198 kJ/mol。在实际生产过程中,原料气中SO2为7%(体积分数)、O2为11%,常压下进行,控制温度在450℃左右。
请问原料气中SO2与O2的体积比不是2∶1,而要7∶11(大约2∶3)的原因是___________ ;如果在恒容容器中,仅把另外82%的其他气体“抽出来”,是否会减小SO2的转化率__________ (填“会”或“不会”)。
 2C(g);下图是其它条件一定时反应中C的百分含量与压强的关系曲线。回答下列问题:
2C(g);下图是其它条件一定时反应中C的百分含量与压强的关系曲线。回答下列问题:
(1)物质A的状态是
(2)图-1中a、b、c、d四点中表示未达到平衡状态且v正<v逆 的点是
(3)v(a)、v(b)、v(c)按由大到小排序
(4)对于2SO2(g)+O2(g)
 2SO3(g);ΔH=-198 kJ/mol。在实际生产过程中,原料气中SO2为7%(体积分数)、O2为11%,常压下进行,控制温度在450℃左右。
2SO3(g);ΔH=-198 kJ/mol。在实际生产过程中,原料气中SO2为7%(体积分数)、O2为11%,常压下进行,控制温度在450℃左右。请问原料气中SO2与O2的体积比不是2∶1,而要7∶11(大约2∶3)的原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】利用太阳能光解水,制备的H2用于还原CO2可以在一定条件下合成CH3OH(不考虑副反应),CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0,可实现资源的再利用。回答下列问题:
(1)某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol·L-1和3 a mol·L-1,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的值为_______ 。
(2)恒压下,CO2和H2的起始物质的量比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O。
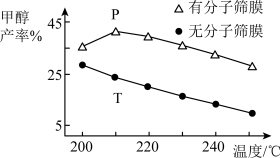
①甲醇平衡产率随温度升高而降低的原因为_______ 。
②P点甲醇产率高于T点的原因为_______ 。
③根据上图,在此条件下采用该分子筛膜时的最佳反应温度为_______ °C。
(1)某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol·L-1和3 a mol·L-1,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的值为
(2)恒压下,CO2和H2的起始物质的量比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O。

①甲醇平衡产率随温度升高而降低的原因为
②P点甲醇产率高于T点的原因为
③根据上图,在此条件下采用该分子筛膜时的最佳反应温度为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】I.现有下列物质①熔化的NaCl②盐酸③氯气④冰醋酸⑤铜⑥酒精⑦硫酸氢钠⑧液氨⑨SO2⑩Al2O3,请按要求回答下列问题。
(1)属于强电解质的是_______ (填序号)
(2)在上述状态下能导电的是_______ (填序号)
(3)属于非电解质,但溶于水后的水溶液能导电的是_______ (填序号)
II.工业合成氨N2(g)+3H2(g) 2NH3(g) ∆H=-92.2kJ∙mol-1,一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示:
2NH3(g) ∆H=-92.2kJ∙mol-1,一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示:
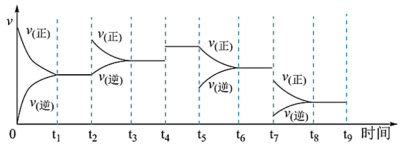
(4)其中 t4时刻所对应的实验条件改变是_____ ,t5时刻所对应的实验条件改变是_____ ,平衡常数最大的时间段是_____ 。
(5)为了提高平衡混合物中氨的含量,根据化学平衡移动原理,仅从理论上分析合成氨适宜的条件是_______(填字母)。
(6)实际生产中一般采用的反应条件为400~500℃,原因是_______ 。
(1)属于强电解质的是
(2)在上述状态下能导电的是
(3)属于非电解质,但溶于水后的水溶液能导电的是
II.工业合成氨N2(g)+3H2(g)
 2NH3(g) ∆H=-92.2kJ∙mol-1,一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示:
2NH3(g) ∆H=-92.2kJ∙mol-1,一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示:
(4)其中 t4时刻所对应的实验条件改变是
(5)为了提高平衡混合物中氨的含量,根据化学平衡移动原理,仅从理论上分析合成氨适宜的条件是_______(填字母)。
| A.高温低压 | B.低温高压 | C.高温高压 | D.低温低压 |
您最近一年使用:0次



