1 . 下列实验方案设计、现象和结论都正确且有因果关系的是
| 选项 | 实验方案 | 现象 | 结论 |
| A | 向外拉动装有 和 和 的注射器 的注射器 | 气体颜色变浅 | 减小压强,平衡向气体分子数增大的方向移动 |
| B | 往碘的 溶液中加入等体积的浓KI溶液,振荡 溶液中加入等体积的浓KI溶液,振荡 | 分层,下层由紫红色变为浅粉红色,上层呈棕黄色 | 碘在浓KI溶液中的溶解能力大于在 中的溶解能力 中的溶解能力 |
| C | 向2mL 0.1  溶液中先滴加4滴0.1 溶液中先滴加4滴0.1 KCl溶液,观察现象,振荡试管,再滴加4滴0.1 KCl溶液,观察现象,振荡试管,再滴加4滴0.1 ¹ KI溶液 ¹ KI溶液 | 先产生白色沉淀,再产生黄色沉淀 | AgCl转化为AgI,AgI溶解度小于AgCl溶解度 |
| D | 将 (卤代烃)与NaOH溶液共热,冷却后取上层水溶液,加入 (卤代烃)与NaOH溶液共热,冷却后取上层水溶液,加入 溶液 溶液 | 观察沉淀颜色 | 证明 中的卤素原子的种类 中的卤素原子的种类 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 氢能是一种重要的绿色能源,在实现“碳中和”与“碳达峰”目标中起到重要作用。
Ⅰ.甲醇―水催化重整可获得氢气。
(1)表中数据是该反应中相关物质的标准摩尔生成焓(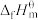 )数据(标准摩尔生成焓是指在298.15K、100kPa下由稳定态单质生成1mol化合物时的焓变)。
)数据(标准摩尔生成焓是指在298.15K、100kPa下由稳定态单质生成1mol化合物时的焓变)。
则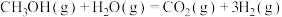 △H=
△H=___________ kJ∙mol-1,该反应在___________ (填“高温”“低温”或“任意温度”)下能自发进行。
Ⅱ.乙醇―水催化重整亦可获得,主要反应如下:
反应①: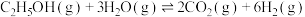
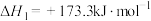
反应②:
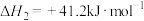
(2)向恒容密闭容器中充入1mol 和3mol
和3mol 发生上述反应①和②,初始时体系压强为100kPa.平衡时
发生上述反应①和②,初始时体系压强为100kPa.平衡时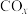 的分布分数
的分布分数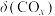 、
、 的产率随温度的变化曲线如图所示。
的产率随温度的变化曲线如图所示。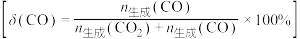
___________ (写出2条)。
②200℃以后,解释曲线a随温度变化趋势的原因:___________ 。
③温度为500℃时,反应经10min达到平衡,此时乙醇的转化率为60%,则0~10min内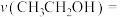
___________ kPa∙min-1,该温度下,反应②的Kp=___________ (保留小数点后两位)。
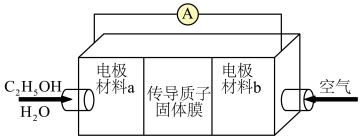
(3)乙醇燃料电池(电极材料a和b均为惰性电极)广泛应用于微型电源、能源汽车、家用电源、国防等领域,工作原理如图所示,写出负极的电极反应式:___________ ,当转移1.2mol电子时,正极消耗的氧气的体积为___________ L(标准状况下)。
Ⅰ.甲醇―水催化重整可获得氢气。
(1)表中数据是该反应中相关物质的标准摩尔生成焓(
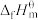 )数据(标准摩尔生成焓是指在298.15K、100kPa下由稳定态单质生成1mol化合物时的焓变)。
)数据(标准摩尔生成焓是指在298.15K、100kPa下由稳定态单质生成1mol化合物时的焓变)。| 物质 |  |  |  |  |
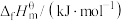 | 0 | ―393.5 | ―241.8 | ―200.7 |
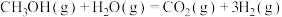 △H=
△H=Ⅱ.乙醇―水催化重整亦可获得,主要反应如下:
反应①:
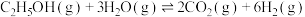
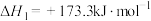
反应②:

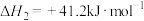
(2)向恒容密闭容器中充入1mol
 和3mol
和3mol 发生上述反应①和②,初始时体系压强为100kPa.平衡时
发生上述反应①和②,初始时体系压强为100kPa.平衡时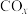 的分布分数
的分布分数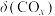 、
、 的产率随温度的变化曲线如图所示。
的产率随温度的变化曲线如图所示。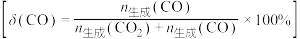
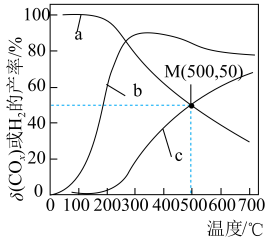
②200℃以后,解释曲线a随温度变化趋势的原因:
③温度为500℃时,反应经10min达到平衡,此时乙醇的转化率为60%,则0~10min内
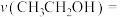
(3)乙醇燃料电池(电极材料a和b均为惰性电极)广泛应用于微型电源、能源汽车、家用电源、国防等领域,工作原理如图所示,写出负极的电极反应式:
您最近一年使用:0次
2024-05-19更新
|
113次组卷
|
4卷引用:T29-原理综合题
解题方法
3 . 乙酸相对乙醇廉价易得,乙酸催化加氢制乙醇的反应如下:
主反应: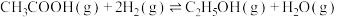

副反应: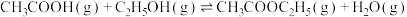
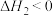
已知:Ⅰ.该副反应的热效应很小;
Ⅱ.S表示产物选择性,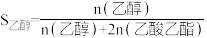 ,
,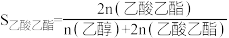
回答下列问题:
(1)一定温度下,将1mol 、2mol
、2mol 通入恒压密闭容器中(不考虑副反应)。达到平衡时
通入恒压密闭容器中(不考虑副反应)。达到平衡时 的转化率为10%,该反应放热QkJ,则
的转化率为10%,该反应放热QkJ,则
_______  。
。
(2)在恒温、恒压下,原料气通过某催化剂发生上述反应,投料比对反应的影响如图甲所示。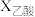 表示乙酸的转化率,最佳投料比
表示乙酸的转化率,最佳投料比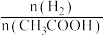 为
为_______ 。当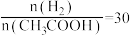 时,
时, 曲线可延伸至E、F、G中的
曲线可延伸至E、F、G中的_______ 点;投料比=20时, 的转化率=
的转化率=_______ 。
(3)当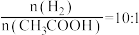 时在不同条件下达到平衡。在
时在不同条件下达到平衡。在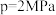 下的
下的 、
、 ~t在
~t在 下的
下的 、
、 ~p如图乙所示:
~p如图乙所示: 随t变化的曲线是
随t变化的曲线是_______ (填标号),曲线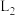 变化的原因是
变化的原因是_______ 。A、B、C三点对应的 的转化率由大到小的顺序为
的转化率由大到小的顺序为_______ 。已知B点时对应 的转化率为
的转化率为 ,则B点时副反应的平衡常数
,则B点时副反应的平衡常数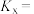
_______ 。150℃, 和
和 反应一段时间后,
反应一段时间后, 的选择性位于M点,不改变反应时间和温度,一定能提高
的选择性位于M点,不改变反应时间和温度,一定能提高 选择性的措施为
选择性的措施为_______ (填一条即可)。
主反应:
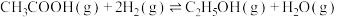

副反应:
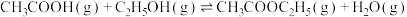
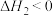
已知:Ⅰ.该副反应的热效应很小;
Ⅱ.S表示产物选择性,
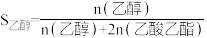 ,
,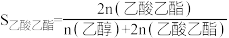
回答下列问题:
(1)一定温度下,将1mol
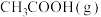 、2mol
、2mol 通入恒压密闭容器中(不考虑副反应)。达到平衡时
通入恒压密闭容器中(不考虑副反应)。达到平衡时 的转化率为10%,该反应放热QkJ,则
的转化率为10%,该反应放热QkJ,则
 。
。(2)在恒温、恒压下,原料气通过某催化剂发生上述反应,投料比对反应的影响如图甲所示。
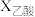 表示乙酸的转化率,最佳投料比
表示乙酸的转化率,最佳投料比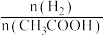 为
为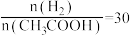 时,
时, 曲线可延伸至E、F、G中的
曲线可延伸至E、F、G中的 的转化率=
的转化率=(3)当
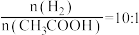 时在不同条件下达到平衡。在
时在不同条件下达到平衡。在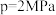 下的
下的 、
、 ~t在
~t在 下的
下的 、
、 ~p如图乙所示:
~p如图乙所示: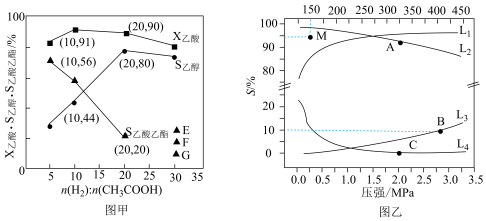
 随t变化的曲线是
随t变化的曲线是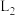 变化的原因是
变化的原因是 的转化率由大到小的顺序为
的转化率由大到小的顺序为 的转化率为
的转化率为 ,则B点时副反应的平衡常数
,则B点时副反应的平衡常数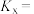
 和
和 反应一段时间后,
反应一段时间后, 的选择性位于M点,不改变反应时间和温度,一定能提高
的选择性位于M点,不改变反应时间和温度,一定能提高 选择性的措施为
选择性的措施为
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
4 . 探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
I.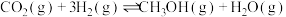
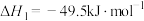
Ⅱ.

Ⅲ.

回答下列问题:
(1)不同压强下,按照 投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。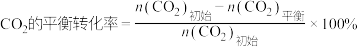
CH3OH的平衡产率=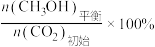
其中纵坐标表示CO2平衡转化率的是图___________ (填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为___________ ;图乙中T1温度时,三条曲线几乎交于一点的原因是___________ 。
(2)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为___________(填标号)。
I.
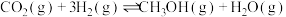
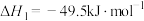
Ⅱ.


Ⅲ.


回答下列问题:
(1)不同压强下,按照
 投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。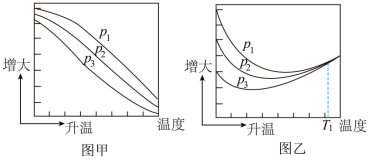
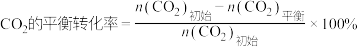
CH3OH的平衡产率=
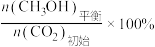
其中纵坐标表示CO2平衡转化率的是图
(2)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为___________(填标号)。
| A.低温、高压 | B.高温、低压 | C.低温、低压 | D.高温、高压 |
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
5 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。我国科学家研究 加氢制备甲醇方面取得一定进展。在一定温度和压强下,
加氢制备甲醇方面取得一定进展。在一定温度和压强下, 加氢制备甲醇的过程中主要发生如下三个反应,请回答以下问题:
加氢制备甲醇的过程中主要发生如下三个反应,请回答以下问题:
反应I.
反应II.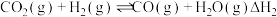
反应III.
(1)有利于提高甲醇平衡产率的措施有___________ (至少回答2条)。
(2)T℃时,将 的混合气体充入压强为6MPa的恒压密闭容器中,在催化剂的作用下发生反应II和反应III:
的混合气体充入压强为6MPa的恒压密闭容器中,在催化剂的作用下发生反应II和反应III:
反应II:
反应III: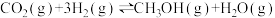
反应达到平衡状态时,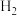 和
和 的分压相等,甲醇的选择性是
的分压相等,甲醇的选择性是 的2倍,则
的2倍,则 的平衡转化率为
的平衡转化率为___________ 。
 加氢制备甲醇方面取得一定进展。在一定温度和压强下,
加氢制备甲醇方面取得一定进展。在一定温度和压强下, 加氢制备甲醇的过程中主要发生如下三个反应,请回答以下问题:
加氢制备甲醇的过程中主要发生如下三个反应,请回答以下问题:反应I.

反应II.
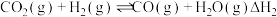
反应III.

(1)有利于提高甲醇平衡产率的措施有
(2)T℃时,将
 的混合气体充入压强为6MPa的恒压密闭容器中,在催化剂的作用下发生反应II和反应III:
的混合气体充入压强为6MPa的恒压密闭容器中,在催化剂的作用下发生反应II和反应III:反应II:

反应III:
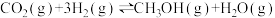
反应达到平衡状态时,
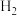 和
和 的分压相等,甲醇的选择性是
的分压相等,甲醇的选择性是 的2倍,则
的2倍,则 的平衡转化率为
的平衡转化率为
您最近一年使用:0次
6 . 一定条件下可合成乙烯:6H2(g)+2CO2(g)⇌CH2=CH2 (g)+4H2O(g) 已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是
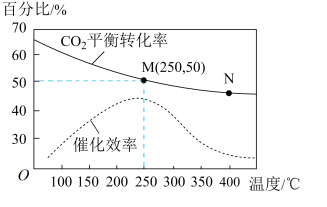
| A.温度不变,若增大压强,ν正>ν逆,平衡常数增大 |
| B.升高温度,平衡向逆反应方向移动,催化剂的催化效率降低 |
| C.温度不变,若恒压下向平衡体系中充入惰性气体,平衡不移动 |
| D.若投料比n(H2):n(CO2)=3:1,则图中 M点乙烯的体积分数为7.7% |
您最近一年使用:0次
2024-04-02更新
|
598次组卷
|
4卷引用:通关练08 聚焦反应热、速率及化学平衡-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
(已下线)通关练08 聚焦反应热、速率及化学平衡-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)(已下线)题型7 化学反应速率与化学平衡 水溶液中的离子反应与平衡(25题)-2024年高考化学常考点必杀300题(新高考通用)安徽省示范高中皖北协作区2024届高三联考化学试题安徽省部分学校2023-2024学年高三下学期3月联考化学试题
7 . 异丁烯 是重要的化工生产原料,可由异丁烷
是重要的化工生产原料,可由异丁烷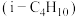 催化脱氢制备,反应如下:
催化脱氢制备,反应如下: .
.
已知:①主要副反应为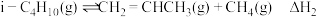

②温度过高会引发烃裂解生成炭(C).
③相关化学键的键能如下所示:
请回答:
(1)
_________  .
.
(2)有利于提高异丁烷平衡转化率的条件有_________ .
A.低温 B.高温 C.低压 D.高压 E.催化剂
(3)其他条件相同,在恒压的密闭容器中充入异丁烷和 各
各 (
( 作惰性气体),经过相同时间测得相关数据如图1和图2所示.[收率
作惰性气体),经过相同时间测得相关数据如图1和图2所示.[收率 ,空速
,空速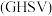 :单位时间通过单位体积催化剂的气体量](不考虑温度对催化剂活性的影响,异丁烷分子在催化剂表面能较快吸附)
:单位时间通过单位体积催化剂的气体量](不考虑温度对催化剂活性的影响,异丁烷分子在催化剂表面能较快吸附) 时异丁烯收率=
时异丁烯收率=_________ .
②下列说法正确的是_________ .
A.由图1可知,温度越高,产生异丁烯的速率越快
B.混入 的目的之一是减小异丁烷的吸附速率,同时带走催化剂局部多余的热量,从而抑制催化剂的积碳
的目的之一是减小异丁烷的吸附速率,同时带走催化剂局部多余的热量,从而抑制催化剂的积碳
C.图2中,空速增加,异丁烷转化率降低的原因可能是原料气在催化剂中停留时间过短
D.图2中,空速增加,异丁烯选择性升高的原因可能是原料气将产物迅速带走,抑制了副反应的发生
③图1中,随着温度升高,异丁烷转化率增大而异丁烯选择性下降的原因可能是_________ .
④其他条件相同,异丁烷的平衡转化率如图3所示.若充入 改为
改为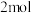 ,在图3中作出异丁烷的平衡转化率随温度变化的曲线
,在图3中作出异丁烷的平衡转化率随温度变化的曲线______ (忽略积碳的影响).
 是重要的化工生产原料,可由异丁烷
是重要的化工生产原料,可由异丁烷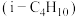 催化脱氢制备,反应如下:
催化脱氢制备,反应如下: .
.已知:①主要副反应为
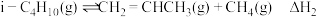

②温度过高会引发烃裂解生成炭(C).
③相关化学键的键能如下所示:
化学键 |
|
|
|
|
键能/ | 615 | 347.7 | 413.4 | 436 |
(1)

 .
.(2)有利于提高异丁烷平衡转化率的条件有
A.低温 B.高温 C.低压 D.高压 E.催化剂
(3)其他条件相同,在恒压的密闭容器中充入异丁烷和
 各
各 (
( 作惰性气体),经过相同时间测得相关数据如图1和图2所示.[收率
作惰性气体),经过相同时间测得相关数据如图1和图2所示.[收率 ,空速
,空速 :单位时间通过单位体积催化剂的气体量](不考虑温度对催化剂活性的影响,异丁烷分子在催化剂表面能较快吸附)
:单位时间通过单位体积催化剂的气体量](不考虑温度对催化剂活性的影响,异丁烷分子在催化剂表面能较快吸附) 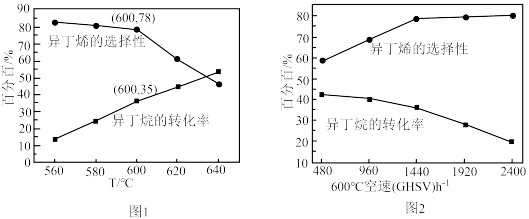
 时异丁烯收率=
时异丁烯收率=②下列说法正确的是
A.由图1可知,温度越高,产生异丁烯的速率越快
B.混入
 的目的之一是减小异丁烷的吸附速率,同时带走催化剂局部多余的热量,从而抑制催化剂的积碳
的目的之一是减小异丁烷的吸附速率,同时带走催化剂局部多余的热量,从而抑制催化剂的积碳C.图2中,空速增加,异丁烷转化率降低的原因可能是原料气在催化剂中停留时间过短
D.图2中,空速增加,异丁烯选择性升高的原因可能是原料气将产物迅速带走,抑制了副反应的发生
③图1中,随着温度升高,异丁烷转化率增大而异丁烯选择性下降的原因可能是
④其他条件相同,异丁烷的平衡转化率如图3所示.若充入
 改为
改为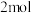 ,在图3中作出异丁烷的平衡转化率随温度变化的曲线
,在图3中作出异丁烷的平衡转化率随温度变化的曲线
您最近一年使用:0次
2024-04-01更新
|
371次组卷
|
4卷引用:压轴题13 化学反应原理综合题(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
(已下线)压轴题13 化学反应原理综合题(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)2024届浙江省温州市高三下学期第二次适应性考试(二模)化学试题浙江省温州市普通高中2024届高三下学期第二次适应性考试(二模)化学试题(已下线)化学(浙江卷01)-2024年高考押题预测卷
8 . 卤素化合物在生产生活中应用广泛,回答下列问题
(1)研究表明 气体中存在单体和环状六聚体的平衡:
气体中存在单体和环状六聚体的平衡: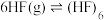 ,HF形成环状六聚体的作用力是
,HF形成环状六聚体的作用力是____________ ;在测定 相对分子质量的实验中,
相对分子质量的实验中,____________ (填“低压”或“高压”)有利于测定的准确性.
(2) 气体是高效绿色消毒剂,但其性质不稳定,浓度大时会发生爆炸.可用草酸
气体是高效绿色消毒剂,但其性质不稳定,浓度大时会发生爆炸.可用草酸 和氯酸钾
和氯酸钾 在酸性条件下制备
在酸性条件下制备 ,离子方程式为
,离子方程式为__________ ;产物中的另一种气体可以起到的作用是________________ .
(3) 与
与 以共价键形成
以共价键形成 ,其中
,其中________ 显负电性, 与水反应的方程式是
与水反应的方程式是____________ .
(4)利用 和浓磷酸制备
和浓磷酸制备 的原理是:
的原理是: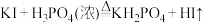 ,该反应中利用了浓磷酸的什么性质:
,该反应中利用了浓磷酸的什么性质:________ (“强酸性”“强氧化性”“高沸点”).
(1)研究表明
 气体中存在单体和环状六聚体的平衡:
气体中存在单体和环状六聚体的平衡: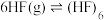 ,HF形成环状六聚体的作用力是
,HF形成环状六聚体的作用力是 相对分子质量的实验中,
相对分子质量的实验中,(2)
 气体是高效绿色消毒剂,但其性质不稳定,浓度大时会发生爆炸.可用草酸
气体是高效绿色消毒剂,但其性质不稳定,浓度大时会发生爆炸.可用草酸 和氯酸钾
和氯酸钾 在酸性条件下制备
在酸性条件下制备 ,离子方程式为
,离子方程式为(3)
 与
与 以共价键形成
以共价键形成 ,其中
,其中 与水反应的方程式是
与水反应的方程式是(4)利用
 和浓磷酸制备
和浓磷酸制备 的原理是:
的原理是: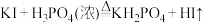 ,该反应中利用了浓磷酸的什么性质:
,该反应中利用了浓磷酸的什么性质:
您最近一年使用:0次
名校
9 . 某温度下,向恒温、恒压容器中充入 和
和 ,在催化剂作用下发生反应:
,在催化剂作用下发生反应:
 ,平衡时体系中
,平衡时体系中 、
、 和
和 的物质的量分数(x)与平衡总压的关系如图所示。下列说法不正确的是
的物质的量分数(x)与平衡总压的关系如图所示。下列说法不正确的是
 和
和 ,在催化剂作用下发生反应:
,在催化剂作用下发生反应:
 ,平衡时体系中
,平衡时体系中 、
、 和
和 的物质的量分数(x)与平衡总压的关系如图所示。下列说法不正确的是
的物质的量分数(x)与平衡总压的关系如图所示。下列说法不正确的是
A.曲线a可表示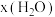 随压强的变化情况 随压强的变化情况 |
| B.其他条件不变,及时分离出水蒸气,有利于平衡正向移动,但平衡常数不变 |
C.Q点 的转化率为75% 的转化率为75% |
D.将容器改为恒容容器,平衡时: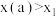 |
您最近一年使用:0次
13-14高二上·河南漯河·期中
10 . 可逆反应 进行过程中,当其他条件不变时,
进行过程中,当其他条件不变时, 的体积分数
的体积分数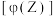 与温度
与温度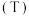 、压强
、压强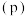 的关系如图所示。下列叙述正确的是
的关系如图所示。下列叙述正确的是
 进行过程中,当其他条件不变时,
进行过程中,当其他条件不变时, 的体积分数
的体积分数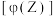 与温度
与温度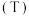 、压强
、压强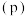 的关系如图所示。下列叙述正确的是
的关系如图所示。下列叙述正确的是
A.达到平衡后,加入催化剂, 的体积分数增大 的体积分数增大 |
| B.达到平衡后,升高温度,平衡向逆反应方向移动 |
C.化学方程式中,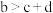 |
D.达到平衡后,增加 的量,平衡向正反应方向移动 的量,平衡向正反应方向移动 |
您最近一年使用:0次
2024-03-11更新
|
106次组卷
|
22卷引用:解密10 化学反应速率与化学平衡(教师版)——备战2018年高考化学之高频考点解密
(已下线)解密10 化学反应速率与化学平衡(教师版)——备战2018年高考化学之高频考点解密(已下线)2013-2014学年河南省漯河市高二上学期期中考试化学试卷(已下线)2013-2014学年江苏省南师附中江宁分校高二上学期选修期末化学试卷河北省大名县第一中学2017-2018学年高二上学期第一次月考化学试题吉林省实验中学2017-2018学年高二上学期期中考试化学试题甘肃省岷县一中2018-2019学年高二上学期期中考试化学试题江西省宜春市宜丰中学2018-2019学年高二上学期期末考试化学试题浙江省丽水四校联考2019年6月高二阶段性考试化学试题四川省自贡市田家炳中学2019-2020学年高二上学期期中考试化学试题河北省沧州市泊头市第一中学2019-2020学年高二月考检测化学试题河北省泊头市第一中学2019-2020学年高二上学期期末模拟考试化学试卷黑龙江省哈尔滨师范大学青冈实验中学校2018-2019学年高二上学期开学考试化学试题湖北省华中师范大学潜江附属中学2019-2020学年高一5月月考化学试题广东省深圳市福田区外国语高级中学2021-2022学年高二上学期期中考试化学试题浙江省温州新力量联盟2021-2022学年高二上学期期中联考化学试题新疆乌鲁木齐市第八中学2021-2022学年高二上学期第二次月考化学试题黑龙江省鹤岗市第一中学2021-2022学年高二上学期期末考试化学试题陕西省宝鸡市渭滨区2021-2022学年高二上学期期末考试化学试题浙江省东阳中学2021-2022学年高二下学期期末考试化学试题安徽省合肥市第一中学2022-2023学年高一下学期5月期中考试化学试题广东省佛山市顺德区勒流中学、均安中学、龙江中学等十五校2023-2024学年高二上学期12月联考化学试题湖南省岳阳市岳阳县第一中学2023-2024学年高一下学期4月期中考试化学试题







