名校
解题方法
1 . 已知反应:
反应①: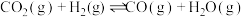
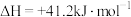
反应②: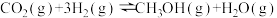
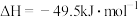
反应③:
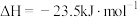
在2 MPa,起始投料 时,CO2的平衡转化率及CH3OCH3和CH3OH的平衡体积分数随温度变化如图-1所示。
时,CO2的平衡转化率及CH3OCH3和CH3OH的平衡体积分数随温度变化如图-1所示。

(1)①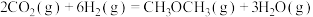 ΔH=
ΔH=___________
②从453-553℃,升高温度CO2平衡转化率降低的原因是___________ 。
③为提高单位时间内CH3OCH3产率。研发的催化剂需具备的特点是___________ 。
(2)在催化剂作用下,二甲醚还原NO的反应原理为 ΔH<0。在有氧和无氧的环境下,NO的去除率随温度变化如图-2所示。
ΔH<0。在有氧和无氧的环境下,NO的去除率随温度变化如图-2所示。
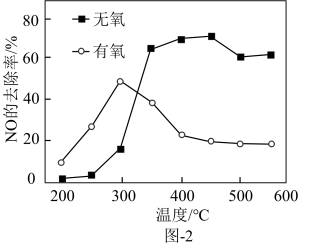
①无氧环境下,在250~450℃范围内随着温度的升高,NO的去除率先迅速上升后上升缓慢的主要原因是___________ 。
②温度高于400℃时,NO去除率明显低于无氧环境的可能原因有___________ 。
反应①:
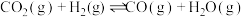
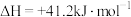
反应②:
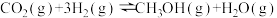
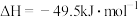
反应③:

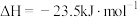
在2 MPa,起始投料
 时,CO2的平衡转化率及CH3OCH3和CH3OH的平衡体积分数随温度变化如图-1所示。
时,CO2的平衡转化率及CH3OCH3和CH3OH的平衡体积分数随温度变化如图-1所示。
(1)①
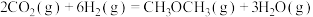 ΔH=
ΔH=②从453-553℃,升高温度CO2平衡转化率降低的原因是
③为提高单位时间内CH3OCH3产率。研发的催化剂需具备的特点是
(2)在催化剂作用下,二甲醚还原NO的反应原理为
 ΔH<0。在有氧和无氧的环境下,NO的去除率随温度变化如图-2所示。
ΔH<0。在有氧和无氧的环境下,NO的去除率随温度变化如图-2所示。
①无氧环境下,在250~450℃范围内随着温度的升高,NO的去除率先迅速上升后上升缓慢的主要原因是
②温度高于400℃时,NO去除率明显低于无氧环境的可能原因有
您最近一年使用:0次
名校
解题方法
2 .  在化工生产中有重要作用.天然气法合成
在化工生产中有重要作用.天然气法合成 相关反应如下:
相关反应如下:
反应I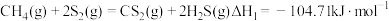
反应Ⅱ
(1) 、
、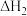 随温度变化不大。温度不同时,反应体系中
随温度变化不大。温度不同时,反应体系中 不同。合成
不同。合成 总反应
总反应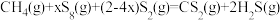 的
的 随温度T变化如图。
随温度T变化如图。
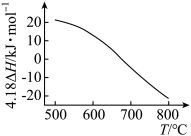
①

________  。
。
②为提高 平衡转化率,控制温度范围在
平衡转化率,控制温度范围在________ (填标号),理由是________ 。
A.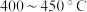 B.
B.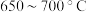 C.
C.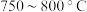 D.
D. 以上
以上
(2)合成 总反应中硫蒸气达到饱和时,反应时间t与
总反应中硫蒸气达到饱和时,反应时间t与 初始浓度
初始浓度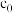 和
和 转化率
转化率 满足关系
满足关系 ,式中k为速率常数。
,式中k为速率常数。
① 、
、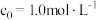 时,测得
时,测得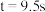 、
、 ,则
,则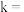
________ 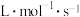 。
。
② 时,计划在
时,计划在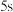 内转化率达
内转化率达 ,应控制初始浓度
,应控制初始浓度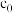 大于
大于________  。
。
(3)利用工业废气 替代硫磺矿生产
替代硫磺矿生产 的反应为
的反应为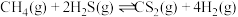 。反应物投料比采用
。反应物投料比采用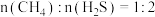 ,维持体系压强为
,维持体系压强为 ,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图。
,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图。
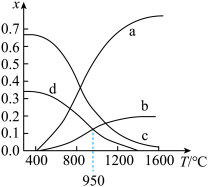
①图中表示 的曲线是
的曲线是________ (填“a”“b”“c”或“d”)。
② 时,该反应的
时,该反应的
________ (以分压表示,分压 总压
总压 物质的量分数)。
物质的量分数)。
③相比以硫磺矿为原料,使用 的优点是
的优点是________ ,缺点是________ 。
 在化工生产中有重要作用.天然气法合成
在化工生产中有重要作用.天然气法合成 相关反应如下:
相关反应如下:反应I
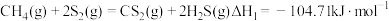
反应Ⅱ

(1)
 、
、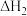 随温度变化不大。温度不同时,反应体系中
随温度变化不大。温度不同时,反应体系中 不同。合成
不同。合成 总反应
总反应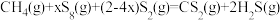 的
的 随温度T变化如图。
随温度T变化如图。
①


 。
。②为提高
 平衡转化率,控制温度范围在
平衡转化率,控制温度范围在A.
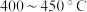 B.
B.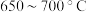 C.
C.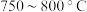 D.
D. 以上
以上(2)合成
 总反应中硫蒸气达到饱和时,反应时间t与
总反应中硫蒸气达到饱和时,反应时间t与 初始浓度
初始浓度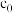 和
和 转化率
转化率 满足关系
满足关系 ,式中k为速率常数。
,式中k为速率常数。①
 、
、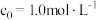 时,测得
时,测得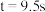 、
、 ,则
,则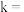
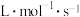 。
。②
 时,计划在
时,计划在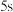 内转化率达
内转化率达 ,应控制初始浓度
,应控制初始浓度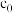 大于
大于 。
。(3)利用工业废气
 替代硫磺矿生产
替代硫磺矿生产 的反应为
的反应为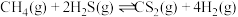 。反应物投料比采用
。反应物投料比采用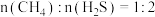 ,维持体系压强为
,维持体系压强为 ,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图。
,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图。
①图中表示
 的曲线是
的曲线是②
 时,该反应的
时,该反应的
 总压
总压 物质的量分数)。
物质的量分数)。③相比以硫磺矿为原料,使用
 的优点是
的优点是
您最近一年使用:0次
2023-03-08更新
|
885次组卷
|
3卷引用:福建省厦门市2023届高三毕业班3月第二次质量检测化学试题
3 . 由 与
与 制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由
制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由 人工合成淀粉(节选途径见下图)中的重要反应之一。
人工合成淀粉(节选途径见下图)中的重要反应之一。
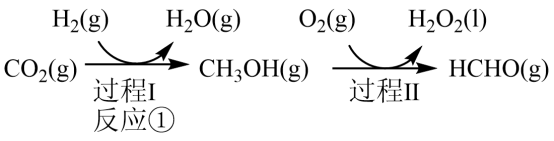
已知:
反应②:
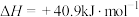 ;
;
反应③:
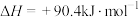 。
。
(1)反应①的热化学方程式为_______ ;若过程II中 得到4mol电子,则理论上可生成
得到4mol电子,则理论上可生成_______ mol HCHO。
(2)反应①在有、无催化剂条件下的反应历程如下图所示,其中吸附在催化剂表面上的物种用*标注,TS为过渡态。
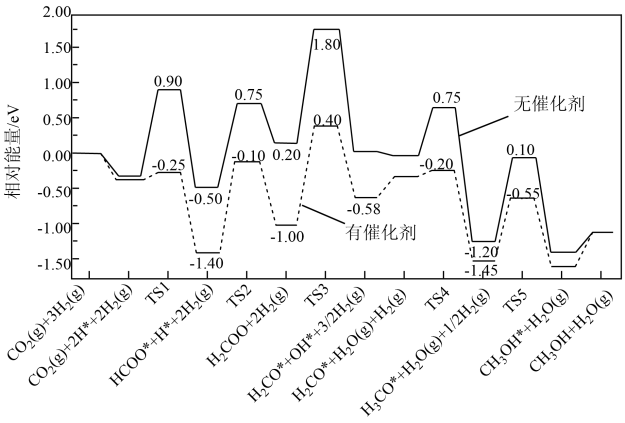
该反应历程中决速步骤的化学方程式为_______ ,催化剂使该步骤的活化能降低_______ eV。
(3)某研究小组采用上述催化剂,向密闭容器中通入 和
和 ,只发生反应①和反应②,在不同条件下达到平衡,在T=300℃下甲醇的体积分数
,只发生反应①和反应②,在不同条件下达到平衡,在T=300℃下甲醇的体积分数 随压强p的变化、在p=600kPa下
随压强p的变化、在p=600kPa下 随温度T的变化,如下图所示。
随温度T的变化,如下图所示。

i.下列说法正确的是_______ (填标号)。
A.曲线a为等压线,曲线b为等温线
B.增大 与
与 的浓度,反应①和反应②的正反应速率都增大
的浓度,反应①和反应②的正反应速率都增大
C.反应①的平衡常数:K(X)=K(Y)
D.反应②的正反应速率:v(X)<v(M)
ii.已知M点:容器中 为
为 ,CO为
,CO为 ,则此时
,则此时 的分压为
的分压为_______ kPa,反应①的压强平衡常数
_______  (压强平衡常数
(压强平衡常数 是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。
是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。
iii.图中M点的 高于N点的原因是
高于N点的原因是_______ 。
 与
与 制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由
制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由 人工合成淀粉(节选途径见下图)中的重要反应之一。
人工合成淀粉(节选途径见下图)中的重要反应之一。
已知:
反应②:

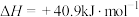 ;
;反应③:

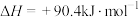 。
。(1)反应①的热化学方程式为
 得到4mol电子,则理论上可生成
得到4mol电子,则理论上可生成(2)反应①在有、无催化剂条件下的反应历程如下图所示,其中吸附在催化剂表面上的物种用*标注,TS为过渡态。

该反应历程中决速步骤的化学方程式为
(3)某研究小组采用上述催化剂,向密闭容器中通入
 和
和 ,只发生反应①和反应②,在不同条件下达到平衡,在T=300℃下甲醇的体积分数
,只发生反应①和反应②,在不同条件下达到平衡,在T=300℃下甲醇的体积分数 随压强p的变化、在p=600kPa下
随压强p的变化、在p=600kPa下 随温度T的变化,如下图所示。
随温度T的变化,如下图所示。
i.下列说法正确的是
A.曲线a为等压线,曲线b为等温线
B.增大
 与
与 的浓度,反应①和反应②的正反应速率都增大
的浓度,反应①和反应②的正反应速率都增大C.反应①的平衡常数:K(X)=K(Y)
D.反应②的正反应速率:v(X)<v(M)
ii.已知M点:容器中
 为
为 ,CO为
,CO为 ,则此时
,则此时 的分压为
的分压为
 (压强平衡常数
(压强平衡常数 是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。
是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。iii.图中M点的
 高于N点的原因是
高于N点的原因是
您最近一年使用:0次
2022-03-31更新
|
997次组卷
|
4卷引用:福建省永春第一中学2023届高三下学期期初考试化学试题
福建省永春第一中学2023届高三下学期期初考试化学试题广东省2021-2022学年高三下学期一模化学试题广东省普通高中2022届高三学业水平选择考化学模拟测试(一)(已下线)押广东卷化学第19题 化学反应原理综合题-备战2022年高考化学临考题号押题(广东卷)
解题方法
4 . 人类过多地使用化石燃料,造成了二氧化碳的大量排放,致使地球气温上升。二氧化碳是温室气体,也是一种重要的资源,如以CO2为基本原料可合成甲醇。回答下列问题:
(1)已知下列热化学方程式:
ⅰ.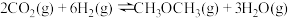

ⅱ.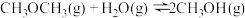

则ⅲ.
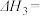
________ 
(2)Deluzarche等人在吸附有氢气的 催化剂上通入CO2发生反应,该过程的反应机理如下:
催化剂上通入CO2发生反应,该过程的反应机理如下:
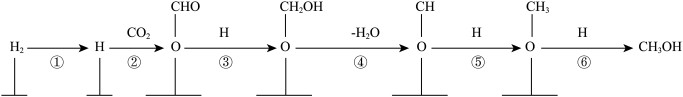
其中涉及非极性键变化的过程是______ (填上图中的数字序号),写出上述过程中总反应的化学方程式:_____ 。
(3)一定条件下,向某密闭容器中按照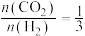 投料,发生反应ⅲ,反应达到平衡时,容器中甲醇的体积分数与压强、温度的关系如下图所示:
投料,发生反应ⅲ,反应达到平衡时,容器中甲醇的体积分数与压强、温度的关系如下图所示:
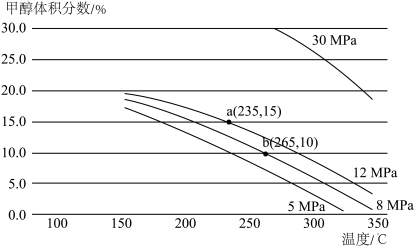
由上图可知,反应物的转化率与压强的关系是:压强增大,CO2的转化率________ (填“减小”“不变”或“增大”),温度为265℃时的平衡常数Kp=________  (Kp为用分压表示的平衡常数,分压=总压×体积分数)(保留小数点后四位)。
(Kp为用分压表示的平衡常数,分压=总压×体积分数)(保留小数点后四位)。
(4)将一定量的 、
、 混合气体通入某密闭容器中,在催化剂作用下生成
混合气体通入某密闭容器中,在催化剂作用下生成 ,不同压强下,平衡时混合气体中
,不同压强下,平衡时混合气体中 的体积分数随温度的变化如图所示。
的体积分数随温度的变化如图所示。

则A、B、C三点的平衡常数由大到小的顺序为____ (用 、
、 、
、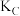 表示),E点变为D点的措施是
表示),E点变为D点的措施是____ 。
(5)以特殊的纳米材料为电极,一定浓度的硫酸作为电解质溶液, 为原料通过电化学方法可制得甲醇,则生成甲醇的电极反应式为
为原料通过电化学方法可制得甲醇,则生成甲醇的电极反应式为_____ 。
(1)已知下列热化学方程式:
ⅰ.
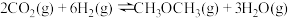

ⅱ.
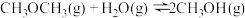

则ⅲ.

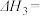

(2)Deluzarche等人在吸附有氢气的
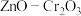 催化剂上通入CO2发生反应,该过程的反应机理如下:
催化剂上通入CO2发生反应,该过程的反应机理如下:
其中涉及非极性键变化的过程是
(3)一定条件下,向某密闭容器中按照
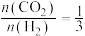 投料,发生反应ⅲ,反应达到平衡时,容器中甲醇的体积分数与压强、温度的关系如下图所示:
投料,发生反应ⅲ,反应达到平衡时,容器中甲醇的体积分数与压强、温度的关系如下图所示:
由上图可知,反应物的转化率与压强的关系是:压强增大,CO2的转化率
 (Kp为用分压表示的平衡常数,分压=总压×体积分数)(保留小数点后四位)。
(Kp为用分压表示的平衡常数,分压=总压×体积分数)(保留小数点后四位)。(4)将一定量的
 、
、 混合气体通入某密闭容器中,在催化剂作用下生成
混合气体通入某密闭容器中,在催化剂作用下生成 ,不同压强下,平衡时混合气体中
,不同压强下,平衡时混合气体中 的体积分数随温度的变化如图所示。
的体积分数随温度的变化如图所示。
则A、B、C三点的平衡常数由大到小的顺序为
 、
、 、
、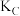 表示),E点变为D点的措施是
表示),E点变为D点的措施是(5)以特殊的纳米材料为电极,一定浓度的硫酸作为电解质溶液,
 为原料通过电化学方法可制得甲醇,则生成甲醇的电极反应式为
为原料通过电化学方法可制得甲醇,则生成甲醇的电极反应式为
您最近一年使用:0次
名校
解题方法
5 . 氢气既是一种优质的能源,又是一种重要化工原料,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,甲烷和水蒸气反应的热化学方程式是:
CH2(g)+2H2O(g)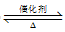 CO2(g)+4H2(g) △H=+165.0kJ·mol-1
CO2(g)+4H2(g) △H=+165.0kJ·mol-1
已知反应器中存在如下反应过程:
I.CH4(g)+H2O(g) CO(g)+3H2(g) △H1=+206.4kJ·mol-1
CO(g)+3H2(g) △H1=+206.4kJ·mol-1
II.CO(g)+H2O(g) CO2(g)+H2(g) △H2
CO2(g)+H2(g) △H2
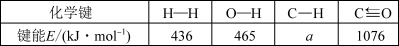
根据上述信息计算:a=___ 、△H2=___ 。
(2)某温度下,4molH2O和lmolCH4在体积为2L的刚性容器内同时发生I、II反应,达平衡时,体系中n(CO)=bmol、n(CO2)=dmol,则该温度下反应I的平衡常数K值为___ (用字母表示)。
(3)欲增大CH4转化为H2的平衡转化率,可采取的措施有___ (填标号)。
A.适当增大反应物投料比武n(H2O):n(CH4)
B.提高压强
C.分离出CO2
(4)H2用于工业合成氨:N2+3H2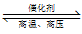 2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是
2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是___ 。

某温度下,n(N2):n(H2)=1:3的混合气体在刚性容器内发生反应,起始气体总压为2×l07Pa,平衡时总压为开始的90%,则H2的转化率为___ ,气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数(记作Kp),此温度下,该反应的化学平衡常数Kp=___ (分压列计算式、不化简)。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,甲烷和水蒸气反应的热化学方程式是:
CH2(g)+2H2O(g)
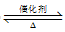 CO2(g)+4H2(g) △H=+165.0kJ·mol-1
CO2(g)+4H2(g) △H=+165.0kJ·mol-1已知反应器中存在如下反应过程:
I.CH4(g)+H2O(g)
 CO(g)+3H2(g) △H1=+206.4kJ·mol-1
CO(g)+3H2(g) △H1=+206.4kJ·mol-1II.CO(g)+H2O(g)
 CO2(g)+H2(g) △H2
CO2(g)+H2(g) △H2
根据上述信息计算:a=
(2)某温度下,4molH2O和lmolCH4在体积为2L的刚性容器内同时发生I、II反应,达平衡时,体系中n(CO)=bmol、n(CO2)=dmol,则该温度下反应I的平衡常数K值为
(3)欲增大CH4转化为H2的平衡转化率,可采取的措施有
A.适当增大反应物投料比武n(H2O):n(CH4)
B.提高压强
C.分离出CO2
(4)H2用于工业合成氨:N2+3H2
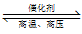 2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是
2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是
某温度下,n(N2):n(H2)=1:3的混合气体在刚性容器内发生反应,起始气体总压为2×l07Pa,平衡时总压为开始的90%,则H2的转化率为
您最近一年使用:0次
2020-01-02更新
|
607次组卷
|
7卷引用:福建省莆田二中2020-2021学年高三上学期期中检测化学试题
福建省莆田二中2020-2021学年高三上学期期中检测化学试题四省八校2020届高三上学期第一次教学质量检测理综化学试题2020届高三《新题速递·化学》1月第02期(考点11-13)【百强校】江西省南昌市第十中学2020届高三下学期综合模拟考试化学试题(已下线)考点06 化学能与热能-2020年高考化学命题预测与模拟试题分类精编广西壮族自治区桂林市第十八中学2021届高三上学期第一次月考理综化学试题(已下线)04 化学反应原理综合题型集训之多重平衡中的Kp计算(解析)-备战2023年高考化学大题逐空突破系列(全国通用)



