已知反应:
反应①: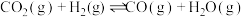
反应②: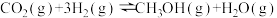
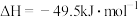
反应③:
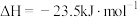
在2 MPa,起始投料 时,CO2的平衡转化率及CH3OCH3和CH3OH的平衡体积分数随温度变化如图-1所示。
时,CO2的平衡转化率及CH3OCH3和CH3OH的平衡体积分数随温度变化如图-1所示。

(1)①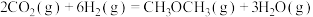 ΔH=
ΔH=___________
②从453-553℃,升高温度CO2平衡转化率降低的原因是___________ 。
③为提高单位时间内CH3OCH3产率。研发的催化剂需具备的特点是___________ 。
(2)在催化剂作用下,二甲醚还原NO的反应原理为 ΔH<0。在有氧和无氧的环境下,NO的去除率随温度变化如图-2所示。
ΔH<0。在有氧和无氧的环境下,NO的去除率随温度变化如图-2所示。
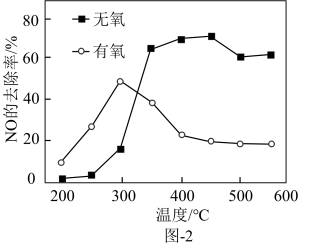
①无氧环境下,在250~450℃范围内随着温度的升高,NO的去除率先迅速上升后上升缓慢的主要原因是___________ 。
②温度高于400℃时,NO去除率明显低于无氧环境的可能原因有___________ 。
反应①:
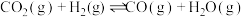
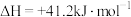
反应②:
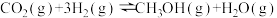
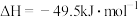
反应③:

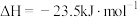
在2 MPa,起始投料
 时,CO2的平衡转化率及CH3OCH3和CH3OH的平衡体积分数随温度变化如图-1所示。
时,CO2的平衡转化率及CH3OCH3和CH3OH的平衡体积分数随温度变化如图-1所示。
(1)①
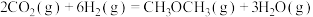 ΔH=
ΔH=②从453-553℃,升高温度CO2平衡转化率降低的原因是
③为提高单位时间内CH3OCH3产率。研发的催化剂需具备的特点是
(2)在催化剂作用下,二甲醚还原NO的反应原理为
 ΔH<0。在有氧和无氧的环境下,NO的去除率随温度变化如图-2所示。
ΔH<0。在有氧和无氧的环境下,NO的去除率随温度变化如图-2所示。
①无氧环境下,在250~450℃范围内随着温度的升高,NO的去除率先迅速上升后上升缓慢的主要原因是
②温度高于400℃时,NO去除率明显低于无氧环境的可能原因有
更新时间:2023-06-26 23:53:19
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】某校化学兴趣小组对CO2、NO2进行了深入的研究。
(1)加热KNO3晶体时生成固体KNO2和O2,没有生成红棕色NO2,且每生成11.2L O2(标况)吸收29kJ热量,已知碳的燃烧热为394kJ/mol,该兴趣小组在模拟黑火药爆炸反应时,忘记加硫,KNO3晶体与碳也发生了反应,其热化学方程式为2KNO3(s) +C(s)=2KNO2(s)+CO2(g) ΔH=a kJ/mol,则a=___ 。
(2)该兴趣小组同学对反应4CO(g)+2NO2(g)⇌N2(g)+4CO2(g)进行了研究,保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况如图所示。

①则b点时,投料n(CO):n(NO2)=_____ ;a、b、c三点NO2的转化率由小到大的顺序为_____ 。
②若在体积为2L的密闭体积不变的容器中,加入2molNO2和一定物质的量的CO,达到平衡点b,b点对应的N2的体积分数为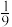 ,则此时n(N2)为
,则此时n(N2)为 _____ 。
(3)向恒容密闭容器中通入一定量NO2,发生反应2NO2(g)⇌N2O4(g),达到平衡后,降低温度,混合气体颜色变浅。
①若需要测定NO2的相对分子质量,为了测定更准确,则需要的外界条件为_______ 。
②该反应平衡时的变化规律如图所示。若X为压强,则Y为_______ (答出一条即可)。
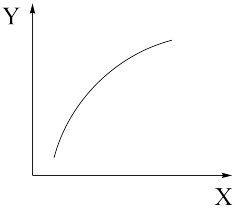
③该反应达到平衡时,向恒容密闭容器中通入一定量NO2,则再次达到平衡时,NO2的物质的量分数将_______ (填“升高”“不变”“降低”)。
(1)加热KNO3晶体时生成固体KNO2和O2,没有生成红棕色NO2,且每生成11.2L O2(标况)吸收29kJ热量,已知碳的燃烧热为394kJ/mol,该兴趣小组在模拟黑火药爆炸反应时,忘记加硫,KNO3晶体与碳也发生了反应,其热化学方程式为2KNO3(s) +C(s)=2KNO2(s)+CO2(g) ΔH=a kJ/mol,则a=
(2)该兴趣小组同学对反应4CO(g)+2NO2(g)⇌N2(g)+4CO2(g)进行了研究,保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况如图所示。

①则b点时,投料n(CO):n(NO2)=
②若在体积为2L的密闭体积不变的容器中,加入2molNO2和一定物质的量的CO,达到平衡点b,b点对应的N2的体积分数为
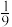 ,则此时n(N2)为
,则此时n(N2)为 (3)向恒容密闭容器中通入一定量NO2,发生反应2NO2(g)⇌N2O4(g),达到平衡后,降低温度,混合气体颜色变浅。
①若需要测定NO2的相对分子质量,为了测定更准确,则需要的外界条件为
②该反应平衡时的变化规律如图所示。若X为压强,则Y为

③该反应达到平衡时,向恒容密闭容器中通入一定量NO2,则再次达到平衡时,NO2的物质的量分数将
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】羰基硫(COS)作为一种粮食熏蒸剂广泛应用于农药工业。利用工厂废气中的H2S和CO反应可以合成COS,回答下列问题:
(1)已知:
①2H2(g)+O2(g)= 2H2O(g) ΔH1= -484 kJ· mol-1
②COS(g)+ H2O(g)⇌H2S(g)+CO2(g) ΔH2= -36kJ·mol-1
③CO的燃烧热为283 kJ·mol-1
反应CO(g)+ H2S(g)⇌COS(g)+ H2(g)的 ΔH=_______ kJ·mol-1。
(2)以FeOOH作催化剂,由H2S和CO合成COS的反应分两步进行。下列示意图能正确体现上述反应能量变化的是_______ (填“甲”或“乙”)。
+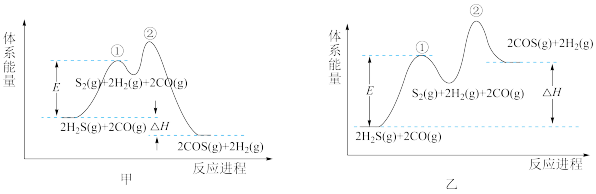
关于该反应的下列叙述正确的是_______ (填标号)。
A.步骤①是慢反应,活化能较大
B.总反应的速率由步骤②决定
C.反应进程中S2属于中间产物
D.更换催化剂可改变E和ΔH
(3)240℃时,反应CO(g)+H2S(g)⇌COS(g)+H2(g)的平衡常数K=1。在密闭容器中充入等物质的量的CO和H2S发生上述反应,达平衡时测得CO的物质的量为4 mol,则H2S的转化率为_____ ,COS 的体积分数为____ 。 在240℃下, 要同时提高CO和H2S的转化率,可采取的措施是_____ 。
(4)在两个密闭容器中都加入CO、H2S、COS、H2四种气体,起始时气体体积分数φ(CO)= φ(H2S),φ(COS)=p(H2),分别在300℃和320℃时反应,容器中H2S(g)和COS(g)的体积分数(φ)随时间(t) 的变化关系如图所示。
+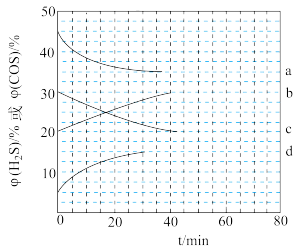
300℃和320℃时,φ(H2S)随时间变化关系的曲线分别是_______ 、_______ ,判断的理由是_______ 。
(1)已知:
①2H2(g)+O2(g)= 2H2O(g) ΔH1= -484 kJ· mol-1
②COS(g)+ H2O(g)⇌H2S(g)+CO2(g) ΔH2= -36kJ·mol-1
③CO的燃烧热为283 kJ·mol-1
反应CO(g)+ H2S(g)⇌COS(g)+ H2(g)的 ΔH=
(2)以FeOOH作催化剂,由H2S和CO合成COS的反应分两步进行。下列示意图能正确体现上述反应能量变化的是
+

关于该反应的下列叙述正确的是
A.步骤①是慢反应,活化能较大
B.总反应的速率由步骤②决定
C.反应进程中S2属于中间产物
D.更换催化剂可改变E和ΔH
(3)240℃时,反应CO(g)+H2S(g)⇌COS(g)+H2(g)的平衡常数K=1。在密闭容器中充入等物质的量的CO和H2S发生上述反应,达平衡时测得CO的物质的量为4 mol,则H2S的转化率为
(4)在两个密闭容器中都加入CO、H2S、COS、H2四种气体,起始时气体体积分数φ(CO)= φ(H2S),φ(COS)=p(H2),分别在300℃和320℃时反应,容器中H2S(g)和COS(g)的体积分数(φ)随时间(t) 的变化关系如图所示。
+

300℃和320℃时,φ(H2S)随时间变化关系的曲线分别是
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】碳中和作为一种新型环保形式,目前已经被越来越多的大型活动和会议采用。回答下列有关问题:
(1)利用CO2合成二甲醚有两种工艺。
工艺1:涉及以下主要反应:
Ⅰ.甲醇的合成:CO2(g) + 3H2(g) CH3OH(g) + H2O (g) ΔH1<0
CH3OH(g) + H2O (g) ΔH1<0
Ⅱ.逆水汽变换:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2>0
CO(g)+H2O(g) ΔH2>0
Ⅲ.甲醇脱水:2CH3OH(g) CH3OCH3(g) + H2O(g) ΔH3>0
CH3OCH3(g) + H2O(g) ΔH3>0
工艺2:利用CO2直接加氢合成CH3OCH3 (反应Ⅳ)
①反应Ⅳ的热化学方程式为_______ ,平衡常数K4= _______ (用K1、K3表示)。
②恒温恒容情况下,下列说法能判断反应Ⅳ达到平衡的是_______ 。
A.气体物质中碳元素与氧元素的质量比不变
B.容器内压强不变
C.容器内气体密度不变
D.容器内CH3OCH3浓度保持不变
(2)工艺1需先合成甲醇。在不同压强下,按照n(CO2):n(H2)=1:3投料合成甲醇,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
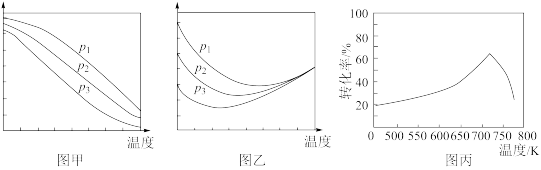
①下列说法正确的是_______
A.图甲纵坐标表示CH3OH的平衡产率
B.p1>p2>p3
C.为了同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择低温、高压条件
D.一定温度压强下,提高CO2的平衡转化率的主要方向是寻找活性更高的催化剂
②图乙中,某温度时,三条曲线几乎交于一点的原因是_______ 。
(3)对于合成甲醇的反应:CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH<0,一定条件下,单位时间内不同温度下测定的CO2转化率如图丙所示。温度高于710K时,随温度的升高CO2转化率降低的原因可能是
CH3OH(g) + H2O(g) ΔH<0,一定条件下,单位时间内不同温度下测定的CO2转化率如图丙所示。温度高于710K时,随温度的升高CO2转化率降低的原因可能是_______ 。
(1)利用CO2合成二甲醚有两种工艺。
工艺1:涉及以下主要反应:
Ⅰ.甲醇的合成:CO2(g) + 3H2(g)
 CH3OH(g) + H2O (g) ΔH1<0
CH3OH(g) + H2O (g) ΔH1<0Ⅱ.逆水汽变换:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2>0
CO(g)+H2O(g) ΔH2>0Ⅲ.甲醇脱水:2CH3OH(g)
 CH3OCH3(g) + H2O(g) ΔH3>0
CH3OCH3(g) + H2O(g) ΔH3>0工艺2:利用CO2直接加氢合成CH3OCH3 (反应Ⅳ)
①反应Ⅳ的热化学方程式为
②恒温恒容情况下,下列说法能判断反应Ⅳ达到平衡的是
A.气体物质中碳元素与氧元素的质量比不变
B.容器内压强不变
C.容器内气体密度不变
D.容器内CH3OCH3浓度保持不变
(2)工艺1需先合成甲醇。在不同压强下,按照n(CO2):n(H2)=1:3投料合成甲醇,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。

①下列说法正确的是
A.图甲纵坐标表示CH3OH的平衡产率
B.p1>p2>p3
C.为了同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择低温、高压条件
D.一定温度压强下,提高CO2的平衡转化率的主要方向是寻找活性更高的催化剂
②图乙中,某温度时,三条曲线几乎交于一点的原因是
(3)对于合成甲醇的反应:CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g) ΔH<0,一定条件下,单位时间内不同温度下测定的CO2转化率如图丙所示。温度高于710K时,随温度的升高CO2转化率降低的原因可能是
CH3OH(g) + H2O(g) ΔH<0,一定条件下,单位时间内不同温度下测定的CO2转化率如图丙所示。温度高于710K时,随温度的升高CO2转化率降低的原因可能是
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】杭州亚运会主火炬燃料“零碳甲醇”是一种利用焦炉气中的 和工业废气捕获的
和工业废气捕获的 生产的绿色燃料。两者在适宜的过渡金属及其氧化物催化下发生反应:
生产的绿色燃料。两者在适宜的过渡金属及其氧化物催化下发生反应:
 。
。
(1)已知:
 ,
,
 。
。
①则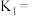
_______ (用含 和
和 的代数式表示)。
的代数式表示)。
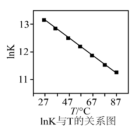
②实验测得 (记作
(记作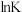 )与温度(T)的关系如图所示,则该反应
)与温度(T)的关系如图所示,则该反应
_____ 0(填“>”“<”或“=”)。
(2)从焦炉气中提取氢气,需净化原料气,尤其要脱除其中的含硫杂质。除了从环保角度考虑外,其主要目的是_______ 。
(3)寻找合适、高效的催化剂氧化除去含硫杂质燃烧产生的 是常见的化学处理方法,一种钥催化剂参与
是常见的化学处理方法,一种钥催化剂参与 催化氧化反应的能量变化如图所示,
催化氧化反应的能量变化如图所示,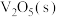 与
与 反应生成
反应生成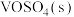 和
和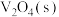 的热化学方程式为
的热化学方程式为___________ 。

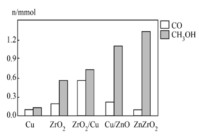
(4)研究合成甲醇的催化剂时,在其他条件不变仅改变催化剂种类的情况下,对反应器出口产品进行成分分析,结果如图所示。在以上催化剂中,该反应选择的最佳催化剂为_______ 。
(5)在研究该反应历程时发现:反应气中水蒸气含量会影响 的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响,如图所示(吸附在催化剂表面上的物种用*标注):
的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响,如图所示(吸附在催化剂表面上的物种用*标注):
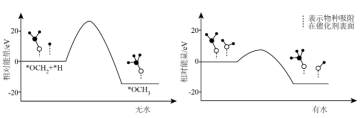
①写出有水参与时的化学方程式_________ 。
②资料显示:水也可以使催化剂活化点位减少。结合资料和图以及学过的知识,推测在反应气中添加水蒸气对甲醇产率的影响并说明产生这种影响的原因(任答两点)___________ 。
 和工业废气捕获的
和工业废气捕获的 生产的绿色燃料。两者在适宜的过渡金属及其氧化物催化下发生反应:
生产的绿色燃料。两者在适宜的过渡金属及其氧化物催化下发生反应:
 。
。(1)已知:

 ,
,
 。
。①则
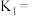
 和
和 的代数式表示)。
的代数式表示)。②实验测得
 (记作
(记作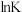 )与温度(T)的关系如图所示,则该反应
)与温度(T)的关系如图所示,则该反应

(2)从焦炉气中提取氢气,需净化原料气,尤其要脱除其中的含硫杂质。除了从环保角度考虑外,其主要目的是
(3)寻找合适、高效的催化剂氧化除去含硫杂质燃烧产生的
 是常见的化学处理方法,一种钥催化剂参与
是常见的化学处理方法,一种钥催化剂参与 催化氧化反应的能量变化如图所示,
催化氧化反应的能量变化如图所示,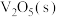 与
与 反应生成
反应生成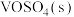 和
和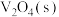 的热化学方程式为
的热化学方程式为
(4)研究合成甲醇的催化剂时,在其他条件不变仅改变催化剂种类的情况下,对反应器出口产品进行成分分析,结果如图所示。在以上催化剂中,该反应选择的最佳催化剂为

(5)在研究该反应历程时发现:反应气中水蒸气含量会影响
 的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响,如图所示(吸附在催化剂表面上的物种用*标注):
的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响,如图所示(吸附在催化剂表面上的物种用*标注):
①写出有水参与时的化学方程式
②资料显示:水也可以使催化剂活化点位减少。结合资料和图以及学过的知识,推测在反应气中添加水蒸气对甲醇产率的影响并说明产生这种影响的原因(任答两点)
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某实验小组研究了几种无机盐对纤维素酶和木聚糖酶活力的影响。将无机盐与酶样分别以1∶10和1∶2的比例均匀混合,配制成待测酶液,酶活力测定结果如下表所示。已知不添加无机盐时,纤维素酶活力为1000IU/g,木聚糖酶活力为5000 IU/g。回答下列问题:
添加不同比例无机盐后对纤维素酶、木聚糖酶活力的影响 单位:IU/g
(1)酶活力也称酶活性,酶活性的大小可以用___________ 来表示。
(2)由表中数据可看出,随着无机盐添加比例的增加,对纤维素酶,木聚糖酶活力促进作用最明显的无机盐分别是___________ ;有同学提出相同的无机盐对不同酶的作用效果不同,其依据是___________ 。
(3)实验中 对木聚糖酶活力具有显著的抑制作用,原因可能是
对木聚糖酶活力具有显著的抑制作用,原因可能是___________ ,从而造成了木聚糖酶活性降低。
(4)在添加无机盐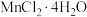 的条件下,进一步探究纤维素含量对酶促反应的影响,以羧甲基纤维素钠溶液作为反应底物,请设计实验思路及预期结果。
的条件下,进一步探究纤维素含量对酶促反应的影响,以羧甲基纤维素钠溶液作为反应底物,请设计实验思路及预期结果。
实验思路:___________ 。
预期实验结果:请根据预期实验结果绘制大致的曲线图___________ 。
添加不同比例无机盐后对纤维素酶、木聚糖酶活力的影响 单位:IU/g
| 添加无机盐 | 纤维素酶活力 | 木聚糖酶活力 | ||
| 1∶10 | 1∶2 | 1∶10 | 1∶2 | |
| NaCl | 1005 | 1005 | 5241 | 5318 |
| KI | 1001 | 1001 | 5012 | 5018 |
 | 957 | 902 | 1937 | 1798 |
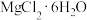 | 1000 | 1048 | 4496 | 4248 |
 | 1052 | 1084 | 4480 | 4261 |
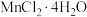 | 1225 | 1435 | 4546 | 4359 |
 | 996 | 1036 | 5313 | 5336 |
 | 1001 | 1069 | 5202 | 5381 |
 | 1007 | 1160 | 4407 | 4211 |
(2)由表中数据可看出,随着无机盐添加比例的增加,对纤维素酶,木聚糖酶活力促进作用最明显的无机盐分别是
(3)实验中
 对木聚糖酶活力具有显著的抑制作用,原因可能是
对木聚糖酶活力具有显著的抑制作用,原因可能是(4)在添加无机盐
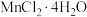 的条件下,进一步探究纤维素含量对酶促反应的影响,以羧甲基纤维素钠溶液作为反应底物,请设计实验思路及预期结果。
的条件下,进一步探究纤维素含量对酶促反应的影响,以羧甲基纤维素钠溶液作为反应底物,请设计实验思路及预期结果。实验思路:
预期实验结果:请根据预期实验结果绘制大致的曲线图
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】草酸(H2C2O4)与高锰酸钾在酸性条件下能够发生如下反应:5H2C2O4+2MnO +6H+→2Mn2++10CO2↑+8H2O
+6H+→2Mn2++10CO2↑+8H2O
甲同学用8.00mL0.001 mol•L-1 KMnO4 溶液与 5.00mL 0.01 mol•L-1 H2C2O4 溶液反应,研究不同条件对化学反应速率的影响.改变的条件如下:
(l)对比实验l和3,主要探究____ 对化学反应速率的影响;实验3中加入2.00mL蒸馏水的目的是________ 。
(2)甲同学在研究反应的影响因素时发现, 草酸与酸性高锰酸钾溶液开始一段时间反应速率较慢,溶液褪色不明显, 但不久后突然褪色, 反应速率明显加快.甲同学认为除了反应放热,导致溶液温度升高,还可能是________ 的影响,为了证明猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是_ (填字母)。
A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰
(3)乙同学为了测定某高锰酸钾产品的质量分数,取0.500g的高锰酸钾产品,配成50.00 mL溶液,取出 10.00 mL, 用 0.100 mol•L-1草酸标准溶液滴定至终点,消耗草酸标准溶液15.00 mL。计算该样品中高锰酸钾的质量分数(写出计算过程)。_________
 +6H+→2Mn2++10CO2↑+8H2O
+6H+→2Mn2++10CO2↑+8H2O甲同学用8.00mL0.001 mol•L-1 KMnO4 溶液与 5.00mL 0.01 mol•L-1 H2C2O4 溶液反应,研究不同条件对化学反应速率的影响.改变的条件如下:
| 序号 | KMnO4/mL | H2C2O4/mL | 10%H2SO4/mL | 温度/℃ | 其他物质 |
| 1 | 8.00 | 5.00 | 3.00 | 20 | |
| 2 | 8.00 | 5.00 | 3.00 | 30 | |
| 3 | 8.00 | 5.00 | 1.00 | 20 | 2.00 mL蒸馏水 |
(l)对比实验l和3,主要探究
(2)甲同学在研究反应的影响因素时发现, 草酸与酸性高锰酸钾溶液开始一段时间反应速率较慢,溶液褪色不明显, 但不久后突然褪色, 反应速率明显加快.甲同学认为除了反应放热,导致溶液温度升高,还可能是
A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰
(3)乙同学为了测定某高锰酸钾产品的质量分数,取0.500g的高锰酸钾产品,配成50.00 mL溶液,取出 10.00 mL, 用 0.100 mol•L-1草酸标准溶液滴定至终点,消耗草酸标准溶液15.00 mL。计算该样品中高锰酸钾的质量分数(写出计算过程)。
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】NO在医药化工行业有着十分重要的应用。
Ⅰ.工业上主要采用氨催化氧化法生产NO:
主反应: △H1
△H1
副反应: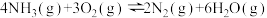 △H2=-1265kJ·mol-1
△H2=-1265kJ·mol-1
(1)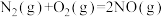 △H=+180kJ·mol-1,则△H1=
△H=+180kJ·mol-1,则△H1=_____ 。
(2)在不同的氨初始含量下,催化剂表面的反应速率与温度的关系如图。
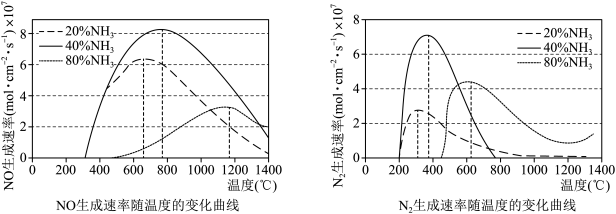
由图知,生产NO的最佳条件为_____。
(3)在一定的氨初始含量下,温度升高一段时间后,体系中 减小,可能的原因是
减小,可能的原因是_____ 。
Ⅱ.NO是空气污染物之一,以硫酸钠溶液为电解质,泡沫Cu为阴极,利用电化学装置实现NO的消除,阴极反应的模拟能量变化如图。
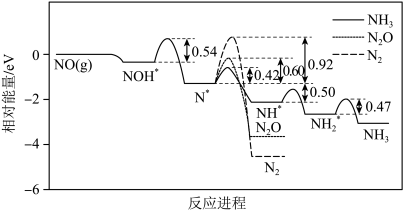
(4)从反应速率角度推断NO最终还原产物主要为_____ ,阴极的主要电极反应式为_____ 。
Ⅲ.用NO生产亚硝酰氯,反应如下: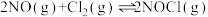 △H<0
△H<0
(5)提高NO平衡转化率可采取的措施是_____。
(6)一定温度下,在恒容密闭容器中,NO(g)和Cl2(g)按物质的量之比为2∶1进行反应,体系初始总压为p0,NO的平衡转化率为α,则平衡常数Kp=_____ (以分压表示,分压=总压×物质的量分数,用含p0、α代数式表示)。
Ⅰ.工业上主要采用氨催化氧化法生产NO:
主反应:
 △H1
△H1副反应:
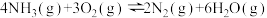 △H2=-1265kJ·mol-1
△H2=-1265kJ·mol-1(1)
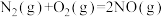 △H=+180kJ·mol-1,则△H1=
△H=+180kJ·mol-1,则△H1=(2)在不同的氨初始含量下,催化剂表面的反应速率与温度的关系如图。

由图知,生产NO的最佳条件为_____。
| A.氨含量20%、反应温度650℃ |
| B.氨含量40%、反应温度750℃ |
| C.氨含量80%、反应温度1150℃ |
| D.氨含量20%、反应温度750℃ |
(3)在一定的氨初始含量下,温度升高一段时间后,体系中
 减小,可能的原因是
减小,可能的原因是Ⅱ.NO是空气污染物之一,以硫酸钠溶液为电解质,泡沫Cu为阴极,利用电化学装置实现NO的消除,阴极反应的模拟能量变化如图。

(4)从反应速率角度推断NO最终还原产物主要为
Ⅲ.用NO生产亚硝酰氯,反应如下:
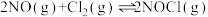 △H<0
△H<0(5)提高NO平衡转化率可采取的措施是_____。
| A.降低温度 | B.增大NO的浓度 | C.增大压强 | D.加入合适的催化剂 |
(6)一定温度下,在恒容密闭容器中,NO(g)和Cl2(g)按物质的量之比为2∶1进行反应,体系初始总压为p0,NO的平衡转化率为α,则平衡常数Kp=
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】Ⅰ.已知在25℃、101kPa时:
a.
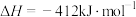
b.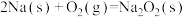
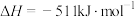
(1)写出 与Na反应生成
与Na反应生成 的热化学方程式
的热化学方程式_______ 。
Ⅱ.铁系金属常用作CO加氢反应的催化剂。已知某种催化剂可用来催化反应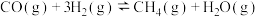
 。在T℃,压强为p时将1 mol CO和3 mol
。在T℃,压强为p时将1 mol CO和3 mol  加入容积为1 L的密闭容器中。实验测得CO的体积分数
加入容积为1 L的密闭容器中。实验测得CO的体积分数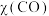 如表:
如表:
(2)达到平衡时,体系的总压强p与初始压强p0之比为_______ ;
(3)如图是该反应CO的平衡转化率与温度、压强的关系。

图中温度 、
、 、
、 由高到低的顺序是
由高到低的顺序是_______ ,理由是_______ 。
(4)45 min时,保持容器的温度和体积不变,再加入1 mol CO和3 mol ,再次达到平衡时,CO的平衡转化率
,再次达到平衡时,CO的平衡转化率_______ (填“不变”、“增大”或“减小”)。
a.

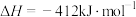
b.
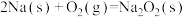
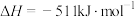
(1)写出
 与Na反应生成
与Na反应生成 的热化学方程式
的热化学方程式Ⅱ.铁系金属常用作CO加氢反应的催化剂。已知某种催化剂可用来催化反应
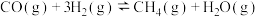
 。在T℃,压强为p时将1 mol CO和3 mol
。在T℃,压强为p时将1 mol CO和3 mol  加入容积为1 L的密闭容器中。实验测得CO的体积分数
加入容积为1 L的密闭容器中。实验测得CO的体积分数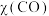 如表:
如表: | 0 | 10 | 20 | 30 | 35 |
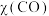 | 0.25 | 0.20 | 0.17 | 0.15 | 0.15 |
(3)如图是该反应CO的平衡转化率与温度、压强的关系。

图中温度
 、
、 、
、 由高到低的顺序是
由高到低的顺序是(4)45 min时,保持容器的温度和体积不变,再加入1 mol CO和3 mol
 ,再次达到平衡时,CO的平衡转化率
,再次达到平衡时,CO的平衡转化率
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】我国力争于2030年前实现碳达峰,2060年前实现碳中和。 与
与 的反应是降低
的反应是降低 排放的研究热点:
排放的研究热点: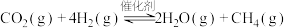
 。回答下列问题:
。回答下列问题:
(1)
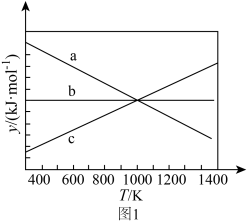
___________ (填“>”或“<”)0,设 ,y随温度的变化关系如图1所示。上述反应对应的曲线是
,y随温度的变化关系如图1所示。上述反应对应的曲线是___________ (填标号)。
(2)生产过程中,为了提高效率,下列对该反应采取的措施中合适的是___________(填标号)。
(3)T℃时,将 和
和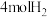 充入密闭容器中发生上述反应,测得平衡时
充入密闭容器中发生上述反应,测得平衡时 和
和 的物质的量浓度与平衡总压的关系如图2所示。则A、B、C三点中
的物质的量浓度与平衡总压的关系如图2所示。则A、B、C三点中 的转化率由大到小的顺序为
的转化率由大到小的顺序为_______ ,C点时 的分压
的分压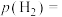
________ MPa,B点时该反应的压强平衡常数
________  (用平衡分压代替浓度)。
(用平衡分压代替浓度)。

(4)在相同条件下, 与
与 还会发生副反应:
还会发生副反应:
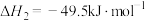 。
。
①一定压强下,随着温度的降低,气体中 与
与 的物质的量
的物质的量___________ (填标号)。
A.均增大 B.均减小 C.均不变
②已知反应速率常数与温度的关系为 ,k为速率常数,R为摩尔气体常量,T为热力学温度,
,k为速率常数,R为摩尔气体常量,T为热力学温度, 为活化能,A为指前因子,为常数。在反应器中按
为活化能,A为指前因子,为常数。在反应器中按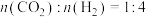 通入反应物,在不同温度、相同的催化剂条件下,反应进行到2min时,测得反应器中
通入反应物,在不同温度、相同的催化剂条件下,反应进行到2min时,测得反应器中 ,
, 的浓度(
的浓度( )如表所示。升高温度时,反应速率增加的倍数大的是活化能大的反应;通过下表可知活化能大的反应是
)如表所示。升高温度时,反应速率增加的倍数大的是活化能大的反应;通过下表可知活化能大的反应是___________ (填“主”或“副”)反应。升高温度,k___________ (填“增大”或“减小”)。
 与
与 的反应是降低
的反应是降低 排放的研究热点:
排放的研究热点: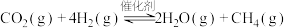
 。回答下列问题:
。回答下列问题:(1)

 ,y随温度的变化关系如图1所示。上述反应对应的曲线是
,y随温度的变化关系如图1所示。上述反应对应的曲线是
(2)生产过程中,为了提高效率,下列对该反应采取的措施中合适的是___________(填标号)。
| A.反应温度愈高愈好 | B.适当增大压强 |
| C.选择合适的催化剂 | D.通入一定量的氮气 |
 和
和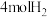 充入密闭容器中发生上述反应,测得平衡时
充入密闭容器中发生上述反应,测得平衡时 和
和 的物质的量浓度与平衡总压的关系如图2所示。则A、B、C三点中
的物质的量浓度与平衡总压的关系如图2所示。则A、B、C三点中 的转化率由大到小的顺序为
的转化率由大到小的顺序为 的分压
的分压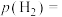

 (用平衡分压代替浓度)。
(用平衡分压代替浓度)。
(4)在相同条件下,
 与
与 还会发生副反应:
还会发生副反应:
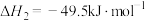 。
。①一定压强下,随着温度的降低,气体中
 与
与 的物质的量
的物质的量A.均增大 B.均减小 C.均不变
②已知反应速率常数与温度的关系为
 ,k为速率常数,R为摩尔气体常量,T为热力学温度,
,k为速率常数,R为摩尔气体常量,T为热力学温度, 为活化能,A为指前因子,为常数。在反应器中按
为活化能,A为指前因子,为常数。在反应器中按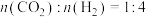 通入反应物,在不同温度、相同的催化剂条件下,反应进行到2min时,测得反应器中
通入反应物,在不同温度、相同的催化剂条件下,反应进行到2min时,测得反应器中 ,
, 的浓度(
的浓度( )如表所示。升高温度时,反应速率增加的倍数大的是活化能大的反应;通过下表可知活化能大的反应是
)如表所示。升高温度时,反应速率增加的倍数大的是活化能大的反应;通过下表可知活化能大的反应是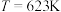 | 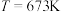 | ||
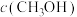 |  | 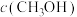 |  |
| 10.8 | 12722 | 345.2 | 42780 |
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】 是目前大气中含量最高的一种温室气体。
是目前大气中含量最高的一种温室气体。 的捕获与重整是
的捕获与重整是 利用的研究热点。
利用的研究热点。
(1)在催化剂作用下,可用 与
与 反应制取甲酸。已知:
反应制取甲酸。已知:
则
___________  。
。
(2)在刚性密闭容器中, 平衡时的体积分数随投料比
平衡时的体积分数随投料比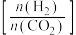 的变化如图所示:
的变化如图所示:
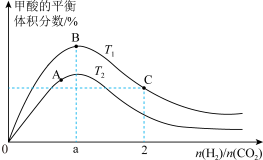
①图中 、
、 表示不同的反应温度,判断
表示不同的反应温度,判断
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②A、B、C三点 的平衡转化率
的平衡转化率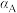 、
、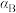 、
、 ,由大到小的顺序为
,由大到小的顺序为___________ 。
(3) 可以被
可以被 溶液捕获,当溶液
溶液捕获,当溶液 时,所得溶液中
时,所得溶液中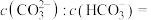
___________ 。(室温下,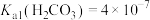 ,
,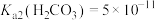 )。
)。
(4)二氧化碳的重整利用的另一方式为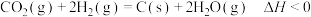 。
。
在250℃时,向体积为2L恒容密闭容器中通入 和
和 发生该反应,测得容器内气压变化如图所示。
发生该反应,测得容器内气压变化如图所示。
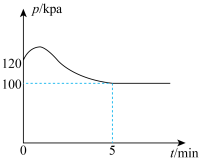
①为提高平衡时 的转化率,反应条件应选择
的转化率,反应条件应选择___________ (填标号)。
A.高压 B.低压 C.低温 D.高温
②该温度下的平衡常数
___________ 。
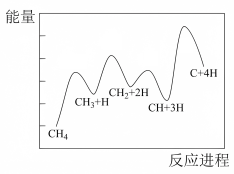
(5)一定条件下, 分解形成碳的反应历程如图所示分4步完成,其中决定反应速率的是第
分解形成碳的反应历程如图所示分4步完成,其中决定反应速率的是第___________ 步反应。
 是目前大气中含量最高的一种温室气体。
是目前大气中含量最高的一种温室气体。 的捕获与重整是
的捕获与重整是 利用的研究热点。
利用的研究热点。(1)在催化剂作用下,可用
 与
与 反应制取甲酸。已知:
反应制取甲酸。已知:| 共价键 |  |  |  |  |  |
键能 | 799 | 343 | 436 | 463 | 413 |

 。
。(2)在刚性密闭容器中,
 平衡时的体积分数随投料比
平衡时的体积分数随投料比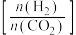 的变化如图所示:
的变化如图所示:
①图中
 、
、 表示不同的反应温度,判断
表示不同的反应温度,判断
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②A、B、C三点
 的平衡转化率
的平衡转化率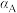 、
、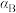 、
、 ,由大到小的顺序为
,由大到小的顺序为(3)
 可以被
可以被 溶液捕获,当溶液
溶液捕获,当溶液 时,所得溶液中
时,所得溶液中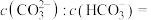
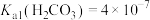 ,
,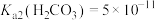 )。
)。(4)二氧化碳的重整利用的另一方式为
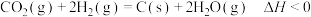 。
。在250℃时,向体积为2L恒容密闭容器中通入
 和
和 发生该反应,测得容器内气压变化如图所示。
发生该反应,测得容器内气压变化如图所示。
①为提高平衡时
 的转化率,反应条件应选择
的转化率,反应条件应选择A.高压 B.低压 C.低温 D.高温
②该温度下的平衡常数

(5)一定条件下,
 分解形成碳的反应历程如图所示分4步完成,其中决定反应速率的是第
分解形成碳的反应历程如图所示分4步完成,其中决定反应速率的是第
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】苯乙烯是一种重要的有机化工原料,可利用乙苯催化脱氢法制备,实际生产中常在体系中充入一定量的CO2,主要反应如下:
I.C8H10(g)=C8H8(g)+H2(g) ΔH1=+117.6kJ·mol-1;
II.CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1。
回答下列问题:
(1)相比于乙苯直接脱氢制苯乙烯,工业实际生产中充入一定量CO2的优点为___________ (任写一点);二氧化碳与乙苯气体反应生成苯乙烯气体、一氧化碳和水蒸气的热化学方程式为___________ 。
(2)一定温度下,起始向10L盛放催化剂的恒容密闭容器中充入2 mol C8H10(g)和1 molCO2(g)发生反应I和反应II.20min末达到平衡时,C8H8(g)、H2O(g)的体积分数分别为25%和5%。
①0~20 min内,用C8H10的物质的量浓度变化表示的平均反应速率v(C8H10)=___________ 。
②反应II的平衡常数Kc=___________ 。
③起始投料量不变,在不同温度、压强下重复实验,测得H2的平衡体积分数与温度和压强的关系如图所示。
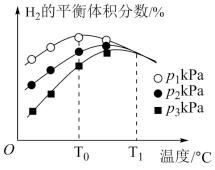
由图可知,温度低于T0℃时,以反应___________ (填“I”或“II”)为主,理由为___________ ;T1℃时,三条曲线几乎相交的原因为___________ ,P1、P2、P3由大到小的顺序为___________ 。
(3)若乙苯催化脱氢过程中发生积碳反应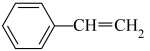 (g)=8C(s)+4H2(g) ΔH3=-126 kJ·mol-1.积碳反应可能导致的后果为
(g)=8C(s)+4H2(g) ΔH3=-126 kJ·mol-1.积碳反应可能导致的后果为___________ (任写一点)。
I.C8H10(g)=C8H8(g)+H2(g) ΔH1=+117.6kJ·mol-1;
II.CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1。
回答下列问题:
(1)相比于乙苯直接脱氢制苯乙烯,工业实际生产中充入一定量CO2的优点为
(2)一定温度下,起始向10L盛放催化剂的恒容密闭容器中充入2 mol C8H10(g)和1 molCO2(g)发生反应I和反应II.20min末达到平衡时,C8H8(g)、H2O(g)的体积分数分别为25%和5%。
①0~20 min内,用C8H10的物质的量浓度变化表示的平均反应速率v(C8H10)=
②反应II的平衡常数Kc=
③起始投料量不变,在不同温度、压强下重复实验,测得H2的平衡体积分数与温度和压强的关系如图所示。

由图可知,温度低于T0℃时,以反应
(3)若乙苯催化脱氢过程中发生积碳反应
 (g)=8C(s)+4H2(g) ΔH3=-126 kJ·mol-1.积碳反应可能导致的后果为
(g)=8C(s)+4H2(g) ΔH3=-126 kJ·mol-1.积碳反应可能导致的后果为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】氨是重要的化工原料,我国目前氨的生产能力位居世界首位。回答下列问题:
(1)二十世纪初,工业以 和
和 为原料在一定温度和压强下合成尿素。反应分两步:a.
为原料在一定温度和压强下合成尿素。反应分两步:a. 和
和 生成
生成 ;b.
;b. 分解生成尿素,结合反应过程中能量变化示意图(如图),回答问题:
分解生成尿素,结合反应过程中能量变化示意图(如图),回答问题:
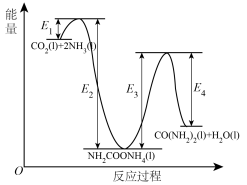
①反应a为反应_____ (填“放热”或“吸热”)。
②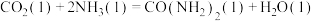

_____ kJ/mol(用含“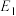 、
、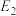 、
、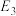 、
、 ”的代数式表示)。
”的代数式表示)。
(2)研究表明,合成氨反应在Fe催化剂上可能通过下图机理进行(*表示催化剂表面吸附位, 表示被吸附于催化剂表面的
表示被吸附于催化剂表面的 ),其中
),其中 的吸附分解反应活化能高,速率慢,是合成氨反应的决速步。
的吸附分解反应活化能高,速率慢,是合成氨反应的决速步。
(i)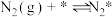
(ii)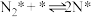
(iii)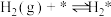
(iv)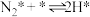
(v)
……
(…)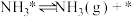
实际生产中, 和
和 的物质的量之比并非
的物质的量之比并非 ,而是
,而是 ,分析说明原料气中
,分析说明原料气中 适度过量的2个理由:
适度过量的2个理由:
①_____ ;②_____ 。
(3)若在不同压强下,以投料比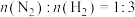 的方式进料,反应达平衡时氨的物质的量分数与温度的计算结果如图所示:(物质i的物质的量分数:
的方式进料,反应达平衡时氨的物质的量分数与温度的计算结果如图所示:(物质i的物质的量分数: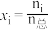 )
)
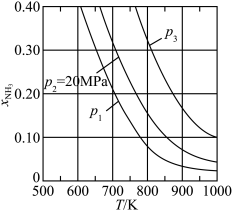
①图中压强由小到大的顺序为_____ 。
②当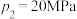 、
、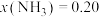 时,氮气的转化率ɑ=
时,氮气的转化率ɑ=_____ (保留到小数点后一位)。
③某温度下,在1L的密闭容器中充入 和
和 ,反应达到平衡后,测得
,反应达到平衡后,测得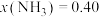 ,计算该温度下合成氨反应的平衡常数为
,计算该温度下合成氨反应的平衡常数为_____ 。
(1)二十世纪初,工业以
 和
和 为原料在一定温度和压强下合成尿素。反应分两步:a.
为原料在一定温度和压强下合成尿素。反应分两步:a. 和
和 生成
生成 ;b.
;b. 分解生成尿素,结合反应过程中能量变化示意图(如图),回答问题:
分解生成尿素,结合反应过程中能量变化示意图(如图),回答问题:
①反应a为反应
②
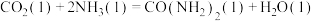

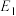 、
、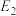 、
、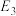 、
、 ”的代数式表示)。
”的代数式表示)。(2)研究表明,合成氨反应在Fe催化剂上可能通过下图机理进行(*表示催化剂表面吸附位,
 表示被吸附于催化剂表面的
表示被吸附于催化剂表面的 ),其中
),其中 的吸附分解反应活化能高,速率慢,是合成氨反应的决速步。
的吸附分解反应活化能高,速率慢,是合成氨反应的决速步。(i)
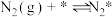
(ii)
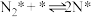
(iii)
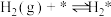
(iv)
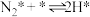
(v)

……
(…)
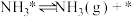
实际生产中,
 和
和 的物质的量之比并非
的物质的量之比并非 ,而是
,而是 ,分析说明原料气中
,分析说明原料气中 适度过量的2个理由:
适度过量的2个理由:①
(3)若在不同压强下,以投料比
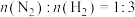 的方式进料,反应达平衡时氨的物质的量分数与温度的计算结果如图所示:(物质i的物质的量分数:
的方式进料,反应达平衡时氨的物质的量分数与温度的计算结果如图所示:(物质i的物质的量分数: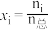 )
)
①图中压强由小到大的顺序为
②当
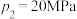 、
、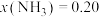 时,氮气的转化率ɑ=
时,氮气的转化率ɑ=③某温度下,在1L的密闭容器中充入
 和
和 ,反应达到平衡后,测得
,反应达到平衡后,测得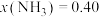 ,计算该温度下合成氨反应的平衡常数为
,计算该温度下合成氨反应的平衡常数为
您最近半年使用:0次



