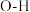我国力争于2030年前实现碳达峰,2060年前实现碳中和。 与
与 的反应是降低
的反应是降低 排放的研究热点:
排放的研究热点: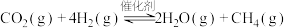
 。回答下列问题:
。回答下列问题:
(1)
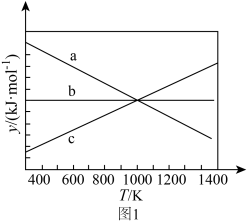
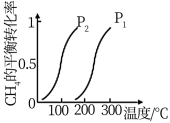
___________ (填“>”或“<”)0,设 ,y随温度的变化关系如图1所示。上述反应对应的曲线是
,y随温度的变化关系如图1所示。上述反应对应的曲线是___________ (填标号)。
(2)生产过程中,为了提高效率,下列对该反应采取的措施中合适的是___________(填标号)。
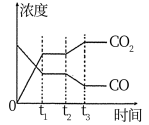
(3)T℃时,将 和
和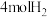 充入密闭容器中发生上述反应,测得平衡时
充入密闭容器中发生上述反应,测得平衡时 和
和 的物质的量浓度与平衡总压的关系如图2所示。则A、B、C三点中
的物质的量浓度与平衡总压的关系如图2所示。则A、B、C三点中 的转化率由大到小的顺序为
的转化率由大到小的顺序为_______ ,C点时 的分压
的分压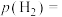
________ MPa,B点时该反应的压强平衡常数
________  (用平衡分压代替浓度)。
(用平衡分压代替浓度)。

(4)在相同条件下, 与
与 还会发生副反应:
还会发生副反应:
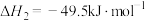 。
。
①一定压强下,随着温度的降低,气体中 与
与 的物质的量
的物质的量___________ (填标号)。
A.均增大 B.均减小 C.均不变
②已知反应速率常数与温度的关系为 ,k为速率常数,R为摩尔气体常量,T为热力学温度,
,k为速率常数,R为摩尔气体常量,T为热力学温度, 为活化能,A为指前因子,为常数。在反应器中按
为活化能,A为指前因子,为常数。在反应器中按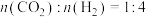 通入反应物,在不同温度、相同的催化剂条件下,反应进行到2min时,测得反应器中
通入反应物,在不同温度、相同的催化剂条件下,反应进行到2min时,测得反应器中 ,
, 的浓度(
的浓度( )如表所示。升高温度时,反应速率增加的倍数大的是活化能大的反应;通过下表可知活化能大的反应是
)如表所示。升高温度时,反应速率增加的倍数大的是活化能大的反应;通过下表可知活化能大的反应是___________ (填“主”或“副”)反应。升高温度,k___________ (填“增大”或“减小”)。
 与
与 的反应是降低
的反应是降低 排放的研究热点:
排放的研究热点: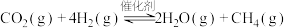
 。回答下列问题:
。回答下列问题:(1)

 ,y随温度的变化关系如图1所示。上述反应对应的曲线是
,y随温度的变化关系如图1所示。上述反应对应的曲线是
(2)生产过程中,为了提高效率,下列对该反应采取的措施中合适的是___________(填标号)。
| A.反应温度愈高愈好 | B.适当增大压强 |
| C.选择合适的催化剂 | D.通入一定量的氮气 |
 和
和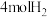 充入密闭容器中发生上述反应,测得平衡时
充入密闭容器中发生上述反应,测得平衡时 和
和 的物质的量浓度与平衡总压的关系如图2所示。则A、B、C三点中
的物质的量浓度与平衡总压的关系如图2所示。则A、B、C三点中 的转化率由大到小的顺序为
的转化率由大到小的顺序为 的分压
的分压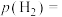

 (用平衡分压代替浓度)。
(用平衡分压代替浓度)。
(4)在相同条件下,
 与
与 还会发生副反应:
还会发生副反应:
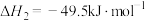 。
。①一定压强下,随着温度的降低,气体中
 与
与 的物质的量
的物质的量A.均增大 B.均减小 C.均不变
②已知反应速率常数与温度的关系为
 ,k为速率常数,R为摩尔气体常量,T为热力学温度,
,k为速率常数,R为摩尔气体常量,T为热力学温度, 为活化能,A为指前因子,为常数。在反应器中按
为活化能,A为指前因子,为常数。在反应器中按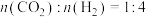 通入反应物,在不同温度、相同的催化剂条件下,反应进行到2min时,测得反应器中
通入反应物,在不同温度、相同的催化剂条件下,反应进行到2min时,测得反应器中 ,
, 的浓度(
的浓度( )如表所示。升高温度时,反应速率增加的倍数大的是活化能大的反应;通过下表可知活化能大的反应是
)如表所示。升高温度时,反应速率增加的倍数大的是活化能大的反应;通过下表可知活化能大的反应是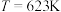 | 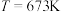 | ||
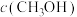 |  | 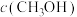 |  |
| 10.8 | 12722 | 345.2 | 42780 |
更新时间:2023-08-09 07:44:02
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】使用石油热裂解的副产物 来制取
来制取 和
和 ,其生产流程如下图:
,其生产流程如下图:
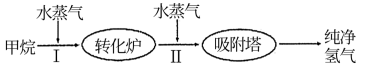
(1)工业上常利用反应Ⅰ产生的 和
和 合成可再生能源甲醇。
合成可再生能源甲醇。
已知 、
、 的摩尔燃烧焓分别为
的摩尔燃烧焓分别为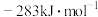 和
和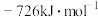 ,则
,则 不完全燃烧生成
不完全燃烧生成 和
和 的热化学方程式为
的热化学方程式为_____ 。
(2)此流程的第Ⅰ步反应为: ,一定条件下
,一定条件下 的平衡转化率与温度、压强的关系如图,则
的平衡转化率与温度、压强的关系如图,则
____  (填“小于”、“大于”或“等于”)。100℃时,将
(填“小于”、“大于”或“等于”)。100℃时,将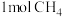 和
和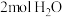 通入容积为
通入容积为 的恒容密闭容器中,达到平衡时
的恒容密闭容器中,达到平衡时 的转化率为0.8.此时该反应的平衡常数K=
的转化率为0.8.此时该反应的平衡常数K=___  (保留小数点后两位数字)。
(保留小数点后两位数字)。
(3)此流程的第Ⅱ步反应 的平衡常数随温度的变化如下表:
的平衡常数随温度的变化如下表:
从上表可以推断:该反应的∆H_____ 0(填“>”或“<”),若在500℃时进行,设起始时 和
和 的起始浓度均为
的起始浓度均为 在该条件下,反应达到平衡时,
在该条件下,反应达到平衡时, 的转化率为
的转化率为____ 。
(4)下图表示该反应在t1时刻达到平衡、在t2时刻因改变某个条件引起浓度变化的情况,图中t2时刻发生改变的条件是_____ (写出一种)。
 来制取
来制取 和
和 ,其生产流程如下图:
,其生产流程如下图:
(1)工业上常利用反应Ⅰ产生的
 和
和 合成可再生能源甲醇。
合成可再生能源甲醇。已知
 、
、 的摩尔燃烧焓分别为
的摩尔燃烧焓分别为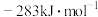 和
和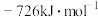 ,则
,则 不完全燃烧生成
不完全燃烧生成 和
和 的热化学方程式为
的热化学方程式为(2)此流程的第Ⅰ步反应为:
 ,一定条件下
,一定条件下 的平衡转化率与温度、压强的关系如图,则
的平衡转化率与温度、压强的关系如图,则
 (填“小于”、“大于”或“等于”)。100℃时,将
(填“小于”、“大于”或“等于”)。100℃时,将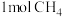 和
和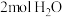 通入容积为
通入容积为 的恒容密闭容器中,达到平衡时
的恒容密闭容器中,达到平衡时 的转化率为0.8.此时该反应的平衡常数K=
的转化率为0.8.此时该反应的平衡常数K= (保留小数点后两位数字)。
(保留小数点后两位数字)。
(3)此流程的第Ⅱ步反应
 的平衡常数随温度的变化如下表:
的平衡常数随温度的变化如下表:温度/℃ | 400 | 500 | 600 |
平衡常数K | 10 | 9 | 1 |
 和
和 的起始浓度均为
的起始浓度均为 在该条件下,反应达到平衡时,
在该条件下,反应达到平衡时, 的转化率为
的转化率为(4)下图表示该反应在t1时刻达到平衡、在t2时刻因改变某个条件引起浓度变化的情况,图中t2时刻发生改变的条件是

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】活性炭载钯(Pd/C)催化剂被广泛应用于医药和化工行业。废钯催化剂的杂质主要含炭、有机物及少量Fe、Cu、Al等元素。从废钯催化剂中回收钯(Pd),并制备二氯二氨合钯[Pd(NH3)2Cl2]的一种工艺流程如下:
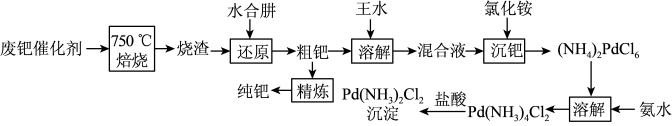
回答下列问题:
(1)“焙烧”的目的是___________ 。
(2)“烧渣”的主要成分是PdO,利用水合肼(N2H4·H2O)在弱碱性环境下还原PdO,产生的气体可以参与大气循环。该还原反应的化学方程式为_________ 。
(3)“粗钯”中含Fe、Cu等杂质,可采用电解精炼的方法得到纯钯。粗钯应与电源的__________ 极相连,Pd与Fe均为第Ⅷ族元素,性质相似,则阴极的电极反应式为_______ 。
(4)粗钯“王水溶解”时,生成氯钯酸(H2PdCl6),其中Pd元素化合价为___________ 。
(5)“沉钯”中氯化铵与“混合液”中的氯钯酸反应生成氯钯酸铵[(NH4)2PdCl6]沉淀,其沉淀率随温度的变化曲线如图所示。下列有关推断错误的是_____________ (填序号)。
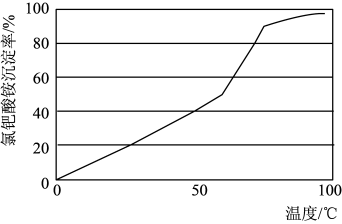
A 升高温度有利于氯化氢挥发,促使平衡正向移动
B 沉钯的最佳温度为100 ℃
C 该反应ΔS>0
(6)“氨水溶解”氯钯酸铵时,先加热将(NH4)2PdCl6转化为(NH4)2PdCl4,再与氨水反应。写出足量氨水与(NH4)2PdCl4反应的化学方程式_________ 。
(7)用平衡移动原理解释盐酸能将Pd(NH3)4Cl2转化为Pd(NH3)2Cl2沉淀的原因_______ 。

回答下列问题:
(1)“焙烧”的目的是
(2)“烧渣”的主要成分是PdO,利用水合肼(N2H4·H2O)在弱碱性环境下还原PdO,产生的气体可以参与大气循环。该还原反应的化学方程式为
(3)“粗钯”中含Fe、Cu等杂质,可采用电解精炼的方法得到纯钯。粗钯应与电源的
(4)粗钯“王水溶解”时,生成氯钯酸(H2PdCl6),其中Pd元素化合价为
(5)“沉钯”中氯化铵与“混合液”中的氯钯酸反应生成氯钯酸铵[(NH4)2PdCl6]沉淀,其沉淀率随温度的变化曲线如图所示。下列有关推断错误的是

A 升高温度有利于氯化氢挥发,促使平衡正向移动
B 沉钯的最佳温度为100 ℃
C 该反应ΔS>0
(6)“氨水溶解”氯钯酸铵时,先加热将(NH4)2PdCl6转化为(NH4)2PdCl4,再与氨水反应。写出足量氨水与(NH4)2PdCl4反应的化学方程式
(7)用平衡移动原理解释盐酸能将Pd(NH3)4Cl2转化为Pd(NH3)2Cl2沉淀的原因
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】某化学兴趣小组进行了实验:向2支试管中分别加入0.5 g Na2CO3固体和0.5 g NaHCO3固体,再分别加入30 mL0.3 mol·L-1盐酸,充分反应后,用手触摸试管,明显感觉到加Na2CO3固体的试管变热了,加NaHCO3固体的试管变冷了。甲同学由此得出结论: (aq)+2H+(aq)=H2O(l)+CO2(g) △H1<0,
(aq)+2H+(aq)=H2O(l)+CO2(g) △H1<0, (aq)+H+ (aq) =H2O(l) +CO2(g) △H2>0。回答下列问题:
(aq)+H+ (aq) =H2O(l) +CO2(g) △H2>0。回答下列问题:
(1)乙同学认为该实验不一定能得到甲同学的结论,因为碳酸钠或碳酸氢钠固体溶于水时会有能量变化,乙同学的观点_______ (填“合理”或“不合理”)。
(2)查阅资料:
反应I: (aq)+2H+(aq)=H2O(l)+CO2(g) △H1=-12.14kJ· mol-1
(aq)+2H+(aq)=H2O(l)+CO2(g) △H1=-12.14kJ· mol-1
反应II: (aq)+H+(aq)=H2O(l) +CO2(g) △H2 +12.64 kJ·mol-1
(aq)+H+(aq)=H2O(l) +CO2(g) △H2 +12.64 kJ·mol-1
反应III: (aq)+ H+ (aq)=
(aq)+ H+ (aq)= (aq) △H3=
(aq) △H3=_______ kJ·mol-1
②向VmLc mol·L-1碳酸钠溶液中,逐滴加入2V mL c mol·L-1稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是_______ (填标号)。
A.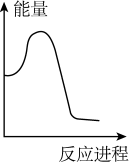 B.
B.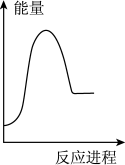 C.
C.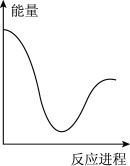 D.
D.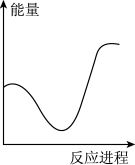
(3)该化学兴趣小组用如图所示装置设计实验验证碳酸钠、碳酸氢钠分别与稀盐酸反应的热效应。
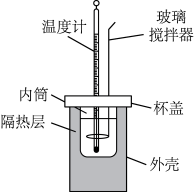
表格一:
表格二:
表格三:
实验操作:将试剂1与试剂2混合,测混合后溶液的温度,静置,冷却至定温,再将试剂3与之前的。混合溶液混合,再测混合溶液的温度。
①实验中玻璃搅拌器的使用方法是_______ (填 “顺时针搅动”“逆时针搅动”或“上下移动”)。
②表格二对应实验得出的结论是_______ 。
③反应IV:Na2CO3(s)+2H+(aq)= 2Na+(aq)+H2O(l)+CO2(g) △H4;
反应V:NaHCO3(s)+H+(aq)=Na+(aq)+H2O(1)+CO2(g) △H5
则△H1_______ △H4(填“>”“ <”或“=”,下同),△H2_______ △H5。
 (aq)+2H+(aq)=H2O(l)+CO2(g) △H1<0,
(aq)+2H+(aq)=H2O(l)+CO2(g) △H1<0, (aq)+H+ (aq) =H2O(l) +CO2(g) △H2>0。回答下列问题:
(aq)+H+ (aq) =H2O(l) +CO2(g) △H2>0。回答下列问题:(1)乙同学认为该实验不一定能得到甲同学的结论,因为碳酸钠或碳酸氢钠固体溶于水时会有能量变化,乙同学的观点
(2)查阅资料:
反应I:
 (aq)+2H+(aq)=H2O(l)+CO2(g) △H1=-12.14kJ· mol-1
(aq)+2H+(aq)=H2O(l)+CO2(g) △H1=-12.14kJ· mol-1反应II:
 (aq)+H+(aq)=H2O(l) +CO2(g) △H2 +12.64 kJ·mol-1
(aq)+H+(aq)=H2O(l) +CO2(g) △H2 +12.64 kJ·mol-1反应III:
 (aq)+ H+ (aq)=
(aq)+ H+ (aq)= (aq) △H3=
(aq) △H3=②向VmLc mol·L-1碳酸钠溶液中,逐滴加入2V mL c mol·L-1稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是
A.
 B.
B. C.
C. D.
D.
(3)该化学兴趣小组用如图所示装置设计实验验证碳酸钠、碳酸氢钠分别与稀盐酸反应的热效应。

表格一:
| 试剂1 | 试剂2混合前温度/℃ | 混合后温度/℃ |
| 0.5 g Na2CO3 | 40mL HCl 19.0 | 21.7 |
| 0.5 g NaHCO3 | 40 mL HCl 19.0 | 18.1 |
| 试剂1 | 试剂2混合前温度/℃ | 溶解后温度/℃ | 静置后的温度/℃ | 试剂3混合前温度/℃ | 混合后温度/℃ |
| 0.5 g Na2CO3 | 10mLH2O19.0 | 22.3 | 19.0 | 10mLH2O19.0 | 19.0 |
| 0.5 g NaHCO3 | 10mLH2O19.0 | 17.5 | 19.0 | 10mLH2O19.0 | 19.0 |
| 试剂1 | 试剂2混合温度/℃ | 溶解后温度/℃ | 静置后的温度/℃ | 试剂3混合前温度/℃ | 混合后温度/℃ |
| 0.5 g Na2CO3 | 10mLH2O19.0 | 22.3 | 19.0 | 10mLHCl19.0 | 20.5 |
| 0.5 g NaHCO3 | 10mLH2O19.0 | 17.5 | 19.0 | 10mLHCl19.0 | 18.3 |
①实验中玻璃搅拌器的使用方法是
②表格二对应实验得出的结论是
③反应IV:Na2CO3(s)+2H+(aq)= 2Na+(aq)+H2O(l)+CO2(g) △H4;
反应V:NaHCO3(s)+H+(aq)=Na+(aq)+H2O(1)+CO2(g) △H5
则△H1
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】碘单质及其化合物在生产、生活中有广泛应用。回答下列问题:
(1)已知几种共价键键能数据如图所示。

__________  。
。
(2)NH4I分解温度为235℃,HI分解温度为300℃。
①卤化铵分解与产物稳定性有关,产物越稳定,卤化铵(NH4X)越容易分解。NH4I、NH4Br、NH4Cl、NH4F的热分解温度由高到低排序为_____________ 。
②某温度下,在恒容密闭容器中加入适量的NH4I(s),仅发生下列反应:反应Ⅰ: ;反应Ⅱ:
;反应Ⅱ: 。随着反应的进行,产物物质的量随时间的变化曲线如图所示。
。随着反应的进行,产物物质的量随时间的变化曲线如图所示。__________ (填“甲”“乙”或“丙”)代表 物质的量随时间变化曲线;该温度下,反应Ⅱ的平衡常数
物质的量随时间变化曲线;该温度下,反应Ⅱ的平衡常数
__________ 。
ⅱ.进一步研究发现,其他条件不变,升高温度时甲曲线平台下移,其可能的原因是_____________ (写出化学方程式)。
(3)1925年VanArkn和DeBoer发明了碘化钛热分解法制备高纯钛。装置如图所示:
 ;
;
副反应: ,
, 。
。
①主反应中
__________ 0(填“>”“<”或“=”),简述提纯钛的原理:_____________ 。
②钛沉积速率与钛丝温度关系如图所示。温度高1500℃时,钛沉积速率降低的主要原因可能是______________ 。
(1)已知几种共价键键能数据如图所示。


 。
。(2)NH4I分解温度为235℃,HI分解温度为300℃。
①卤化铵分解与产物稳定性有关,产物越稳定,卤化铵(NH4X)越容易分解。NH4I、NH4Br、NH4Cl、NH4F的热分解温度由高到低排序为
②某温度下,在恒容密闭容器中加入适量的NH4I(s),仅发生下列反应:反应Ⅰ:
 ;反应Ⅱ:
;反应Ⅱ: 。随着反应的进行,产物物质的量随时间的变化曲线如图所示。
。随着反应的进行,产物物质的量随时间的变化曲线如图所示。
 物质的量随时间变化曲线;该温度下,反应Ⅱ的平衡常数
物质的量随时间变化曲线;该温度下,反应Ⅱ的平衡常数
ⅱ.进一步研究发现,其他条件不变,升高温度时甲曲线平台下移,其可能的原因是
(3)1925年VanArkn和DeBoer发明了碘化钛热分解法制备高纯钛。装置如图所示:


 ;
;副反应:
 ,
, 。
。①主反应中

②钛沉积速率与钛丝温度关系如图所示。温度高1500℃时,钛沉积速率降低的主要原因可能是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】低碳生活,幸福你我,科学家研究利用回收的 制取甲醛,反应的热化学方程式为
制取甲醛,反应的热化学方程式为 .请回答下列问题:
.请回答下列问题:
(1)已知:①

②相关化学键的键能数据如表所示:
则
_______ .
(2)一定条件下,将 的混合气体充入恒温恒压的密闭容器中,发生反
的混合气体充入恒温恒压的密闭容器中,发生反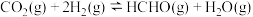 .
.
①下列不能说明反应已经达到平衡状态的是______ (填标号).
a.容器内气体密度保持不变 b.H2的体积分数保持不变
c.该反应的平衡常数保持不变 d.混合气体的平均相对分子质量不变
②下列措施既能提高H2的转化率又能加快反应速率的是__________ (填标号).
a.降低温度 b.使用高效催化剂 c.增大压强
(3)实验室在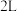 密闭容器中进行模拟上述合成
密闭容器中进行模拟上述合成 的实验.
的实验.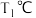 时,将体积比为
时,将体积比为 的CO2和H2混合气体充入容器中,每隔一定时间测得容器内气体压强如表所示:
的CO2和H2混合气体充入容器中,每隔一定时间测得容器内气体压强如表所示:
①已知, ,则反应开始至
,则反应开始至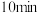 时,用
时,用 的压强变化表示该反应的平均反应速率为
的压强变化表示该反应的平均反应速率为_______  .
.
②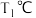 时,反应的平衡常数
时,反应的平衡常数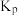 的代数式为
的代数式为
_______  (
(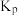 为用各气体分压表示的平衡常数,分压=总压×物质的量分数).
为用各气体分压表示的平衡常数,分压=总压×物质的量分数).
(4) 时,向体积为2L的恒容密闭容器中充入一定量的H2和CO2的混合气体,容器内气体压强为
时,向体积为2L的恒容密闭容器中充入一定量的H2和CO2的混合气体,容器内气体压强为 ,反应达到平衡时,HCHO的分压与起始的
,反应达到平衡时,HCHO的分压与起始的 关系如图所示:
关系如图所示:
①当 时,反应达到平衡后,若再向容器中加入
时,反应达到平衡后,若再向容器中加入 和
和 ,使二者分压均增大
,使二者分压均增大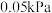 ,则达到新平衡时,H2的转化率将
,则达到新平衡时,H2的转化率将________ (填“增大”“减小”或“不变”).
②当 时,达到平衡状态后,HCHO的分压可能是图象中的点
时,达到平衡状态后,HCHO的分压可能是图象中的点__________ (填“D”“E”或“F”),原因为____________________________________ .

 制取甲醛,反应的热化学方程式为
制取甲醛,反应的热化学方程式为 .请回答下列问题:
.请回答下列问题:(1)已知:①


②相关化学键的键能数据如表所示:
化学键 |
|
|
|
键能/ | 498 | a | 464 |

(2)一定条件下,将
 的混合气体充入恒温恒压的密闭容器中,发生反
的混合气体充入恒温恒压的密闭容器中,发生反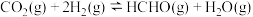 .
.①下列不能说明反应已经达到平衡状态的是
a.容器内气体密度保持不变 b.H2的体积分数保持不变
c.该反应的平衡常数保持不变 d.混合气体的平均相对分子质量不变
②下列措施既能提高H2的转化率又能加快反应速率的是
a.降低温度 b.使用高效催化剂 c.增大压强
(3)实验室在
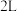 密闭容器中进行模拟上述合成
密闭容器中进行模拟上述合成 的实验.
的实验.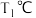 时,将体积比为
时,将体积比为 的CO2和H2混合气体充入容器中,每隔一定时间测得容器内气体压强如表所示:
的CO2和H2混合气体充入容器中,每隔一定时间测得容器内气体压强如表所示:时间/ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
压强/ | 1.08 | 0.96 | 0.88 | 0.82 | 0.80 | 0.80 | 0.80 |
 ,则反应开始至
,则反应开始至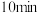 时,用
时,用 的压强变化表示该反应的平均反应速率为
的压强变化表示该反应的平均反应速率为 .
.②
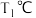 时,反应的平衡常数
时,反应的平衡常数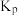 的代数式为
的代数式为
 (
(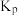 为用各气体分压表示的平衡常数,分压=总压×物质的量分数).
为用各气体分压表示的平衡常数,分压=总压×物质的量分数).(4)
 时,向体积为2L的恒容密闭容器中充入一定量的H2和CO2的混合气体,容器内气体压强为
时,向体积为2L的恒容密闭容器中充入一定量的H2和CO2的混合气体,容器内气体压强为 ,反应达到平衡时,HCHO的分压与起始的
,反应达到平衡时,HCHO的分压与起始的 关系如图所示:
关系如图所示:①当
 时,反应达到平衡后,若再向容器中加入
时,反应达到平衡后,若再向容器中加入 和
和 ,使二者分压均增大
,使二者分压均增大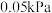 ,则达到新平衡时,H2的转化率将
,则达到新平衡时,H2的转化率将②当
 时,达到平衡状态后,HCHO的分压可能是图象中的点
时,达到平衡状态后,HCHO的分压可能是图象中的点
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】我国将在2030年前实现碳达峰、2060年前实现碳中和。 的资源化利用能有效减少
的资源化利用能有效减少 排放,某研究小组利用工业废气中的
排放,某研究小组利用工业废气中的 在催化剂的作用下合成甲醇,发生反应:
在催化剂的作用下合成甲醇,发生反应:
已知:Ⅰ.
Ⅱ.
(1)根据以上化学反应方程式,计算反应热
_______ 。
(2)下列有关合成甲醇的说法中正确的是_______(填标号)。
(3)反应温度和催化剂组成与反应物 的转化率和产物甲醇的选择性高度相关。改变温度和催化剂组成,控制其他条件相同进行四组实验,得到的实验数据如下表所示:
的转化率和产物甲醇的选择性高度相关。改变温度和催化剂组成,控制其他条件相同进行四组实验,得到的实验数据如下表所示:
注:“甲醇选择性”是指生成甲醇的二氧化碳占所有参与反应的二氧化碳的百分比。
结合表中数据可知,用 生产甲醇的最优条件为
生产甲醇的最优条件为_______ (填实验编号)。
(4)下图为一定温度下, 时,氢气的转化率
时,氢气的转化率 与投料比
与投料比
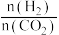 的关系图像,请在图中画出相同温度下,压强为
的关系图像,请在图中画出相同温度下,压强为 时对应的变化曲线。
时对应的变化曲线。_________

(5)某研究小组采用甲醇燃料电池,以石墨为电极材料进行电解饱和NaCl溶液的实验,装置如图所示:

①甲醇燃料电池工作时,甲醇应由_______ (填“a”或“b”)口通入。该燃料电池的正极反应式为_______ 。
②电解一段时间后,c1、c2电极上均有气体产生,其中c2电极上得到的是_______ ,电解NaCl溶液的离子方程式为_______ 。
 的资源化利用能有效减少
的资源化利用能有效减少 排放,某研究小组利用工业废气中的
排放,某研究小组利用工业废气中的 在催化剂的作用下合成甲醇,发生反应:
在催化剂的作用下合成甲醇,发生反应:
已知:Ⅰ.

Ⅱ.

(1)根据以上化学反应方程式,计算反应热

(2)下列有关合成甲醇的说法中正确的是_______(填标号)。
| A.增大氢气的浓度,有利于提高甲醇的产率 |
| B.选择合适的催化剂,有利于平衡正向移动 |
| C.低温有利于平衡正向移动,因此实际生产中温度越低越好 |
| D.高压有利于平衡正向移动,因此实际生产中压强越高越好 |
 的转化率和产物甲醇的选择性高度相关。改变温度和催化剂组成,控制其他条件相同进行四组实验,得到的实验数据如下表所示:
的转化率和产物甲醇的选择性高度相关。改变温度和催化剂组成,控制其他条件相同进行四组实验,得到的实验数据如下表所示:| 实验编号 | 温度/℃ | 催化剂组成 |  转化率/% 转化率/% | 甲醇选择性/% |
| 甲 | 250 | 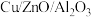 | 12.3 | 42.3 |
| 乙 | 250 | 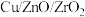 | 30.3 | 87.2 |
| 丙 | 300 | 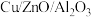 | 15.3 | 38.5 |
| 丁 | 300 | 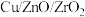 | 30.5 | 60.2 |
结合表中数据可知,用
 生产甲醇的最优条件为
生产甲醇的最优条件为(4)下图为一定温度下,
 时,氢气的转化率
时,氢气的转化率 与投料比
与投料比
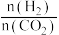 的关系图像,请在图中画出相同温度下,压强为
的关系图像,请在图中画出相同温度下,压强为 时对应的变化曲线。
时对应的变化曲线。
(5)某研究小组采用甲醇燃料电池,以石墨为电极材料进行电解饱和NaCl溶液的实验,装置如图所示:

①甲醇燃料电池工作时,甲醇应由
②电解一段时间后,c1、c2电极上均有气体产生,其中c2电极上得到的是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】合成氨是人类科学技术上的一项重大突破,氨有广泛的应用。
已知:N2(g)+3H2(g) 2NH3(g) ∆H1=-a kJ∙mol-1;
2NH3(g) ∆H1=-a kJ∙mol-1;
2H2(g)+O2(g) 2H2O(l) ∆H2=-b kJ∙mol-1
2H2O(l) ∆H2=-b kJ∙mol-1
(1)有研究报道,在常温、常压、光照条件下,N2在特殊催化剂表面与H2O反应可生成NH3。则由N2与H2O反应生成NH3的热化学方程式是___________ 。
(2)工业上主要以N2(g)、H2(g)为原料气合成NH3。
①将物质的量之比为1:3的N2和H2充入2L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
该条件下H2的转化率为___________ (可用分数表示),平衡常数K=___________ (可用分数表示)。
②若按以下浓度投料,其它反应条件与①相同,起始时反应进行的方向为___________ (填“正向”、“逆向”或“无法判断”)。
③L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。
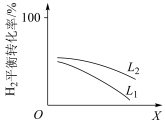
i.X代表的物理量是___________ 。
ii.判断L1、L2的大小关系,并简述理由___________ 。
已知:N2(g)+3H2(g)
 2NH3(g) ∆H1=-a kJ∙mol-1;
2NH3(g) ∆H1=-a kJ∙mol-1;2H2(g)+O2(g)
 2H2O(l) ∆H2=-b kJ∙mol-1
2H2O(l) ∆H2=-b kJ∙mol-1(1)有研究报道,在常温、常压、光照条件下,N2在特殊催化剂表面与H2O反应可生成NH3。则由N2与H2O反应生成NH3的热化学方程式是
(2)工业上主要以N2(g)、H2(g)为原料气合成NH3。
①将物质的量之比为1:3的N2和H2充入2L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
物质 | N2 | H2 | NH3 |
平衡时物质的量/mol | 0.2 | 0.6 | 0.2 |
②若按以下浓度投料,其它反应条件与①相同,起始时反应进行的方向为
物质 | N2 | H2 | NH3 |
起始浓度(mol/L) | 0.5 | 1.5 | 0.5 |

i.X代表的物理量是
ii.判断L1、L2的大小关系,并简述理由
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某电镀废水中的铬元素以Cr3+和CrO 的形式存在,其总铬含量的测定方法如下:
的形式存在,其总铬含量的测定方法如下:
步骤一:取100mL废水,加热浓缩成20.00mL溶液,然后加入NaOH溶液将Cr3+转化为CrO ;
;
步骤二:加入稍过量的H2O2,使CrO2在碱性条件下转化成CrO ;
;
步骤三:加入硫酸酸化并煮沸后,加入足量的KI将CrO 还原为Cr3+,同时生成单质I2;
还原为Cr3+,同时生成单质I2;
步骤四:加入指示剂用 溶液滴定,滴定过程中消耗
溶液滴定,滴定过程中消耗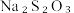 溶液30.00mL。
溶液30.00mL。
已知: I2+2S2O
I2+2S2O =S4O
=S4O +2I-,请回答下列问题:
+2I-,请回答下列问题:
(1)CrO 中铬元素价态为
中铬元素价态为___________ 。
(2)步骤一中将Cr3+转化为CrO 的离子反应方程式为:
的离子反应方程式为:___________ 。
(3)“步骤三”中加硫酸酸化时存在反应2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O ΔH<0,升高温度溶液变为
(橙色)+H2O ΔH<0,升高温度溶液变为___________ 色。
(4)“步骤四”中加入的指示剂为___________ ,滴定终点现象为___________ 。
(5)该废水中铬元素的含量为___________ g/L。
(6)若“步骤三”省略加热煮沸操作会导致废水中铬元素含量的测量结果偏高,原因可能为___________ 。
 的形式存在,其总铬含量的测定方法如下:
的形式存在,其总铬含量的测定方法如下:步骤一:取100mL废水,加热浓缩成20.00mL溶液,然后加入NaOH溶液将Cr3+转化为CrO
 ;
;步骤二:加入稍过量的H2O2,使CrO2在碱性条件下转化成CrO
 ;
;步骤三:加入硫酸酸化并煮沸后,加入足量的KI将CrO
 还原为Cr3+,同时生成单质I2;
还原为Cr3+,同时生成单质I2;步骤四:加入指示剂用
 溶液滴定,滴定过程中消耗
溶液滴定,滴定过程中消耗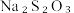 溶液30.00mL。
溶液30.00mL。已知:
 I2+2S2O
I2+2S2O =S4O
=S4O +2I-,请回答下列问题:
+2I-,请回答下列问题:(1)CrO
 中铬元素价态为
中铬元素价态为(2)步骤一中将Cr3+转化为CrO
 的离子反应方程式为:
的离子反应方程式为:(3)“步骤三”中加硫酸酸化时存在反应2CrO
 (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O ΔH<0,升高温度溶液变为
(橙色)+H2O ΔH<0,升高温度溶液变为(4)“步骤四”中加入的指示剂为
(5)该废水中铬元素的含量为
(6)若“步骤三”省略加热煮沸操作会导致废水中铬元素含量的测量结果偏高,原因可能为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】在保温杯式量热计中(如图),将 、
、 溶液与
溶液与 、
、 溶液混合,温度从
溶液混合,温度从 升高到
升高到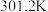 。(已知:低浓度
。(已知:低浓度 溶液比热容
溶液比热容 ,溶液的密度为
,溶液的密度为 )
)
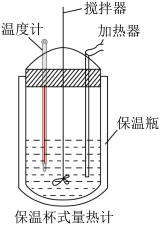
(1)有关中和热测定,下列说法正确的是_______。
(2)实验中 溶液过量的目的是
溶液过量的目的是_______ 。
(3)通过计算,写出 中和反应热方程式
中和反应热方程式_______ 。
(4)化学反应速率、化学平衡理论通过大量化学实验进行验证,在重铬酸钾溶液中存在 (橙色)与
(橙色)与 (黄色)之间的平衡体系,若向体系中加入足量70%的硫酸,溶液呈橙色,则该平衡体系的离子方程式为
(黄色)之间的平衡体系,若向体系中加入足量70%的硫酸,溶液呈橙色,则该平衡体系的离子方程式为_______ 。
(5)向 稀盐酸中加入
稀盐酸中加入 氯化钴溶液发生反应:
氯化钴溶液发生反应:
 ,平衡时溶液呈浅紫色。下列说法
,平衡时溶液呈浅紫色。下列说法错误 的是_______。
 、
、 溶液与
溶液与 、
、 溶液混合,温度从
溶液混合,温度从 升高到
升高到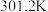 。(已知:低浓度
。(已知:低浓度 溶液比热容
溶液比热容 ,溶液的密度为
,溶液的密度为 )
)
(1)有关中和热测定,下列说法正确的是_______。
| A.测定中和热的实验中,至少需要测定并记录温度的次数是3次 |
B.表示中和热的离子方程式为:  |
C.若改用 盐酸跟 盐酸跟 的 的 溶液进行反应,所放出热量相等 溶液进行反应,所放出热量相等 |
| D.用保温杯式量热计来代替烧杯做测定中和热的实验,能有效防止热量损失 |
 溶液过量的目的是
溶液过量的目的是(3)通过计算,写出
 中和反应热方程式
中和反应热方程式(4)化学反应速率、化学平衡理论通过大量化学实验进行验证,在重铬酸钾溶液中存在
 (橙色)与
(橙色)与 (黄色)之间的平衡体系,若向体系中加入足量70%的硫酸,溶液呈橙色,则该平衡体系的离子方程式为
(黄色)之间的平衡体系,若向体系中加入足量70%的硫酸,溶液呈橙色,则该平衡体系的离子方程式为(5)向
 稀盐酸中加入
稀盐酸中加入 氯化钴溶液发生反应:
氯化钴溶液发生反应:
 ,平衡时溶液呈浅紫色。下列说法
,平衡时溶液呈浅紫色。下列说法| A.加热溶液会逐渐变成蓝色 |
B.向溶液中加 ,如果生成白色沉淀说明该反应存在限度 ,如果生成白色沉淀说明该反应存在限度 |
| C.加入少量水,平衡会逆向移动 |
D.加入 固体,平衡右移,但平衡常数不变 固体,平衡右移,但平衡常数不变 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】氮可形成多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是 和
和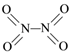 。实验测得N-N键键能167kJ·mol-1,NO2中氮氧键的平均键能466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能167kJ·mol-1,NO2中氮氧键的平均键能466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
(1)写出N2O4转化为NO2的热化学方程式_________________________
(2)对反应N2O4(g) 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是______

A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.400mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为_____ mol·(L·s)-1。
②n3____ n4(填“>”、“<”或“=”),该反应的平衡常数K的值为_____________ ,升高温度后,反应2NO2 N2O4的平衡常数K将
N2O4的平衡常数K将_______ (填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是_____________ mol·L-1。
④计算③中条件下达到平衡后混合气体的平均相对分子质量为____________ 。(结果保留小数点后一位)
 和
和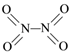 。实验测得N-N键键能167kJ·mol-1,NO2中氮氧键的平均键能466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能167kJ·mol-1,NO2中氮氧键的平均键能466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。(1)写出N2O4转化为NO2的热化学方程式
(2)对反应N2O4(g)
 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.400mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为
②n3
 N2O4的平衡常数K将
N2O4的平衡常数K将③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是
④计算③中条件下达到平衡后混合气体的平均相对分子质量为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】在铜、银催化下,乙烯与氧气反应生成环氧乙烷( )和乙醛,下图是该反应的部分历程。
)和乙醛,下图是该反应的部分历程。

(2)鉴别以上产物乙醛和环氧乙烷可以用___________。
| A.原子发射光谱 | B.原子吸收光谱 | C.核磁共振氢谱 | D.红外光谱 |
(3)以下电子排布式和价电子轨道表示式中,正确且对应微粒为基态原子的是___________。
A.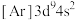 | B.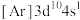 |
C. | D.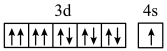 |
(4)已知
 的熔点为1235℃,
的熔点为1235℃, 的熔点为1130℃,二者晶体结构类似,且熔点都较高,但
的熔点为1130℃,二者晶体结构类似,且熔点都较高,但 熔点比
熔点比 高,其原因是
高,其原因是(5)
 晶胞结构如图所示,其中
晶胞结构如图所示,其中 代表的原子是
代表的原子是 ,晶胞参数为a pm,则阿伏加德罗常数值
,晶胞参数为a pm,则阿伏加德罗常数值
 和a的代数式表示)
和a的代数式表示)
 可以形成一种配位化合物,其结构如下图所示。以下说法正确的是___________。
可以形成一种配位化合物,其结构如下图所示。以下说法正确的是___________。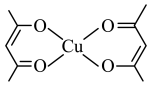
A. 的配位数是2 的配位数是2 |
| B.此配合物中存在配位键、极性键、非极性键 |
| C.配体中O原子提供空轨道 |
D. 提供孤电子对 提供孤电子对 |
(7)已知:常温下,①
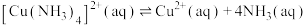
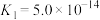 ;
;②


则常温下
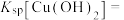
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】工业废气、汽车尾气排放出的NOx、SO2等是形成酸雨的主要物质,其综合治理是当前重要的研究课题。回答下列问题:
Ⅰ.NOx的消除
(1)汽车尾气中的 和
和 在一定温度和催化剂条件下可发生如下反应:
在一定温度和催化剂条件下可发生如下反应:
2NO(g)+2CO(g)⇌N2(g)+2CO2(g) △H。
若已知:①CO的燃烧热△H1=-283.0 kJ·mol
②N2(g)+O2(g)⇌2NO(g) △H2=+180.5 kJ·mol
则反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)的
_______ 。
(2)T℃下,向一容积不变的密闭容器中通入一定量的 和
和 ,用气体传感器测得不同时间
,用气体传感器测得不同时间 和
和 的浓度如下表:
的浓度如下表:
则c2合理的数值为_______ (填字母代号)。
A.2.85 B.2.95 C.3.00 D.4.20
(3)某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图所示。下列说法正确的是_______ (填字母代号)。
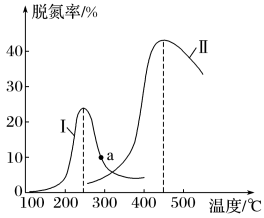
A.曲线Ⅱ中催化剂脱氮率比曲线Ⅰ中的高
B.相同条件下,改变压强对脱氮率没有影响
C.曲线Ⅱ中的催化剂适用于450℃左右脱氮
D.两种催化剂均能降低活化能,但 不变
不变
Ⅱ.SO2的综合利用
(4)某研究小组对反应NO2(g)+SO2(g)⇌SO3(g)+NO(g) 进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(NO2):n0(SO2)]进行多组实验(各组实验的温度可能相同,也可能不同),测定NO2的平衡转化率
进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(NO2):n0(SO2)]进行多组实验(各组实验的温度可能相同,也可能不同),测定NO2的平衡转化率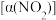 。部分实验结果如图所示。
。部分实验结果如图所示。

①图中A点对应温度下,该反应的化学平衡常数
_______ 。
②如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是_______ 。
Ⅰ.NOx的消除
(1)汽车尾气中的
 和
和 在一定温度和催化剂条件下可发生如下反应:
在一定温度和催化剂条件下可发生如下反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g) △H。
若已知:①CO的燃烧热△H1=-283.0 kJ·mol
②N2(g)+O2(g)⇌2NO(g) △H2=+180.5 kJ·mol
则反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)的

(2)T℃下,向一容积不变的密闭容器中通入一定量的
 和
和 ,用气体传感器测得不同时间
,用气体传感器测得不同时间 和
和 的浓度如下表:
的浓度如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(×10-4 mol/L) | 8.50 | 4.50 | c1 | 1.50 | 1.00 | 1.00 |
| c(CO)/(×10-3 mol/L) | 3.45 | 3.05 | c2 | 2.75 | 2.70 | 2.70 |
A.2.85 B.2.95 C.3.00 D.4.20
(3)某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图所示。下列说法正确的是

A.曲线Ⅱ中催化剂脱氮率比曲线Ⅰ中的高
B.相同条件下,改变压强对脱氮率没有影响
C.曲线Ⅱ中的催化剂适用于450℃左右脱氮
D.两种催化剂均能降低活化能,但
 不变
不变Ⅱ.SO2的综合利用
(4)某研究小组对反应NO2(g)+SO2(g)⇌SO3(g)+NO(g)
 进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(NO2):n0(SO2)]进行多组实验(各组实验的温度可能相同,也可能不同),测定NO2的平衡转化率
进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(NO2):n0(SO2)]进行多组实验(各组实验的温度可能相同,也可能不同),测定NO2的平衡转化率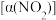 。部分实验结果如图所示。
。部分实验结果如图所示。
①图中A点对应温度下,该反应的化学平衡常数

②如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是
您最近一年使用:0次