名校
解题方法
1 . 丙烯是重要的化工原料,可用于生产丙醇、卤代烃和塑料。回答下列问题:
(1)工业上用丙烯加成法制备1,2-二氯丙烷,主要副产物为3-氯丙烯,反应原理为:
①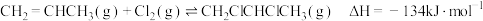
②
已知: 的活化能
的活化能 为
为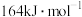 ,则该反应的活化能
,则该反应的活化能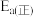 为
为___________  。
。
(2)某研究小组向密闭容器中充入一定量的 和
和 ,分别在
,分别在 、
、 两种不同催化剂作用下发生反应①,一段时间后测得
两种不同催化剂作用下发生反应①,一段时间后测得 的产率与温度的关系如下图所示。
的产率与温度的关系如下图所示。___________ (填代号)。
A.使用催化剂 的最佳温度约为
的最佳温度约为
B.相同条件下,改变压强不影响 的产率
的产率
C.两种催化剂均能降低反应的活化能,但 不变
不变
D.P点是对应温度下 的平衡产率
的平衡产率
②在催化剂 作用下,温度低于
作用下,温度低于 时,
时, 的产率随温度升高变化不大,主要原因是
的产率随温度升高变化不大,主要原因是___________ 。
(3) 在不同温度下达到平衡,在总压强分别为
在不同温度下达到平衡,在总压强分别为 和
和 时,测得丙烷及丙烯的物质的量分数如图所示。
时,测得丙烷及丙烯的物质的量分数如图所示。___________ (填“丙烷”或“丙烯”),
___________  (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
②起始时充入一定量丙烷,在恒压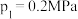 条件下发生反应,
条件下发生反应, 点对应温度下丙烷的转化率为
点对应温度下丙烷的转化率为___________ (保留1位小数),该反应的平衡常数
___________ 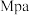 (用平衡分压代替平衡浓度计算,分压
(用平衡分压代替平衡浓度计算,分压 总压
总压 物质的量分数)。
物质的量分数)。
(1)工业上用丙烯加成法制备1,2-二氯丙烷,主要副产物为3-氯丙烯,反应原理为:
①
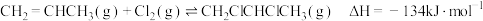
②

已知:
 的活化能
的活化能 为
为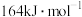 ,则该反应的活化能
,则该反应的活化能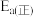 为
为 。
。(2)某研究小组向密闭容器中充入一定量的
 和
和 ,分别在
,分别在 、
、 两种不同催化剂作用下发生反应①,一段时间后测得
两种不同催化剂作用下发生反应①,一段时间后测得 的产率与温度的关系如下图所示。
的产率与温度的关系如下图所示。
A.使用催化剂
 的最佳温度约为
的最佳温度约为
B.相同条件下,改变压强不影响
 的产率
的产率C.两种催化剂均能降低反应的活化能,但
 不变
不变D.P点是对应温度下
 的平衡产率
的平衡产率②在催化剂
 作用下,温度低于
作用下,温度低于 时,
时, 的产率随温度升高变化不大,主要原因是
的产率随温度升高变化不大,主要原因是(3)
 在不同温度下达到平衡,在总压强分别为
在不同温度下达到平衡,在总压强分别为 和
和 时,测得丙烷及丙烯的物质的量分数如图所示。
时,测得丙烷及丙烯的物质的量分数如图所示。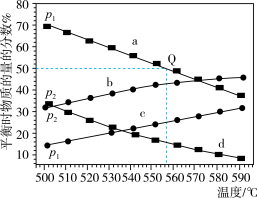

 (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。②起始时充入一定量丙烷,在恒压
 条件下发生反应,
条件下发生反应, 点对应温度下丙烷的转化率为
点对应温度下丙烷的转化率为
 (用平衡分压代替平衡浓度计算,分压
(用平衡分压代替平衡浓度计算,分压 总压
总压 物质的量分数)。
物质的量分数)。
您最近一年使用:0次
2023-12-19更新
|
616次组卷
|
4卷引用:2024届四川省自贡市普高高三上学期第一次诊断性考试理综试题
2024届四川省自贡市普高高三上学期第一次诊断性考试理综试题河南省焦作市博爱县第一中学2023-2024学年高三下学期开学化学试题(已下线)专题10 化学反应原理综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)大题04 化学反应原理综合题(逐空突破)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)
名校
解题方法
2 . “低碳经济”已成为全世界科学家研究的重要课题。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)已知:
①CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
②C(s)+2H2(g) CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
③2CO(g) C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:___________ 。
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,在容积为2L密闭容器中,充入1molCO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图所示:
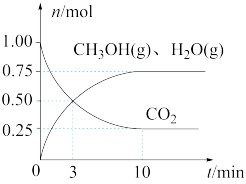
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________ 。
②下列措施一定能使CO2的转化率增大的是___________ 。
A.在原容器中再充入1molCO2 B.在原容器中再充入1molH2
C.在原容器中充入1mol氦气 D.使用更有效的催化剂
(3)高温下,CO2与足量的碳在密闭容器中实现反应:C(s)+CO2(g) 2CO(g)。向容积为1L的恒容容器中加入0.2molCO2,在不同温度下达到平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示。则该反应为
2CO(g)。向容积为1L的恒容容器中加入0.2molCO2,在不同温度下达到平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示。则该反应为___________ (填“放热”或“吸热”)反应,某温度下,若向该平衡体系中再通入0.2molCO2,平衡___________ (填“正向”“逆向”或“不”)移动,达到新平衡后,体系中CO的百分含量___________ (填“变大”“变小”或“不变”)。

(4)在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的CO和H2,发生反应CO(g)+2H2(g) CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与
CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与 的关系如下图所示。
的关系如下图所示。
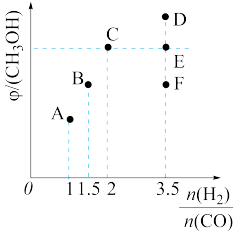
① =2时,经过5min达到平衡,CO的转化率为0.6,则该反应的化学平衡常数K=
=2时,经过5min达到平衡,CO的转化率为0.6,则该反应的化学平衡常数K=___________ (保留一位小数)。若此刻再向容器中加入CO(g)和CH3OH(g)各0.4mol,达到新平衡时H2的转化率将___________ (填“增大”“减小”或“不变”)。
②当 =3.5时,达到平衡后,CH3OH的体积分数可能是图象中的
=3.5时,达到平衡后,CH3OH的体积分数可能是图象中的___________ (填“D”“E”或“F”)点。
(1)已知:
①CO(g)+H2O(g)
 H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1②C(s)+2H2(g)
 CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1③2CO(g)
 C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,在容积为2L密闭容器中,充入1molCO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图所示:

①从反应开始到平衡,氢气的平均反应速率v(H2)=
②下列措施一定能使CO2的转化率增大的是
A.在原容器中再充入1molCO2 B.在原容器中再充入1molH2
C.在原容器中充入1mol氦气 D.使用更有效的催化剂
(3)高温下,CO2与足量的碳在密闭容器中实现反应:C(s)+CO2(g)
 2CO(g)。向容积为1L的恒容容器中加入0.2molCO2,在不同温度下达到平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示。则该反应为
2CO(g)。向容积为1L的恒容容器中加入0.2molCO2,在不同温度下达到平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示。则该反应为
(4)在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的CO和H2,发生反应CO(g)+2H2(g)
 CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与
CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与 的关系如下图所示。
的关系如下图所示。
①
 =2时,经过5min达到平衡,CO的转化率为0.6,则该反应的化学平衡常数K=
=2时,经过5min达到平衡,CO的转化率为0.6,则该反应的化学平衡常数K=②当
 =3.5时,达到平衡后,CH3OH的体积分数可能是图象中的
=3.5时,达到平衡后,CH3OH的体积分数可能是图象中的
您最近一年使用:0次
2020-12-31更新
|
142次组卷
|
2卷引用:四川省自贡市田家柄中学教育集团2021-2022学年高二上学期期中考试化学试题



