11-12高二上·吉林·期末
1 . (1) 根据所学化学反应原理填空:
①升高温度时,水的pH________ (填“增大”“减小”或“不变”)
②体积、pH均相同的盐酸和醋酸溶液,中和等浓度的NaOH溶液时所需体积分别为V1、V2 。则V1_______ V2(填“<”、“>”或“=”)
③某反应放热且熵增加,该反应_________ 自发进行(用“能”或“不能”表示)
(2)依据事实,用化学用语填空:
①1 mol NO2气体与水完全反应生成硝酸溶液和NO气体,放出热量46 kJ。该反应的热化学方程式______________________________________ 。
②用离子方程式表示氯化铵溶液的酸碱性:_________________________________ 。
③用离子方程式表示向碳酸镁沉淀中加入NaOH溶液后的沉淀转化:
_______________________________________________________ 。
①升高温度时,水的pH
②体积、pH均相同的盐酸和醋酸溶液,中和等浓度的NaOH溶液时所需体积分别为V1、V2 。则V1
③某反应放热且熵增加,该反应
(2)依据事实,用化学用语填空:
①1 mol NO2气体与水完全反应生成硝酸溶液和NO气体,放出热量46 kJ。该反应的热化学方程式
②用离子方程式表示氯化铵溶液的酸碱性:
③用离子方程式表示向碳酸镁沉淀中加入NaOH溶液后的沉淀转化:
您最近一年使用:0次
10-11高二上·江西新余·阶段练习
解题方法
2 . 汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)===N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ/mol,ΔS=-145 J/(mol·K).
(1)为了提高该反应的速率和NO的转化率,采取的正确措施为________ .
(2)该反应达到平衡时若缩小体积,则混合气体的平均相对分子质量________ ,若升高温度,则该反应的平衡常数________ (均填“增大”、“减小”或“不变”).
(3)该条件下反应__________________ (填“能”或“不能”)自发进行.
(4)在如图中画出在某时刻条件改变后的图象_______ (其他条件不变).
t1:增大NO的浓度
t2:降低温度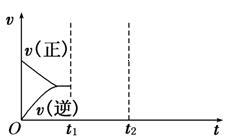
(1)为了提高该反应的速率和NO的转化率,采取的正确措施为
| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 | D.降低温度同时增大压强 |
(3)该条件下反应
(4)在如图中画出在某时刻条件改变后的图象
t1:增大NO的浓度
t2:降低温度

您最近一年使用:0次
10-11高二上·吉林·阶段练习
3 . 工业上用赤铁矿生产铁,可以选择的还原剂有C和H2,根据所学的知识判断:
已知:Fe2O3(s)+3/2C(s)=2Fe(s)+3/2CO2(g) ΔH=+233.8kJ/mol ΔS=279J/(K∙mol)
Fe2O3(s)+3H2(g)=2Fe(s)+3H2O(g) ΔH=+98kJ/mol ΔS=144.2J/(K∙mol)
问:哪一种还原剂可使反应自发进行的温度低?________ (要求计算过程)(保留三位有效数字)
已知:Fe2O3(s)+3/2C(s)=2Fe(s)+3/2CO2(g) ΔH=+233.8kJ/mol ΔS=279J/(K∙mol)
Fe2O3(s)+3H2(g)=2Fe(s)+3H2O(g) ΔH=+98kJ/mol ΔS=144.2J/(K∙mol)
问:哪一种还原剂可使反应自发进行的温度低?
您最近一年使用:0次
13-14高二·全国·课时练习
4 . 氨的工业合成工艺的成熟推动了人类文明的进步,不少科技工作者为了寻找廉价的氨的制备方法,进行了前赴后继的探索性工作。请回答下列各题:
用氢气和氮气合成氨是一个可逆反应,化学方程式如下:N2+3H2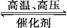 2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。
2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。
(1)请写出该反应的热化学方程式:____ 。
(2)如果一个反应的ΔH-TΔS<0,则该反应能够自发进行。已知该反应的ΔS=-198.2 J·K-1·mol-1。则上述氨气的合成反应在常温下____ (填“能”或“不能”)自发进行。
用氢气和氮气合成氨是一个可逆反应,化学方程式如下:N2+3H2
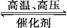 2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。
2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。(1)请写出该反应的热化学方程式:
(2)如果一个反应的ΔH-TΔS<0,则该反应能够自发进行。已知该反应的ΔS=-198.2 J·K-1·mol-1。则上述氨气的合成反应在常温下
您最近一年使用:0次
9-10高二下·浙江杭州·期中
5 . 合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g)⇌3NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用碳在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
(1)将水蒸气通过红热的炭即产生水煤气:C(s) + H2O(g)H2(g) + CO(g) △H = +131.3 kJ ,△S = +133.7 J/K该反应在低温下能否自发_______ (填:能或否)。
(2)合成氨工业中原料气压缩到30~50MPa的原因是_______ 。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是_______ 。
(3)已知在400℃时,N2 (g)+ 3H2(g)⇌2NH3(g) 的K=0.5。
①在400℃时, 2NH3(g)⇌N2 (g)+ 3H2(g)的K=_______ (填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正_______ V(N2)逆(填:>、<、=、不能确定)。
③500℃、50MPa时,在容积为2L的容器中加入1 mol N2、3mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x。则K和x的关系满足K=_______ 。
④在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是_______ (填序号)。
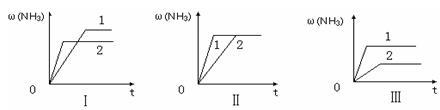
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是不同压强对反应的影响,且P1>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下,催化剂性能:1>2
(1)将水蒸气通过红热的炭即产生水煤气:C(s) + H2O(g)H2(g) + CO(g) △H = +131.3 kJ ,△S = +133.7 J/K该反应在低温下能否自发
(2)合成氨工业中原料气压缩到30~50MPa的原因是
(3)已知在400℃时,N2 (g)+ 3H2(g)⇌2NH3(g) 的K=0.5。
①在400℃时, 2NH3(g)⇌N2 (g)+ 3H2(g)的K=
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正
③500℃、50MPa时,在容积为2L的容器中加入1 mol N2、3mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x。则K和x的关系满足K=
④在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是

A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是不同压强对反应的影响,且P1>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下,催化剂性能:1>2
您最近一年使用:0次



