解题方法
1 . 已知甲烷隔绝空气在不同温度下有可能发生如下两个反应:①CH4(g)=C(s)+2H2(g),②2CH4(g)=C2H2(g)+3H2(g)。某同学为了得到用天然气制取炭黑的允许温度范围和最佳温度,在图书馆查到了如下热力学数据:
①的ΔH(298 K)=74.848 kJ·mol-1,ΔS(298 K)=80.674 J·mol-1·K-1
②的ΔH(298 K)=376.426 kJ·mol-1,ΔS(298 K)=220.211 J·mol-1·K-1
已知焓变和熵变随温度变化很小。请帮助这位同学考虑如下问题:
(1)判断②反应是高温自发还是低温自发:___________ (填“高温”或“低温”)。
(2)通过计算判断①反应在常温下能否自发进行:___________ 。
(3)求算制取炭黑的允许温度范围:___________ 。
(4)为了提高甲烷的碳化程度,你认为下面四个温度中最合适的是___________(填字母)。
①的ΔH(298 K)=74.848 kJ·mol-1,ΔS(298 K)=80.674 J·mol-1·K-1
②的ΔH(298 K)=376.426 kJ·mol-1,ΔS(298 K)=220.211 J·mol-1·K-1
已知焓变和熵变随温度变化很小。请帮助这位同学考虑如下问题:
(1)判断②反应是高温自发还是低温自发:
(2)通过计算判断①反应在常温下能否自发进行:
(3)求算制取炭黑的允许温度范围:
(4)为了提高甲烷的碳化程度,你认为下面四个温度中最合适的是___________(填字母)。
| A.905.2 K | B.927 K |
| C.1 273 K | D.2 000 K |
您最近一年使用:0次
22-23高一下·上海徐汇·期末
名校
解题方法
2 . 已知298K时有下列数据:
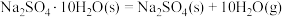
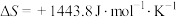
(1)上述反应在298K时能否自发进行?_____ 。
(2)该反应能自发进行的温度范围是_____ 。
| 物质 | 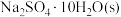 | 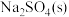 |  |
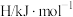 |  |  | 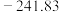 |
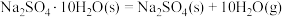
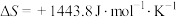
(1)上述反应在298K时能否自发进行?
(2)该反应能自发进行的温度范围是
您最近一年使用:0次
3 . (1)0.5 mol气态高能燃料乙硼烷 在氧气中燃烧生成固态三氧化二硼和液态水放出1082.5 kJ的热量,其热化学方程式为
在氧气中燃烧生成固态三氧化二硼和液态水放出1082.5 kJ的热量,其热化学方程式为_________ 。已知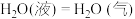
 ,则STP条件下,11.2 L乙硼烷完全燃烧生成气态水时放出的热量
,则STP条件下,11.2 L乙硼烷完全燃烧生成气态水时放出的热量____________
(2)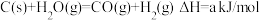 ,
,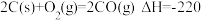
 ,又已知
,又已知 、
、 和
和 键的键能分别为
键的键能分别为 、
、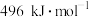 和
和 ,则a为
,则a为__________ 。
(3)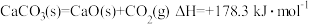 ,
, ,该反应能够自发进行,则温度所满足的条件是
,该反应能够自发进行,则温度所满足的条件是______________ 。
(4)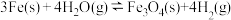 平衡常数的表达式为
平衡常数的表达式为____________ 。反应 的平衡常数为49,则该温度下反应
的平衡常数为49,则该温度下反应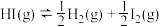 的平衡常数为
的平衡常数为____________ 。
 在氧气中燃烧生成固态三氧化二硼和液态水放出1082.5 kJ的热量,其热化学方程式为
在氧气中燃烧生成固态三氧化二硼和液态水放出1082.5 kJ的热量,其热化学方程式为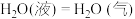
 ,则STP条件下,11.2 L乙硼烷完全燃烧生成气态水时放出的热量
,则STP条件下,11.2 L乙硼烷完全燃烧生成气态水时放出的热量(2)
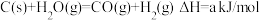 ,
,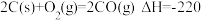
 ,又已知
,又已知 、
、 和
和 键的键能分别为
键的键能分别为 、
、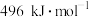 和
和 ,则a为
,则a为(3)
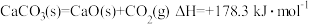 ,
, ,该反应能够自发进行,则温度所满足的条件是
,该反应能够自发进行,则温度所满足的条件是(4)
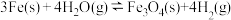 平衡常数的表达式为
平衡常数的表达式为 的平衡常数为49,则该温度下反应
的平衡常数为49,则该温度下反应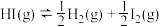 的平衡常数为
的平衡常数为
您最近一年使用:0次
2020-12-07更新
|
219次组卷
|
2卷引用:宁夏石嘴山市第三中学2020-2021学年高二上学期期中考试化学试题
解题方法
4 . (1)已知在 、
、 时,反应
时,反应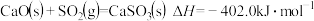 ,
,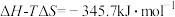 ,若该反应的
,若该反应的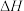 和
和 不随温度变化而变化,则保持该反应能自发进行的温度应低于
不随温度变化而变化,则保持该反应能自发进行的温度应低于_______ (结果保留整数)。
(2)已知: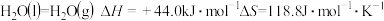 ,则水的沸点是
,则水的沸点是_______ (结果保留1位小数)。
(3)已知在 时,由石墨转化为金刚石的反应的
时,由石墨转化为金刚石的反应的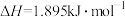 ,
,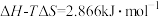 ,石墨的熵S石
,石墨的熵S石 ,则金刚石的熵S金=
,则金刚石的熵S金=________ ,这两种碳的同素异形体中更有序的是________ 。
 、
、 时,反应
时,反应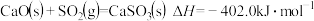 ,
,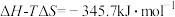 ,若该反应的
,若该反应的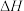 和
和 不随温度变化而变化,则保持该反应能自发进行的温度应低于
不随温度变化而变化,则保持该反应能自发进行的温度应低于(2)已知:
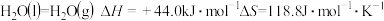 ,则水的沸点是
,则水的沸点是(3)已知在
 时,由石墨转化为金刚石的反应的
时,由石墨转化为金刚石的反应的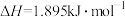 ,
,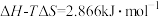 ,石墨的熵S石
,石墨的熵S石 ,则金刚石的熵S金=
,则金刚石的熵S金=
您最近一年使用:0次
2020-09-16更新
|
328次组卷
|
3卷引用:鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第1节 化学反应的方向
鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第1节 化学反应的方向(已下线)第2章能力提升测评卷-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)上海市嘉定区安亭高级中学2022-2023学年高二上学期期中考试化学试题
解题方法
5 . (1)磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)═6CaO(s)+P4(s)+10CO(g)△H1=+3359.26 kJ•mol﹣1
CaO(s)+SiO2(s)═CaSiO3(s)△H2=﹣89.61 kJ•mol﹣1
写出白磷(P4)由Ca3(PO4)2、焦炭和SiO2在一定条件下反应的热化学方程式为:_____ 。
(2)电子工业中清洗硅片上的SiO2(s)的反应为SiO2(s)+4HF(g)═SiF4(g)+2H2O(g)△H(298.15 K)=﹣94.0 kJ•mol﹣1△S(298.15 K)=﹣75.8 J•mol﹣1•K﹣1,设△H和△S不随温度而变化,此反应自发进行的温度是_____
白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)═6CaO(s)+P4(s)+10CO(g)△H1=+3359.26 kJ•mol﹣1
CaO(s)+SiO2(s)═CaSiO3(s)△H2=﹣89.61 kJ•mol﹣1
写出白磷(P4)由Ca3(PO4)2、焦炭和SiO2在一定条件下反应的热化学方程式为:
(2)电子工业中清洗硅片上的SiO2(s)的反应为SiO2(s)+4HF(g)═SiF4(g)+2H2O(g)△H(298.15 K)=﹣94.0 kJ•mol﹣1△S(298.15 K)=﹣75.8 J•mol﹣1•K﹣1,设△H和△S不随温度而变化,此反应自发进行的温度是
您最近一年使用:0次
解题方法
6 . 回答下列各题:
(1)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol,
②
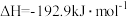 ,
,
③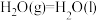

则表示氢气燃烧热的热化学方程式为________ 。
(2)判断下列反应的熵值是增大、减小还是几乎不变。
①2H2(g)+O2(g)=2H2O(l);熵________ (填“增大”“减小”“几乎不变”,下同)
②H2(g)+Cl2(g)=2HCl(g);熵________
③(NH4)2CO3(g)=NH4HCO3(g)+NH3(g);熵________
④Cu(s)+Cl2(g)=CuCl2(s);熵________
(1)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol,
②

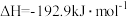 ,
,③
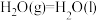

则表示氢气燃烧热的热化学方程式为
(2)判断下列反应的熵值是增大、减小还是几乎不变。
①2H2(g)+O2(g)=2H2O(l);熵
②H2(g)+Cl2(g)=2HCl(g);熵
③(NH4)2CO3(g)=NH4HCO3(g)+NH3(g);熵
④Cu(s)+Cl2(g)=CuCl2(s);熵
您最近一年使用:0次
名校
7 . 大气中CO2含量的增加会加剧温室效应,为减少其排放,需将工业生产中产生的CO2分离出来进行储存和利用。
(1)CO2与NH3反应可合成化肥尿素[化学式为CO(NH2)2],反应2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)在合成塔中进行。如图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比[
CO(NH2)2(l)+H2O(g)在合成塔中进行。如图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比[ ]和水碳比[
]和水碳比[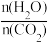 ]投料时二氧化碳转化率的情况。
]投料时二氧化碳转化率的情况。
①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值范围分别为0.6~0.7、1~1.1和1.5~1.61,则生产中应选用水碳比的数值范围为____ 。
②请推测生产中氨碳比控制在4.0左右还是控制在4.5左右比较适宜,并简述你的理由_____ 。
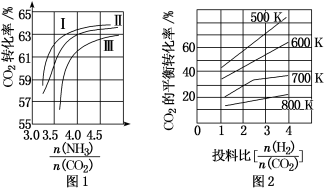
(2)CO2与H2也可用于合成甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。在体积可变的恒压密闭容器中,该反应在不同温度、不同投料比时,CO2的平衡转化率如图2所示。
CH3OH(g)+H2O(g)。在体积可变的恒压密闭容器中,该反应在不同温度、不同投料比时,CO2的平衡转化率如图2所示。
①该反应的化学平衡常数的表达式为_____ 。
②该反应的ΔS___ 0,ΔH___ 0(填“>”或“<”)。
③700K投料比[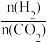 ]=2时,H2的平衡转化率为
]=2时,H2的平衡转化率为_____ 。
(1)CO2与NH3反应可合成化肥尿素[化学式为CO(NH2)2],反应2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(g)在合成塔中进行。如图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比[
CO(NH2)2(l)+H2O(g)在合成塔中进行。如图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比[ ]和水碳比[
]和水碳比[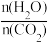 ]投料时二氧化碳转化率的情况。
]投料时二氧化碳转化率的情况。①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值范围分别为0.6~0.7、1~1.1和1.5~1.61,则生产中应选用水碳比的数值范围为
②请推测生产中氨碳比控制在4.0左右还是控制在4.5左右比较适宜,并简述你的理由

(2)CO2与H2也可用于合成甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。在体积可变的恒压密闭容器中,该反应在不同温度、不同投料比时,CO2的平衡转化率如图2所示。
CH3OH(g)+H2O(g)。在体积可变的恒压密闭容器中,该反应在不同温度、不同投料比时,CO2的平衡转化率如图2所示。①该反应的化学平衡常数的表达式为
②该反应的ΔS
③700K投料比[
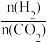 ]=2时,H2的平衡转化率为
]=2时,H2的平衡转化率为
您最近一年使用:0次
名校
8 . 反应A(g) 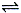 B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
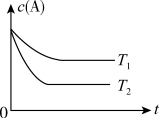
(1)上述反应的温度T1____ T2,平衡常数K(T1)____ K(T2)。(填“大于”、“小于”或“等于”)
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为________ 。
②反应的平衡常数K=_______ 。
③反应在0~5min区间的平均反应速率v(A)=________ 。
(3)已知1g FeS2完全燃烧放出7.1kJ热量,FeS2燃烧反应的热化学方程式为______ 。
(4)物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)2 2(t-BuNO) ΔH = 50.5 kJ·mol-1。该反应的ΔS
2(t-BuNO) ΔH = 50.5 kJ·mol-1。该反应的ΔS_____ 0(填“>”、“<”或“=”)。在______ 填“较高”或“较低”)温度下有利于该反应自发进行。
 B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
(1)上述反应的温度T1
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为
②反应的平衡常数K=
③反应在0~5min区间的平均反应速率v(A)=
(3)已知1g FeS2完全燃烧放出7.1kJ热量,FeS2燃烧反应的热化学方程式为
(4)物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)2
 2(t-BuNO) ΔH = 50.5 kJ·mol-1。该反应的ΔS
2(t-BuNO) ΔH = 50.5 kJ·mol-1。该反应的ΔS
您最近一年使用:0次
名校
9 . 甲醇是重要的化学工业基础原料和清洁液体燃料。已知制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=________ (用K1、K2表示)。
(2)反应③的ΔH_________ 0(填“>”或“<”)。
(3)500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正_____ v逆(填“>”、“=”或“<”)。
(4)500℃时2L密闭容器中投入a mol H2、b mol CO发生反应①;测得平衡时H2(g)、CO2(g)的浓度(mol·L-1)分别为0.2、0.1则:
①a=______ ,b=_________ ,平衡时H2的转换率为________ (保留一位有效数字)。
②若向平衡后的容器中再投入a mol H2、b mol CO,达平衡后,CH3OH的体积分数与原平衡相比______________ (填“增大”、“减小”或“不变”)
| 化学反应 | 平衡常数 | 温度/℃ | |
| 500 | 800 | ||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g)  H2O(g)+CO(g) H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) CH3OH(g)+H2O(g) CH3OH(g)+H2O(g) | K3 | ||
(2)反应③的ΔH
(3)500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正
(4)500℃时2L密闭容器中投入a mol H2、b mol CO发生反应①;测得平衡时H2(g)、CO2(g)的浓度(mol·L-1)分别为0.2、0.1则:
①a=
②若向平衡后的容器中再投入a mol H2、b mol CO,达平衡后,CH3OH的体积分数与原平衡相比
您最近一年使用:0次
名校
10 . 以CH4和 H2O为原料制备二甲醚和甲醇的工业流程如下:
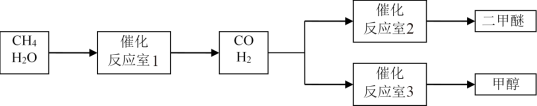
已知:2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
CH3OCH3 (g)+3O2(g)=2CO2(g)+3H2O (g) △H=-1323 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-484 kJ·mol-1
(1)反应室3中发生反应:CO(g)+2H2(g)=CH3OH(g)。该反应在一定条件下能自发进行的原因是_____ 。
(2)反应室2中发生反应:2CO(g)+4H2(g)=CH3OCH3(g)+H2O (g) △H=_____ 。
(3)以反应室1出来的CO和H2为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质构成的一种碳酸盐燃料电池如图所示。
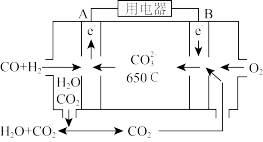
①该电池的正极反应式为______________ 。
②若电路中流过4 mol电子,则理论上消耗CO和H2的总体积为______ L(标准状况)。

已知:2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
CH3OCH3 (g)+3O2(g)=2CO2(g)+3H2O (g) △H=-1323 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-484 kJ·mol-1
(1)反应室3中发生反应:CO(g)+2H2(g)=CH3OH(g)。该反应在一定条件下能自发进行的原因是
(2)反应室2中发生反应:2CO(g)+4H2(g)=CH3OCH3(g)+H2O (g) △H=
(3)以反应室1出来的CO和H2为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质构成的一种碳酸盐燃料电池如图所示。

①该电池的正极反应式为
②若电路中流过4 mol电子,则理论上消耗CO和H2的总体积为
您最近一年使用:0次



