解题方法
1 . 次磷酸钠(NaH2PO2)是一种白色粉末,微溶于无水乙醇,不溶于乙醚,具有强还原性,酸性条件下易被氧化生成H3PO4.实验室使用白磷、熟石灰和碳酸钠溶液模拟工业制备两步法合成次磷酸钠晶体。
I.制备次磷酸钙[Ca(H2PO2)2]溶液:_____ ;
(2)将一定量的白磷和过量的熟石灰依次投入仪器a中,加水调成稀浆状,搅拌下加热升温到90℃,至无PH3,气体放出时停止反应。则a中发生反应的化学方程式是_____ ;
II.制备次磷酸钠(NaH2PO2)溶液:_____ ;
III.制备次磷酸钠晶体:
(4)过滤除去碳酸钙后将滤液蒸发浓缩,该操作需在_____ 条件下进行,再经过冷却结晶,制得次磷酸钠晶体。
IV.测定次磷酸钠纯度:
(5)测量步骤:称取8.8g样品溶于水配成25mL溶液置于锥形瓶中,再加盐酸25mL,准确加入c1mol∙L-1碘标准溶液V1mL,盖好瓶塞,放在暗处30min。打开瓶塞,用少量蒸馏水洗瓶颈及瓶塞后,以淀粉溶液作指示剂,用c2mol∙L-1硫代硫酸钠标准溶液进行滴定,消耗硫代硫酸钠溶液的体积为V2mL(已知I2+2Na2S2O3=Na2S4O6+2NaI)。
①判断达到滴定终点的现象是_____ ;
②晶体中NaH2PO2的质量分数是_____ (列出表达式)。
I.制备次磷酸钙[Ca(H2PO2)2]溶液:
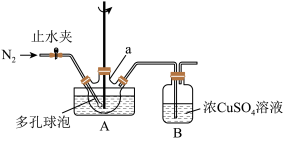
(2)将一定量的白磷和过量的熟石灰依次投入仪器a中,加水调成稀浆状,搅拌下加热升温到90℃,至无PH3,气体放出时停止反应。则a中发生反应的化学方程式是
II.制备次磷酸钠(NaH2PO2)溶液:
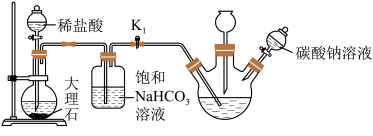
III.制备次磷酸钠晶体:
(4)过滤除去碳酸钙后将滤液蒸发浓缩,该操作需在
IV.测定次磷酸钠纯度:
(5)测量步骤:称取8.8g样品溶于水配成25mL溶液置于锥形瓶中,再加盐酸25mL,准确加入c1mol∙L-1碘标准溶液V1mL,盖好瓶塞,放在暗处30min。打开瓶塞,用少量蒸馏水洗瓶颈及瓶塞后,以淀粉溶液作指示剂,用c2mol∙L-1硫代硫酸钠标准溶液进行滴定,消耗硫代硫酸钠溶液的体积为V2mL(已知I2+2Na2S2O3=Na2S4O6+2NaI)。
①判断达到滴定终点的现象是
②晶体中NaH2PO2的质量分数是
您最近一年使用:0次
名校
解题方法
2 . 用中和滴定法测定某烧碱的纯度,试根据实验回答:
(1)称取5.0g烧碱样品。将样品配成 待测液,需要的主要玻璃仪器除烧杯、玻璃棒外还需
待测液,需要的主要玻璃仪器除烧杯、玻璃棒外还需___________ 。
(2)取 待测液,用
待测液,用___________ 量取。
(3)用 标准盐酸滴定待测烧碱溶液,以酚酞为指示剂,滴定终点的现象是
标准盐酸滴定待测烧碱溶液,以酚酞为指示剂,滴定终点的现象是___________ 。
(4)根据表中数据,计算样品烧碱的质量分数为___________ 。
(5)滴定过程,下列情况会使测定结果偏高的是___________ (填序号)。
①记录酸式滴定管起始体积时,仰视读数,终点时俯视
②碱式滴定管水洗后就用来量取待测液
③滴定前,酸式滴定管有气泡,滴定后消失
④锥形瓶水洗后,未用烧碱溶液润洗
(6)某学习小组用“间接碘量法”测定含有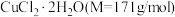 晶体的试样(不含能与
晶体的试样(不含能与 发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加过量KI固体,充分反应,生成白色沉淀,用
发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加过量KI固体,充分反应,生成白色沉淀,用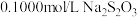 标准溶液滴定,到达滴定终点时,消耗
标准溶液滴定,到达滴定终点时,消耗 标准溶液
标准溶液 。已知:
。已知: ;
; ;试样中
;试样中 的质量分数为
的质量分数为___________ %。
(1)称取5.0g烧碱样品。将样品配成
 待测液,需要的主要玻璃仪器除烧杯、玻璃棒外还需
待测液,需要的主要玻璃仪器除烧杯、玻璃棒外还需(2)取
 待测液,用
待测液,用(3)用
 标准盐酸滴定待测烧碱溶液,以酚酞为指示剂,滴定终点的现象是
标准盐酸滴定待测烧碱溶液,以酚酞为指示剂,滴定终点的现象是(4)根据表中数据,计算样品烧碱的质量分数为
| 滴定次数 | 待测液体积( ) ) | 标准盐酸体积( ) ) | |
滴定前读数( ) ) | 滴定后读数( ) ) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 5.12 | 28.02 |
①记录酸式滴定管起始体积时,仰视读数,终点时俯视
②碱式滴定管水洗后就用来量取待测液
③滴定前,酸式滴定管有气泡,滴定后消失
④锥形瓶水洗后,未用烧碱溶液润洗
(6)某学习小组用“间接碘量法”测定含有
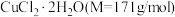 晶体的试样(不含能与
晶体的试样(不含能与 发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加过量KI固体,充分反应,生成白色沉淀,用
发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加过量KI固体,充分反应,生成白色沉淀,用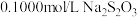 标准溶液滴定,到达滴定终点时,消耗
标准溶液滴定,到达滴定终点时,消耗 标准溶液
标准溶液 。已知:
。已知: ;
; ;试样中
;试样中 的质量分数为
的质量分数为
您最近一年使用:0次
2024-01-06更新
|
41次组卷
|
2卷引用:四川省眉山市仁寿第一中学校南校区2023-2024学年高二下学期3月月考化学试题
名校
3 . 工业废水中常含有一定量氧化性较强的 ,利用滴定原理测定
,利用滴定原理测定 含量(通常以1L废水中的微粒质量计量)的方法如下:
含量(通常以1L废水中的微粒质量计量)的方法如下:
步骤I:量取30.00mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤II:加入过量的碘化钾溶液充分反应: +6I-+14H+=2Cr3++3I2+7H2O
+6I-+14H+=2Cr3++3I2+7H2O
步骤III:向锥形瓶中滴入几滴指示剂。用滴定管量取0.1000mol/LNa2S2O3溶液进行滴定,数据记录如表:(I2+2Na2S2O3=2NaI+Na2S4O6)
(1)取Na2S2O3固体配制100mL0.1000mol/LNa2S2O3溶液需要的定量仪器有托盘天平、量筒和___________ 。
(2)步骤I量取30.00mL废水选择的仪器是___________ 。
(3)步骤III中滴加的指示剂为___________ ;滴定达到终点时的实验现象是___________ 。
(4)步骤III中a的读数如图所示,则:___________ mL。
②计算废水中 含量为
含量为___________ g/L。
(5)以下操作会造成废水中 含量测定值偏高的是___________(填字母)。
含量测定值偏高的是___________(填字母)。
 ,利用滴定原理测定
,利用滴定原理测定 含量(通常以1L废水中的微粒质量计量)的方法如下:
含量(通常以1L废水中的微粒质量计量)的方法如下:步骤I:量取30.00mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤II:加入过量的碘化钾溶液充分反应:
 +6I-+14H+=2Cr3++3I2+7H2O
+6I-+14H+=2Cr3++3I2+7H2O步骤III:向锥形瓶中滴入几滴指示剂。用滴定管量取0.1000mol/LNa2S2O3溶液进行滴定,数据记录如表:(I2+2Na2S2O3=2NaI+Na2S4O6)
| 滴定次数 | Na2S2O3溶液起始读数/mL | Na2S2O3溶液终点读数/mL |
| 第一次 | 1.02 | 19.03 |
| 第二次 | 2.00 | 19.99 |
| 第三次 | 0.20 | a |
(2)步骤I量取30.00mL废水选择的仪器是
(3)步骤III中滴加的指示剂为
(4)步骤III中a的读数如图所示,则:
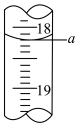
②计算废水中
 含量为
含量为(5)以下操作会造成废水中
 含量测定值偏高的是___________(填字母)。
含量测定值偏高的是___________(填字母)。| A.滴定终点读数时,俯视滴定管的刻度 |
| B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗 |
| C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 |
| D.量取Na2S2O3溶液的滴定管用蒸馏水洗后未用标准液润洗 |
您最近一年使用:0次
2023-04-29更新
|
195次组卷
|
2卷引用:四川省广元市川师大万达中学2023-2024学年高二下学期入学考试化学试题
名校
4 . 工业废水中常含有一定量氧化性较强的Cr2O72-,利用滴定原理测定Cr2O72-含量方法如下:
步骤Ⅰ:量取30.00 mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液充分反应:Cr2O72-+6I-+14H+=== 2Cr3++3I2+7H2O。
步骤Ⅲ:向锥形瓶中滴入几滴指示剂。用滴定管量取0.1000 mol•L-1Na2S2O3溶液进行滴定,数据记录如下:(I2+2Na2S2O3=== 2NaI+Na2S4O6)
(1)步骤Ⅰ量取30.00 mL废水选择的仪器是_____ 。
(2)步骤Ⅲ中滴加的指示剂为_____ 。滴定达到终点的实验现象是____ 。
(3)步骤Ⅲ中a的读数如图所示,则:
① a=_____ 。

② Cr2O72-的含量为____ g•L-1。
(4)以下操作会造成废水中Cr2O72-含量测定值偏高的是_____ 。
A.滴定终点读数时,俯视滴定管的刻度
B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.量取Na2S2O3溶液的滴定管用蒸馏水洗后未用标准液润洗
步骤Ⅰ:量取30.00 mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液充分反应:Cr2O72-+6I-+14H+=== 2Cr3++3I2+7H2O。
步骤Ⅲ:向锥形瓶中滴入几滴指示剂。用滴定管量取0.1000 mol•L-1Na2S2O3溶液进行滴定,数据记录如下:(I2+2Na2S2O3=== 2NaI+Na2S4O6)
| 滴定次数 | Na2S2O3溶液起始读数/mL | Na2S2O3溶液终点读数/mL |
| 第一次 | 1.02 | 19.03 |
| 第二次 | 2.00 | 19.99 |
| 第三次 | 0. 20 | a |
(1)步骤Ⅰ量取30.00 mL废水选择的仪器是
(2)步骤Ⅲ中滴加的指示剂为
(3)步骤Ⅲ中a的读数如图所示,则:
① a=

② Cr2O72-的含量为
(4)以下操作会造成废水中Cr2O72-含量测定值偏高的是
A.滴定终点读数时,俯视滴定管的刻度
B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.量取Na2S2O3溶液的滴定管用蒸馏水洗后未用标准液润洗
您最近一年使用:0次
2018-07-01更新
|
902次组卷
|
12卷引用:四川省广安市华蓥中学2023-2024学年高二下学期开学化学试题
四川省广安市华蓥中学2023-2024学年高二下学期开学化学试题 四川省内江市第六中学2022-2023学年高二下学期第一次月考化学试题【全国市级联考】江苏省宿迁市2017-2018学年高二下学期期末考试化学试题浙江省山河联盟2021-2022学年高二上学期12月考试化学试题河南省信阳高级中学2021-2022学年高一下学期第四次月考化学试题第二节 水的电离和溶液的pH 第3课时 酸碱中和滴定河南省鹤壁市第一中学2022-2023学年高二上学期期末检测化学试题重庆市铜梁一中等三校2022-2023学年高二上学期期末考试化学试题(已下线)题型43 氧化还原滴定—-重铬酸钾法内蒙古呼和浩特市第一中学2023-2024学年高二上学期期中考试化学试题浙江省嘉兴高级中学2023-2024学年高二上学期期中考试化学试题 内蒙古呼和浩特市回民区2023-2024学年高二上学期期中考试化学试题



