名校
1 . 下列实验设计的步骤及现象均正确的是
| 选项 | 实验目的 | 实验步骤及现象 |
| A | 证明氯水有酸性 | 试样 溶液变红色,且长时间不变 溶液变红色,且长时间不变 |
| B | 检验某红棕色气体是否为溴蒸气 | 试样 观察溶液是否变蓝 观察溶液是否变蓝 |
| C | 证明酸性条件下H2O2氧化性比 I2强 | NaI   溶液变蓝色 溶液变蓝色 |
| D | 比较: Ksp(AgCl)>Ksp(AgI) | AgNO3 溶液 产生白色沉淀 产生白色沉淀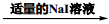 有黄色沉淀生成 有黄色沉淀生成 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
2 . 下列实验中,对现象的解释不正确 的是
| 选项 | A | B | C | D |
| 装置及操作 |  向右轻轻推动活塞压缩体积 | 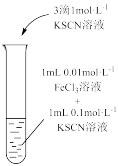 | 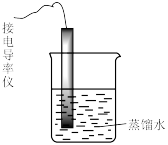 分别测定20℃和80℃蒸馏水的电导率 | 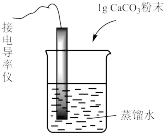 |
| 现象 | 气体红棕色先变深再变浅 | 溶液血红色加深 | 80℃蒸馏水的电导率大于20℃的 | 加入 粉末后电导率增大 粉末后电导率增大 |
| 解释 | 压强增大, 平衡先逆向移动,再正向移动 平衡先逆向移动,再正向移动 | 增大反应物浓度,  平衡正向移动 平衡正向移动 | 温度升高,水的电离平衡正向移动 |  在水中存在 在水中存在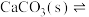  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-01-06更新
|
932次组卷
|
13卷引用:四川省德阳市什邡中学2023-2024学年高二上学期11月期中考试化学试题
四川省德阳市什邡中学2023-2024学年高二上学期11月期中考试化学试题北京海淀区2022-2023学年高二上学期期末考试化学试题北京一零一中学2022-2023高二上学期期末考试化学试题北京市首都师范大学附属中学2022-2023学年高二上学期期末考试化学试题北京市顺义牛栏山第一中学2022-2023学年高二下学期3月月考化学试题河南省濮阳市第一高级中学2022-2023学年高二下学期期中质量检测化学试题北京市顺义牛栏山第一中学2023-2024学年高二上学期期中考试化学试题北京市第三十五中学2023-2024学年高二上学期期中考试化学试题 北京市第十三中学2023-2024学年高二上学期期中考试化学试题北京师范大学附属中学2023-2024学年高二上学期期中考试化学试卷北京市第五十中学2023-2024学年高二上学期12月月考化学试题天津市部分区2023-2024学年高二上学期期末练习化学试题北京交通大学附属中学第二分校2023-2024学年高二上学期12月月考化学试题
解题方法
3 . 硝酸铜晶体[Cu(NO3)2•6H2O],是一种重要的化工原料,常用于农药、镀铜、搪瓷等工业。以辉铜矿(主要成分为Cu2S,含少量Fe2O3,、SiO2等杂质)为原料制备硝酸铜晶体的某工艺如图所示:

回答下列问题:
(1)“浸取”时,为了提高浸取率可采取的措施有____ (任写一点),浸取时在生成S的反应中还原剂与氧化剂的物质的量之比为____ 。
(2)滤渣2的主要成分是____ ,滤渣2与稀硝酸反应时,需向装置内通入适量空气,这样做的目的是____ 。
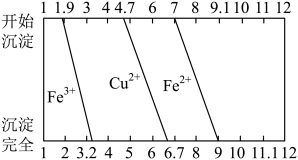
(3)调节溶液pH时选用的物质a可以是_____ ,几种金属离子沉淀的pH范围如图所示,“调pH”时应将溶液pH调至____ 。
(4)操作X主要包括____ 、____ 、过滤、洗涤、干燥。
(5)用碱性锌锰干电池为电源电解硝酸铜溶液可制得铜单质。请写出电解过程中阳极的电极反应式____ 。

回答下列问题:
(1)“浸取”时,为了提高浸取率可采取的措施有
(2)滤渣2的主要成分是
(3)调节溶液pH时选用的物质a可以是

(4)操作X主要包括
(5)用碱性锌锰干电池为电源电解硝酸铜溶液可制得铜单质。请写出电解过程中阳极的电极反应式
您最近一年使用:0次
名校
解题方法
4 . 以SO2、软锰矿(主要成分为MnO2,少量Fe、Al、Ca及Pb的化合物等)、氨水及净化剂等为原料可制备MnSO4液和Mn3O4,主要实验步骤如下
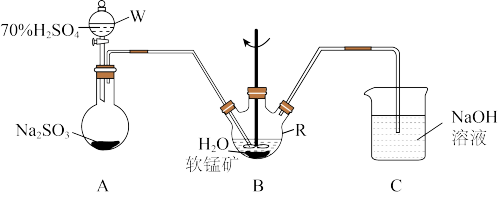
步骤I、如图所示装置,将SO2通入B中的软锰矿浆液中(MnO2+SO2=MnSO4)。
步骤II、充分反应后,在不断搅拌下依次向仪器R中加入适量纯净的MnO2、MnCO3,最后加入适量Na2S沉铅,
步骤III、过滤得MnSO4溶液
(1)仪器R的名称是_______ 。
(2)装置A用于制取SO2,反应的化学方程式为_________ 。
(3)装置B中的反应应控制在90~100℃,适宜的加热方式是______________ 。
(4)装置C的作用是______________________ 。
(5)“步骤Ⅱ”中加入纯净MnO2的目的是_______________ ,用MnCO3调节溶液pH时,需调节溶液pH的范围为________ (该实验条件下,部分金属离子开始沉淀和沉淀完全的pH如下表)
(6)已知①用空气氧化Mn(OH)2浊液可制备Mn3O4[6Mn(OH)2+O2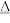 2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响分别如图所示
2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响分别如图所示
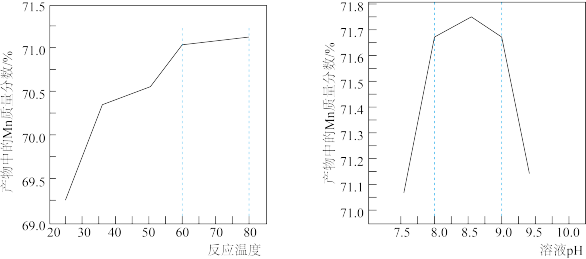
②反应温度超过80℃时,Mn3O4的产率开始降低,Mn(OH)2是白色沉淀,Mn3O4呈黑色;Mn3O4、MnOOH中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到MnSO4溶液,并用氨水等制备较纯净的Mn3O4的实验方案:______________________ ,真空干燥6小时得产品Mn3O4。

步骤I、如图所示装置,将SO2通入B中的软锰矿浆液中(MnO2+SO2=MnSO4)。
步骤II、充分反应后,在不断搅拌下依次向仪器R中加入适量纯净的MnO2、MnCO3,最后加入适量Na2S沉铅,
步骤III、过滤得MnSO4溶液
(1)仪器R的名称是
(2)装置A用于制取SO2,反应的化学方程式为
(3)装置B中的反应应控制在90~100℃,适宜的加热方式是
(4)装置C的作用是
(5)“步骤Ⅱ”中加入纯净MnO2的目的是
| 金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
| 开始沉淀的pH | 7.04 | 1.87 | 3.32 | 7.56 |
| 沉淀完全的pH | 9.18 | 3.27 | 4.9 | 10.2 |
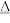 2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响分别如图所示
2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响分别如图所示
②反应温度超过80℃时,Mn3O4的产率开始降低,Mn(OH)2是白色沉淀,Mn3O4呈黑色;Mn3O4、MnOOH中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到MnSO4溶液,并用氨水等制备较纯净的Mn3O4的实验方案:
您最近一年使用:0次



