名校
解题方法
1 . 制备锂离子电池的正极材料的前体 的一种流程如下:
的一种流程如下:

资料:i.磷灰石的主要成分是
ii. 可溶于水,
可溶于水, 微溶于水
微溶于水
ii.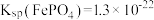
iv.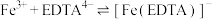
(1)制备
①用 溶液、
溶液、 溶液
溶液分步 浸取磷灰石生成HF、 和
和 ,主要反应是
,主要反应是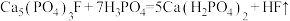 和
和_______ 。
②增大酸浸反应速率的措施有_______ (只写1条)。
③其他条件不变时,若仅用 溶液酸浸,浸取的速率低于用
溶液酸浸,浸取的速率低于用 、
、 分步浸取法,原因是
分步浸取法,原因是_______ 。
(2)制备
将 、
、 、
、 混合并调节溶液的pH制备
混合并调节溶液的pH制备 。
。
①酸性条件下,生成 的离子方程式是
的离子方程式是_______ 。
②含磷各微粒的物质的量分数与pH的关系如图。
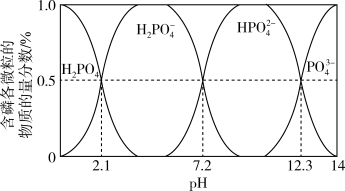
pH=1时,溶液中的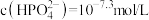 ,则
,则
_______  。再加入
。再加入 晶体、
晶体、 溶液使溶液中的
溶液使溶液中的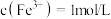 ,不考虑溶液体积的变化,通过计算说明此时能否产生
,不考虑溶液体积的变化,通过计算说明此时能否产生 沉淀
沉淀_______ 。
③ 的纯度及颗粒大小会影响其性能,沉淀速率过快容易团聚。
的纯度及颗粒大小会影响其性能,沉淀速率过快容易团聚。
ⅰ.研究表明,沉淀时可加入含 的溶液,
的溶液, 的作用是
的作用是_______ 。
ⅱ.其他条件不变时,工业上选择pH=2而不是更高的pH制备 ,可能的原因是
,可能的原因是_______ (答出2点)。
 的一种流程如下:
的一种流程如下:
资料:i.磷灰石的主要成分是

ii.
 可溶于水,
可溶于水, 微溶于水
微溶于水ii.
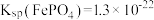
iv.
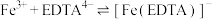
(1)制备

①用
 溶液、
溶液、 溶液
溶液 和
和 ,主要反应是
,主要反应是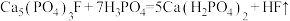 和
和②增大酸浸反应速率的措施有
③其他条件不变时,若仅用
 溶液酸浸,浸取的速率低于用
溶液酸浸,浸取的速率低于用 、
、 分步浸取法,原因是
分步浸取法,原因是(2)制备

将
 、
、 、
、 混合并调节溶液的pH制备
混合并调节溶液的pH制备 。
。①酸性条件下,生成
 的离子方程式是
的离子方程式是②含磷各微粒的物质的量分数与pH的关系如图。

pH=1时,溶液中的
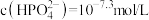 ,则
,则
 。再加入
。再加入 晶体、
晶体、 溶液使溶液中的
溶液使溶液中的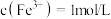 ,不考虑溶液体积的变化,通过计算说明此时能否产生
,不考虑溶液体积的变化,通过计算说明此时能否产生 沉淀
沉淀③
 的纯度及颗粒大小会影响其性能,沉淀速率过快容易团聚。
的纯度及颗粒大小会影响其性能,沉淀速率过快容易团聚。ⅰ.研究表明,沉淀时可加入含
 的溶液,
的溶液, 的作用是
的作用是ⅱ.其他条件不变时,工业上选择pH=2而不是更高的pH制备
 ,可能的原因是
,可能的原因是
您最近一年使用:0次
2022-04-10更新
|
920次组卷
|
7卷引用:四川省邻水实验学校2021-2022学年高二下学期第二次月考理综化学试题
四川省邻水实验学校2021-2022学年高二下学期第二次月考理综化学试题北京市西城区2022届高三一模化学试题(已下线)三轮冲刺卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)北京市第八中学2022-2023 学年高三上学期12 月月考化学试题北京市八一学校2022-2023学年高三上学期12月月考化学试题(已下线)北京市第四中学2023-2024学年高二上学期期中考试化学试题北京师范大学附属中学2023-2024学年高二上学期期末考试化学试卷
2 . 次磷酸钠(NaH2PO2)可用于化学镀银、镍、铬等,工业上以泥磷(主要含有P4和少量CaO、Fe2O3、Al2O3、CaCl2等)为原料制备NaH2PO2·H2O的流程如下图所示:
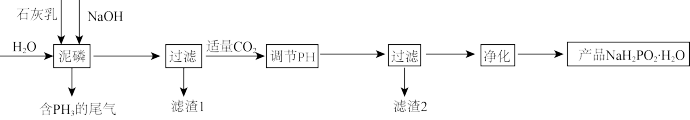
已知:(1)P4与碱反应生成相应的次磷酸盐和PH3;(2) 具有极强的还原性。
具有极强的还原性。
回答下列问题:
(1)已知次磷酸(H3PO2)为一元酸,则NaH2PO2是_______ (填“正盐”或“酸式盐”)。
(2)写出P4与NaOH溶液反应的化学方程式_______ 。
(3)尾气中的PH3可被NaClO氧化为NaH2PO2,氧化1mol PH3需要NaClO_______ g。
(4)滤渣1主要含有_______ ;通入CO2调节pH后会得到两种沉淀,分别是_______ ,写出生成其中一种沉淀的离子反应方程式_______ 。
(5)净化时加入Ag2SO4溶液等用以除去其中的Cl-,原理是_______ ,加入Ag2SO4过多会使产率降低,原因是_______ 。

已知:(1)P4与碱反应生成相应的次磷酸盐和PH3;(2)
 具有极强的还原性。
具有极强的还原性。回答下列问题:
(1)已知次磷酸(H3PO2)为一元酸,则NaH2PO2是
(2)写出P4与NaOH溶液反应的化学方程式
(3)尾气中的PH3可被NaClO氧化为NaH2PO2,氧化1mol PH3需要NaClO
(4)滤渣1主要含有
(5)净化时加入Ag2SO4溶液等用以除去其中的Cl-,原理是
您最近一年使用:0次
名校
解题方法
3 . 活性炭载钯(Pd/C)催化剂被广泛应用于医药和化工行业,某废钯催化剂(钯碳)的杂质主要含炭、有机物及少量Fe等。如图是利用钯碳制备氯化钯(PdCl2)和Pd的流程。

回答下列问题:
(1)“钯灰”中的主要成分有PdO,加入甲酸(HCOOH),可以将PdO还原成金属单质,请写出HCOOH还原PdO的化学方程式___________ 。
(2)“焚烧”的目的是____ ;实验室中可在___________ (填仪器名称)中模拟该过程。
(3)王水是将浓盐酸和浓硝酸混合而得到的强氧化性溶液,加热条件下钯在王水中发生反应生成H2[PdCl4]和一种有毒的无色气体A,该气体遇空气变红棕色,该反应中消耗的HCl与HNO3的物质的量之比为___________ 。
(4)加入浓氨水,调节溶液pH至9.0,并控制温度在70 ~75℃,Pd元素以 的形式存在:
的形式存在:
①若温度大于75℃,则不利于除铁,原因是___________
②已知:黄色晶体的成分为 ,在合并液中加盐酸时,发生反应的离子方程式为
,在合并液中加盐酸时,发生反应的离子方程式为___________ 。
(5)洗涤滤渣并将洗涤液与滤液合并,其意义是___________ 。
(6)Pd是优良的储氢金属,假设海绵状金属钯密度为,ρg·cm-3标准状况下其吸附的氢气是其体积的n倍,则此条件下海绵钯的储氢容量R=___________ mL·g-1(储氢容量R即1g钯吸附氢气的体积)。

回答下列问题:
(1)“钯灰”中的主要成分有PdO,加入甲酸(HCOOH),可以将PdO还原成金属单质,请写出HCOOH还原PdO的化学方程式
(2)“焚烧”的目的是
(3)王水是将浓盐酸和浓硝酸混合而得到的强氧化性溶液,加热条件下钯在王水中发生反应生成H2[PdCl4]和一种有毒的无色气体A,该气体遇空气变红棕色,该反应中消耗的HCl与HNO3的物质的量之比为
(4)加入浓氨水,调节溶液pH至9.0,并控制温度在70 ~75℃,Pd元素以
 的形式存在:
的形式存在:①若温度大于75℃,则不利于除铁,原因是
②已知:黄色晶体的成分为
 ,在合并液中加盐酸时,发生反应的离子方程式为
,在合并液中加盐酸时,发生反应的离子方程式为(5)洗涤滤渣并将洗涤液与滤液合并,其意义是
(6)Pd是优良的储氢金属,假设海绵状金属钯密度为,ρg·cm-3标准状况下其吸附的氢气是其体积的n倍,则此条件下海绵钯的储氢容量R=
您最近一年使用:0次
4 . 钒酸钇(YVO4)广泛应用于光纤通信领域,一种用废钒催化剂(含V2O3、K2O、SiO2、少量Fe2O3)制取YVO4的工艺流程如下:
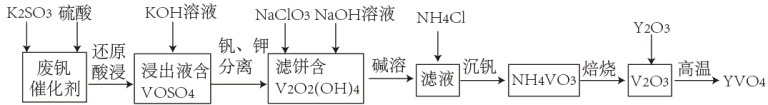
已知:V2O2(OH)4既能与强酸反应,又能与强碱反应。
25℃,浸取液中部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
回答下列问题:
(1)“还原酸浸”时,钒以VO2+浸出,“浸出液”中含有的金属离子是_______ 。V2O5被还原的离子方程式为_______ 。
(2)常温下,“钒、钾分离”时为了提高钒的沉淀率,应调节pH_______ 7(填“>”“<”或“=”)。
(3)结合“碱溶”和“沉钒”可知, 、
、 中
中_______ 的氧化性更强,“沉钒”时发生反应的化学方程式为_______ 。
(4)利用上述表格数据,计算Fe(OH)2的Ksp=_______ 。
(5)某工厂用该工艺流程生产YVO4,当用去1吨该废钒催化剂(V2O5的含量为26.0%)时,得到408kg,YVO4,则整个流程中V的损耗率为_______ 。

已知:V2O2(OH)4既能与强酸反应,又能与强碱反应。
25℃,浸取液中部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
| 阳离子 | VO2+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.01mo/L)的pH | 3.0 | 2.2 | 7.5 |
| 沉淀完全时(c=1.0×10-5mol/L)的pH | 7.0 | 3.2 | 9.0 |
回答下列问题:
(1)“还原酸浸”时,钒以VO2+浸出,“浸出液”中含有的金属离子是
(2)常温下,“钒、钾分离”时为了提高钒的沉淀率,应调节pH
(3)结合“碱溶”和“沉钒”可知,
 、
、 中
中(4)利用上述表格数据,计算Fe(OH)2的Ksp=
(5)某工厂用该工艺流程生产YVO4,当用去1吨该废钒催化剂(V2O5的含量为26.0%)时,得到408kg,YVO4,则整个流程中V的损耗率为
您最近一年使用:0次



