解题方法
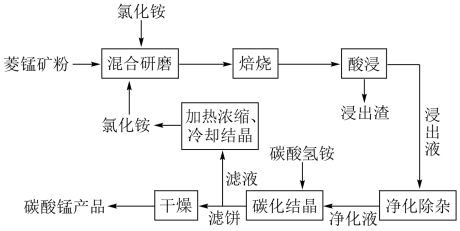
1 . 工业采用氯化铵焙烧菱锰矿制备高纯碳酸锰的流程如图所示: 其余为
其余为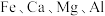 等元素。
等元素。
②部分阳离子沉淀时溶液的 :
:
③“焙烧”过程中主要反应为 。
。
(1)结合图1、2、3,分析“焙烧”过程中最佳的焙烧温度、焙烧时间、 分别为
分别为___________ 、___________ 、___________ 。 ,作用是
,作用是___________ ,再调节溶液 的范围为
的范围为___________ ,将 和
和 变为沉淀而除去,然后加入
变为沉淀而除去,然后加入 将
将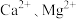 变为氟化物沉淀除去。
变为氟化物沉淀除去。
(3)“碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为___________ 。
(4)上述流程中可循环使用的物质是___________ (填化学式)。
(5)现用滴定法测定产品中锰的含量。实验步骤:称取 试样,向其中加入稍过量的磷酸和硝酸,加热使产品中
试样,向其中加入稍过量的磷酸和硝酸,加热使产品中 完全转化为
完全转化为 (其中
(其中 转化为
转化为 );加入稍过量的硫酸铵,发生反应
);加入稍过量的硫酸铵,发生反应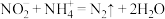 以除去
以除去 ;加入稀硫酸酸化,用
;加入稀硫酸酸化,用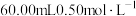 硫酸亚铁铵标准溶液进行滴定,发生的反应为
硫酸亚铁铵标准溶液进行滴定,发生的反应为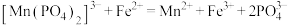 ;用
;用 酸性
酸性 溶液恰好除去过量的
溶液恰好除去过量的 。
。
①酸性 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为___________ 。
②试样中锰的质量分数为___________ 。
 其余为
其余为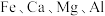 等元素。
等元素。②部分阳离子沉淀时溶液的
 :
:| 离子 |  |  |  |  |  |
开始沉淀的 | 4.1 | 2.2 | 10.6 | 8.1 | 9.1 |
沉淀完全的 | 4.7 | 3.2 | 13.1 | 10.1 | 11.1 |
 。
。(1)结合图1、2、3,分析“焙烧”过程中最佳的焙烧温度、焙烧时间、
 分别为
分别为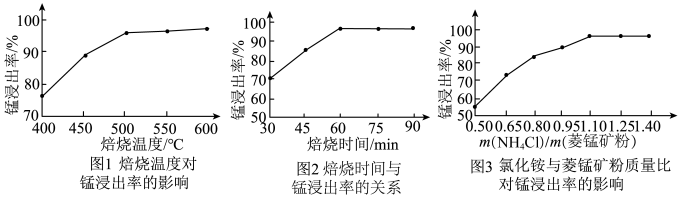
 ,作用是
,作用是 的范围为
的范围为 和
和 变为沉淀而除去,然后加入
变为沉淀而除去,然后加入 将
将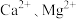 变为氟化物沉淀除去。
变为氟化物沉淀除去。(3)“碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为
(4)上述流程中可循环使用的物质是
(5)现用滴定法测定产品中锰的含量。实验步骤:称取
 试样,向其中加入稍过量的磷酸和硝酸,加热使产品中
试样,向其中加入稍过量的磷酸和硝酸,加热使产品中 完全转化为
完全转化为 (其中
(其中 转化为
转化为 );加入稍过量的硫酸铵,发生反应
);加入稍过量的硫酸铵,发生反应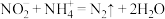 以除去
以除去 ;加入稀硫酸酸化,用
;加入稀硫酸酸化,用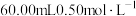 硫酸亚铁铵标准溶液进行滴定,发生的反应为
硫酸亚铁铵标准溶液进行滴定,发生的反应为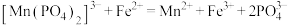 ;用
;用 酸性
酸性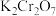 溶液恰好除去过量的
溶液恰好除去过量的 。
。①酸性
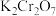 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为②试样中锰的质量分数为
您最近一年使用:0次
2024-04-15更新
|
85次组卷
|
2卷引用:2024届四川省雅安市天全中学高三下学期模拟预测化学试题
解题方法
2 . 三氧化二镍(Ni2O3)是重要的电子元件材料和蓄电池材料,工业上利用含镍废料(主要成分为镍、铝、氧化铁、碳等)提取Ni2O3,工艺流程如下:
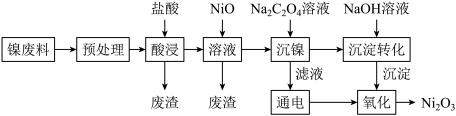
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②实际生产温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O。
③相关金属离子生成氢氧化物沉淀的pH如下(开始沉淀的pH按金属离子的浓度为1mol·L-1计算):
(1)“预处理”操作选择用酒精清洗的目的是_______ 。
(2)“酸浸”时,①温度不宜过高,原因_______ 。
②常温下,盐酸的浓度为2.5mol·L-1,“液固比”与镍的浸出率的关系如图所示,实际生产采取的“液固比”为_______ ,主要的原因是_______ 。

(3)室温下,“浸出”所得溶液中Fe3+的浓度为0.2mol·L-1,当溶液的pH调到2时,c(Fe3+)=_______ 。加NiO调节pH的范围为_______ 。(已知:Ksp[Fe(OH)3]=4.0×10-38)
(4)加入Na2C2O4溶液“沉镍”得到的沉淀为_______ 。
(5)电解过程中产生的氯气在碱性条件下生成ClO-,再把二价镍氧化为三价镍,写出“氧化”反应的离子反应方程式_______ 。

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②实际生产温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O。
③相关金属离子生成氢氧化物沉淀的pH如下(开始沉淀的pH按金属离子的浓度为1mol·L-1计算):
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | Fe(OH)2 |
| 开始沉淀时pH | 1.8 | 3.0 | 7.1 | 5.8 |
| 完全沉淀时pH | 3.2 | 5.0 | 9.2 | 8.0 |
(2)“酸浸”时,①温度不宜过高,原因
②常温下,盐酸的浓度为2.5mol·L-1,“液固比”与镍的浸出率的关系如图所示,实际生产采取的“液固比”为

(3)室温下,“浸出”所得溶液中Fe3+的浓度为0.2mol·L-1,当溶液的pH调到2时,c(Fe3+)=
(4)加入Na2C2O4溶液“沉镍”得到的沉淀为
(5)电解过程中产生的氯气在碱性条件下生成ClO-,再把二价镍氧化为三价镍,写出“氧化”反应的离子反应方程式
您最近一年使用:0次
2021-06-10更新
|
939次组卷
|
3卷引用:四川省雅安市2021届高三下学期5月第三次诊断考试理综化学试题
名校
3 . CoCl2可用于电镀,是一种性能优越的电池前驱材料,由含钴矿(Co元素主要以Co2O3、CoO存在,还含有Fe、Si、Cu、Zn、Mn、Ni、Mg、Ca元素)制取氯化钴晶体的一种工艺流程如下:
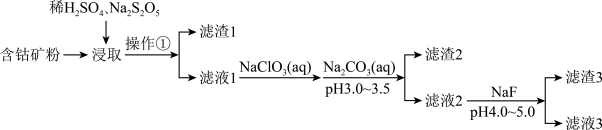
已知:①焦亚硫酸钠Na2S2O5,常做食品抗氧化剂。CaF2、MgF2难溶于水。
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110—120℃时,失去结晶水变成有毒的无水氯化钴。
③部分金属离子形成氢氧化物的pH见下表:
回答下列问题:
(1)操作①的名称为_________ ,NaClO3具有氧化性,其名称为__________________ 。
(2)浸取中加入Na2S2O5的作用是___________________________ 。
(3)滤液1中加入NaClO3的作用是_______________________________________ ,相关的离子方程式为__________________________________________ 。
(4)加入Na2CO3溶液生成滤渣2的主要离子方程式为___________________________ 。
(5)滤渣3主要成分为________________________ (写化学式)。
滤液3经过多次萃取与反萃取制备CoCl2晶体
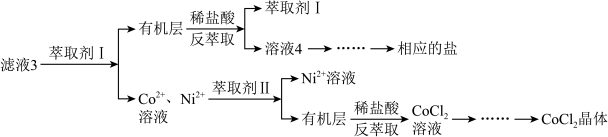
(6)滤液3中加入萃取剂I,然后用稀盐酸反萃取的目的是_______________________ 。
(7)制备晶体CoCl2·6H2O,需在减压环境下烘干的原因是_________________________________ 。

已知:①焦亚硫酸钠Na2S2O5,常做食品抗氧化剂。CaF2、MgF2难溶于水。
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110—120℃时,失去结晶水变成有毒的无水氯化钴。
③部分金属离子形成氢氧化物的pH见下表:
| Co3+ | Fe3+ | Cu2+ | Co2+ | Fe2+ | Zn2+ | Mn2+ | Mg2+ | |
| 开始沉淀pH | 0.3 | 2.7 | 5.5 | 7.2 | 7.6 | 7.6 | 8.3 | 9.6 |
| 完全沉淀pH | 1.1 | 3.2 | 6.6 | 9.2 | 9.6 | 9.2 | 9.3 | 11.1 |
回答下列问题:
(1)操作①的名称为
(2)浸取中加入Na2S2O5的作用是
(3)滤液1中加入NaClO3的作用是
(4)加入Na2CO3溶液生成滤渣2的主要离子方程式为
(5)滤渣3主要成分为
滤液3经过多次萃取与反萃取制备CoCl2晶体

(6)滤液3中加入萃取剂I,然后用稀盐酸反萃取的目的是
(7)制备晶体CoCl2·6H2O,需在减压环境下烘干的原因是
您最近一年使用:0次
2019-09-07更新
|
277次组卷
|
2卷引用:四川省雅安市雅安中学2020届高三上学期开学摸底考试(9月)化学试题
4 . 某化学实验室以一种工业上的废渣(废渣主要含有MgCO3、MgSiO3和少量Fe、Al的氧化物)为原料,制备MgCO3·3H2O。实验流程如下图所示:

(1)为了加快废渣的酸溶速率,可采取的办法有_________ (任写一点),酸溶时废渣中主要成分发生反应的离子方程式为___________________________________ 。
(2)加入30%H2O2的目的是__________________________________ 。
(3)用萃取分液的方法除去溶液中的Fe3+
萃取分液完成后,检验水相中是否含有Fe3+的最佳试剂是__________________________ 。
(4)室温下,除去MgSO4溶液中的A13+(使Al3+浓度小于1×10-6mol/L)而不引入其它杂质,应加入的试剂X为__________ ,应调节pH的范围为_________________ 。
已知:①Ksp[Al(OH)3]=1.0×10-33 ②pH=8.5 时,Mg(OH)2开始沉淀
(5)下图为不同反应温度下所得水合碳酸镁的X射线衍射谱图。由图可知,干燥时需控制温度范围为___________________ ,温度较高时MgCO3·3H2O发生转化的化学方程式为_______________________________ 。


(1)为了加快废渣的酸溶速率,可采取的办法有
(2)加入30%H2O2的目的是
(3)用萃取分液的方法除去溶液中的Fe3+
萃取分液完成后,检验水相中是否含有Fe3+的最佳试剂是
(4)室温下,除去MgSO4溶液中的A13+(使Al3+浓度小于1×10-6mol/L)而不引入其它杂质,应加入的试剂X为
已知:①Ksp[Al(OH)3]=1.0×10-33 ②pH=8.5 时,Mg(OH)2开始沉淀
(5)下图为不同反应温度下所得水合碳酸镁的X射线衍射谱图。由图可知,干燥时需控制温度范围为

您最近一年使用:0次



